壳聚糖对泥鳅毒性及其引发急性死亡分析
王泽颢,顾 双,王向阳*,潘 炎,王煌明,陈颜龙
(1.浙江大学信息与电子工程学院,浙江 杭州 310012;2.浙江大学生物系统工程与食品科学学院,浙江 杭州 310012;3.浙江工商大学食品与生物工程学院,浙江 杭州 310018;4.浙江省杭州市第二中学,浙江 杭州 330100)
甲壳素是从虾蟹、真菌等提取,经脱乙酰变成壳聚糖,已用作食品添加剂、水处理剂、饲料添加剂、医学上创伤敷料等。壳聚糖作为天然抑菌剂,已广泛应用于食品防腐保鲜[1]。GB 2760—2014《食品安全国家标准食品添加剂使用标准》[2]规定壳聚糖在西式火腿类、肉灌肠类中最大使用量为6 g/kg。李冬等[3]开展壳聚糖微球对小鼠急性毒性与长期毒性实验,发现小鼠全部存活,未见异常及死亡,进而对家兔进行急性毒性实验、皮肤刺激实验和长期毒性实验,均未发现兔的采食量、行为外观及粪便异常。张荣等[4]开展壳聚糖对小鼠长期毒性实验、小鼠嗜多染红细胞微核实验、Ames实验和小鼠精子畸变实验,均没有发现任何毒性反应。
然而,本实验室偶然发现壳聚糖会导致泥鳅快速死亡,目前鲜有报道壳聚糖会致死泥鳅或其他动物。预实验选用虾、鲫鱼、泥鳅和黄颡鱼,发现壳聚糖能引起泥鳅急性死亡,黄颡鱼死亡提早,而虾、鲫鱼对壳聚糖不敏感。泥鳅是食品原料,在生物分类学上属鲤形目、鳅科、泥鳅属,具有适应性强、疾病少、成活率高等特点,适合做生物安全性研究,常被用于水体污染物监测实验[5]。刘安军等[6]选用水溶性低分子质量壳聚糖对小鼠做腹腔注射致脱毛实验,得出壳聚糖导致鼠脱毛与肾毒性相关。
目前公认壳聚糖能够抑制细菌、真菌生长,且对植物和动物的细胞是安全的,但壳聚糖抑菌和对动植物安全性机制还未完全清楚。壳聚糖能够引起泥鳅急性死亡,说明壳聚糖对动物的安全性可能还有漏洞,通过找出壳聚糖致死泥鳅原因,有利于减轻对壳聚糖副作用的担忧,并了解其是否会在特殊状态下对人类产生危害。
1 材料与方法
1.1 材料与试剂
泥鳅(每尾约15 g,体长约11.6 cm),体质量差异在1.5 g以内,购自杭州文二街农贸市场、杭州下沙农贸市场等。
水溶性壳聚糖(脱乙酰度≥90%)、高分子质量壳聚糖(脱乙酰度≥90%)、低分子质量壳聚糖(脱乙酰度≥80%) 青岛弘海生物技术有限公司;海藻酸钠青岛明月海藻集团有限公司。
1.2 仪器与设备
SO-200-D红外线二氧化碳分析仪 北京金信诚有限责任公司;RSS-5100溶解氧仪 华辰乐天生物实验设备(北京)有限公司;XSH-1A倒置显微镜 上海硕光电子科技有限公司;ZDJ-5自动滴定仪(配备检测电极和参比电极) 上海仪电科学仪器股份有限公司;HI2300电导率仪 意大利HANNA公司。
1.3 方法
1.3.1 样品处理
泥鳅购买后置于塑料培养箱中,用经过曝气处理的自来水常温驯养7 d,每天换水并去除不活泼或生病状态的泥鳅。所用批次的泥鳅死亡率不超过5%。
除特殊说明外,壳聚糖均采用水溶性壳聚糖,以去离子水溶解,0.1 mol/L NaOH溶液调至pH 6.0,水温28 ℃,每组泥鳅为20 尾,置于1 L壳聚糖溶液中,对照组采用曝气处理的自来水。实验重复3 次。
1.3.2 壳聚糖种类、质量浓度及温度对泥鳅死亡时间的影响
1.3.2.1 壳聚糖种类
处理组分别取5 g/L水溶性壳聚糖溶液、低分子质量壳聚糖溶液、高分子质量壳聚糖溶液,后2 种壳聚糖以体积分数0.3%醋酸溶液溶解,并调至pH 6.0。将泥鳅分别置于上述溶液,其他处理同1.3.1节。
1.3.2.2 壳聚糖质量浓度
处理组分别取0、1、5、10 g/L壳聚糖溶液,将泥鳅分别置于上述溶液,其他处理同1.3.1节。
1.3.2.3 壳聚糖溶液温度
处理组取5 g/L壳聚糖,水温设为12 ℃和28 ℃,将泥鳅分别置于上述溶液,其他处理同1.3.1节。
1.3.3 壳聚糖对泥鳅毒性评价实验
每组20 尾泥鳅放入1 L梯度质量浓度(0.5、1、2、4、8、16、32、64、128、256、512 mg/L)壳聚糖溶液,每24 h更换一次处理液,实验期间曝气,但不喂食。观察并记录96 h后各组泥鳅死亡和中毒症状,得到96 h泥鳅的绝对死亡浓度(absolute lethal concentration,LC100)和全部存活的最大浓度(即最大耐受浓度)。根据所得LC100和最大耐受浓度,设置质量浓度:2、4、8、16、32、64 mg/L和128 mg/L[7]。于96 h后统计死亡率,用寇氏法[8]计算96 h半致死浓度(half lethal concentration,LC50)。
1.3.4 非壳聚糖因素排除实验
1.3.4.1 杂质的影响
将5 g壳聚糖以100 mL体积分数85%乙醇溶液浸泡1 h后,5 000 r/min、4 ℃离心10 min取沉淀,重复提取3 次。沉淀挥发乙醇后,65 ℃烘干,得到提纯后的壳聚糖。500 mL的1%壳聚糖溶液中加入1 mol/L NaOH溶液以沉淀壳聚糖,调pH值至9.0,5 000 r/min、4 ℃离心10 min取上清液,用0.1 mol/L HCl溶液调上清液pH值至6.0,得到去除壳聚糖的杂质溶液。将泥鳅分别置于5 g/L未提纯壳聚糖、5 g/L提纯后的壳聚糖、去除壳聚糖的杂质溶液。将泥鳅分别置于上述溶液,其他处理同1.3.1节。
1.3.4.2 pH值的影响
市售水溶性壳聚糖常含有少量H C l。处理组分别为未调pH值(pH 4.7)、pH 5.5、pH 6.0(以0.1 mol/L NaOH溶液调pH值)的5 g/L壳聚糖溶液,对照组分别为pH 4.7、pH 5.5、pH 6.0的0.05 mol/L磷酸盐缓冲液及相同pH值梯度的0.05 mol/L HCl溶液(以0.1 mol/L NaOH溶液调pH值)。将泥鳅分别置于上述溶液,其他处理同1.3.1节。
1.3.4.3 聚合物对鱼鳃的影响
分别配制5 g/L壳聚糖、海藻酸钠、阿拉伯树胶溶液,以0.1 mol/L NaOH溶液或0.1 mol/L HCl溶液调至pH 6.0,并采用黏度计测定溶液黏度。将泥鳅分别置于上述溶液,其他处理同1.3.1节。
1.3.4.4 溶解氧的影响
将泥鳅分别置于5 g/L壳聚糖和曝气处理的自来水中,水温12 ℃,观察溶液外观变化,测定0、0.5、2.5、4.0 h时溶解氧质量浓度。
充气处理实验:将泥鳅置于5 g/L壳聚糖溶液中,处理组接入空气泵,持续充气,对照组不充气,水温28 ℃,记录泥鳅死亡时间。
1.3.5 壳聚糖对泥鳅生理指标的影响
1.3.5.1 泥鳅器官损伤观察
5 g/L壳聚糖处理泥鳅1 h。取濒临死亡的泥鳅和未处理对照。对泥鳅进行解剖,显微观察鱼鳃、内脏、头部组织,并对鱼鳃显微拍照。剪断泥鳅尾部,取血滴于载玻片上,观察血液色泽和凝血时间。
1.3.5.2 泥鳅体表黏液残余率的测定
各取6 尾泥鳅投入1、5、10 g/L壳聚糖溶液和曝气处理的自来水,3 h后取出,纱布吸干泥鳅体表水分,称体质量(m0),用固体NaCl擦拭泥鳅体表去除黏液,用水冲洗3 次,纱布吸干体表水分,称体质量(m)。泥鳅体表黏液残余率按公式(1)计算。

1.3.5.3 泥鳅呼吸强度的测定
将泥鳅置于5 g/L壳聚糖溶液和曝气处理的自来水中0.5 h,各取2 尾(体质量差异0.5 g之内)置于密封的2 L透明塑料容器中,放入CO2含量测定仪,开机后盖上容器盖子,每隔0.5 min记录CO2含量,持续4 min。泥鳅呼吸强度按公式(2)计算。

1.3.5.4 泥鳅鱼肉pH值的测定
将泥鳅分别置于5 g/L壳聚糖溶液和曝气处理后的自来水中1 h,水温12 ℃,处理组和对照组泥鳅各3 尾。处死0.5 h后去内脏,取5 g肌肉加3 倍质量蒸馏水打浆,4 ℃、10 000 r/min离心10 min。取上清液测定pH值。
1.3.5.5 泥鳅红细胞核异常率的测定
参考文献[5,9]的方法,将泥鳅分别置于0、5、10、15、20、25 mg/L壳聚糖溶液中,水温25 ℃,不投食,每24 h更换溶液。分别于24、48、72 h和96 h,各组随机取出3 尾,擦干体表水分,断尾取血,晾干,纯甲醇固定10 min,清水冲洗,晾干,Giemsa染液(0.2 mol/L pH 6.8磷酸盐缓冲液10 倍体积稀释)染色15~20 min,清水冲洗,晾干,油镜观察。每张血涂片观察2 000 个细胞,记录具有核异常的红细胞数量。红细胞核异常率按公式(3)计算。

1.3.5.6 溶液电导率、pH值、NH3溶出率以及泥鳅离子溶出率的测定
将泥鳅分别置于150 mL5 g/L壳聚糖、去离子水中,每组3 尾,磁力搅拌,速率为1档。用电导仪测定溶液电导率[10];鉴于壳聚糖可能会对离子有吸收作用,不进行相对电导率计算。pH计测定溶液pH值。泥鳅K+、Ca2+、Na+、Cl-离子和NH3溶出率测定样品处理同上,测定方法参考顾双[11]、Vardar[12]、Zhou Li[13]等的方法。建立标准曲线,测定去离子水电位和壳聚糖溶液电位。在0~2 h内测定处理和对照液体中K+、Ca2+、Na+、Cl-、NH3电位。测完后,将所有液体和泥鳅合并打浆研磨,再用电极测定各离子总量。测定时发现偶然有电位尖锐的峰,属泥鳅触碰引起。测定值扣掉水电位后,根据标准曲线换算X值。处理组还要减去壳聚糖中的离子和氨。泥鳅离子溶出量按公式(4)计算。

式中:X为电位值对应各离子标准曲线上物质的量浓度对数值;M为离子相对分子质量;V为溶液体积/L;mf为样品质量/g。
泥鳅离子溶出率按公式(5)计算。

壳聚糖对钙离子有络合作用,会产生沉淀。2 h后所检的总钙离子含量很低,因此钙离子总量为壳聚糖原初溶液钙离子含量与泥鳅钙离子含量之和。
1.4 数据分析
实验数据用Excel 2007软件进行分析处理,计算数据平均值、标准差,处理与对照进行t检验,当P<0.05时表示差异显著。
2 结果与分析
2.1 壳聚糖种类、质量浓度及溶液温度对泥鳅死亡时间的影响

图1 壳聚糖种类(a)、质量浓度(b)和溶液温度(c)对泥鳅死亡时间的影响Fig.1 Effects of different kinds (a) and concentrations (b) of chitosan and different treatment temperatures (c) on death time of loach
泥鳅在无壳聚糖的对照溶液中很正常,在24 h内无死亡。28 ℃下,将泥鳅放置于3种质量浓度均为5 g/L的壳聚糖中,发现4 h内全部急性死亡,说明不同种类的壳聚糖都会引起泥鳅急性死亡(图1a)。泥鳅在1 g/L壳聚糖溶液中窜动加快;在5、10 g/L壳聚糖中急速窜动。壳聚糖质量浓度越高,泥鳅死亡时间越早(图1b)。泥鳅在12 ℃和28 ℃下的5 g/L壳聚糖溶液中,全部急性死亡,说明温度越高泥鳅死亡越快(图1c)。
2.2 壳聚糖对泥鳅毒性评价结果
毒性评价实验显示壳聚糖对泥鳅的96 h L C100为12 0 m g/L,最大耐受浓度为2 m g/L,96 h L C50为16 m g/L。根据《化学农药环境安全评价试验准则》,96 h LC50低毒范围为LC50>10 mg/L;因此,壳聚糖对泥鳅的毒性为低毒,数值接近中毒。根据GB/T 21281—2007《危险化学品鱼类急性毒性分级试验方法》,水环境毒性急性III的LC50为10<LC50≤100 mg/L,因此,壳聚糖对泥鳅急性毒性分级属于急性III,数值接近急性II。
2.3 干扰因素对泥鳅死亡时间的影响
2.3.1 杂质的影响
为判断壳聚糖对泥鳅的毒性是否由壳聚糖中杂质引起,故对壳聚糖进行纯化。排除杂质影响实验显示泥鳅在去除壳聚糖的杂质液体24 h内没有死亡,而在未纯化的壳聚糖、纯化的壳聚糖中的死亡时间分别为(2.37±0.43)、(2.38±0.42)h。杂质对泥鳅死亡无影响。
2.3.2 pH值的影响
市售壳聚糖的pH值常较低,需要了解低pH值是否引起泥鳅死亡。实验结果显示泥鳅在磷酸对照、HCl对照中24 h均没有死亡,而在pH 4.7、5.5、6.0的5 g/L壳聚糖中,死亡时间分别为(1.03±0.12)、(2.00±0.52)、(2.34±0.42)h。实验表明,低pH值加速壳聚糖致泥鳅死亡。
2.3.3 聚合物对鱼鳃的影响
壳聚糖是高分子物质,为判断是否为壳聚糖堵塞泥鳅鱼鳃,造成其呼吸障碍,导致死亡,比较不同高分子物质对泥鳅的影响。实验结果显示,泥鳅在海藻酸钠、阿拉伯树胶溶液中24 h均没有死亡,在壳聚糖溶液中死亡时间为(2.34±0.42)h。壳聚糖、海藻酸钠、阿拉伯树胶溶液黏度分别为4.0、16.8、3.9 mPa·s。海藻酸钠黏度远高于壳聚糖,阿拉伯树胶黏度与壳聚糖类似,高分子聚合物中仅壳聚糖导致泥鳅死亡,说明壳聚糖致死作用具有专一性。
2.3.4 溶解氧的影响
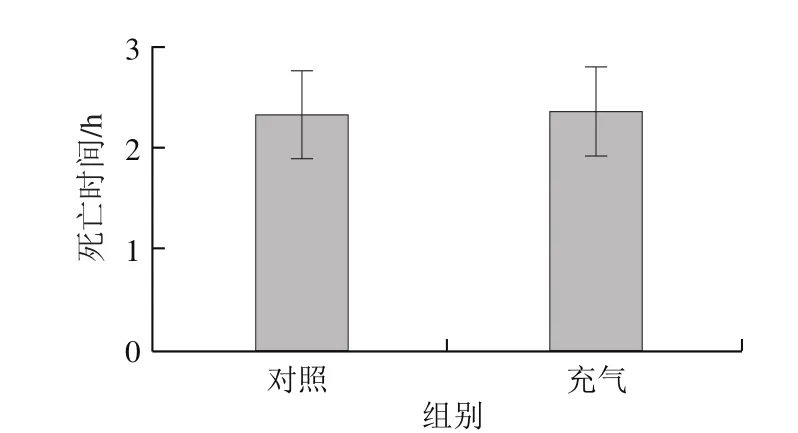
图2 充气处理对泥鳅死亡时间的影响Fig.2 Effect of oxygen supply on death time of loach
由图2可见,泥鳅在充气处理或不充气的5 g/L壳聚糖溶液中都出现急性死亡,二者没有显著差异,说明提高溶液氧气含量不能明显减少泥鳅死亡,其原因可能是壳聚糖已经损害了泥鳅呼吸系统。
2.4 壳聚糖对泥鳅的毒性原因分析
2.4.1 壳聚糖对泥鳅器官的影响
泥鳅放入壳聚糖溶液中后,体表滑液立即变白且大量脱落,出现轻微血丝。后期泥鳅沉于水底,死前偶然跳动。解剖后泥鳅中未观察到处理组和对照组内脏器官的差异,也未见血液色泽和凝血时间差异。壳聚糖处理的泥鳅鱼鳃表面有许多黏附物(图3a),对照鱼鳃则较干净(图3b)。

图3 壳聚糖处理对泥鳅鱼鳃的影响Fig.3 Effect of chitosan treatment on gills of loach
2.4.2 壳聚糖对泥鳅及其养殖环境的影响

图1 壳聚糖处理对泥鳅体表黏液残余率(a)、呼吸强度(b)、溶液中溶解氧质量浓度(c)的影响Fig.1 Effect of chitosan treatment on mucilage residue (a), respiration intensity (b) and dissolved oxygen concentration (c)
泥鳅未经壳聚糖处理,体表黏液残余率为7.1%,经过1、5、10 g/L壳聚糖处理3 h后,与对照相比体表黏液残余率显著下降(P<0.05,P<0.01),分别下降至5.0%、2.3%和3.0%。这与观察到的泥鳅体表黏液脱落现象相符,可能会抑制泥鳅皮肤呼吸(图4a)。
泥鳅在壳聚糖溶液中0.5 h时的呼吸强度显著高于对照组(P<0.01),3 种质量浓度壳聚糖处理泥鳅的呼吸强度均上升2 倍以上,处理组之间差异不显著。说明壳聚糖可能通过刺激泥鳅运动,加剧了泥鳅呼吸作用(图4b)。
溶解氧质量浓度开始时为4.6 mg/L,壳聚糖处理的泥鳅运动剧烈,2.5 h后溶解氧质量浓度低于0.50 mg/L;对照组在4 h时,溶解氧质量浓度为0.65 mg/L。鱼类一般无法在溶解氧质量浓度低于0.50 mg/L的水中生活。但泥鳅可以用鱼鳃、皮肤和肠呼吸;如果水体缺氧,泥鳅会时常钻到水面快速吸气,进行肠呼吸。壳聚糖处理的泥鳅后期沉于水底,无力到水面呼吸(图4c)。
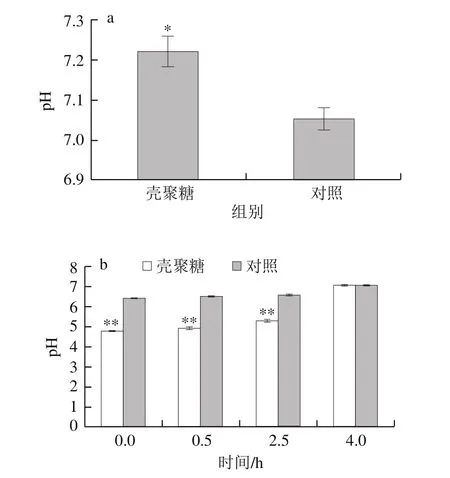
图5 壳聚糖处理对泥鳅肌肉(a)和溶液pH值(b)的影响Fig.5 Effect of chitosan treatment on pH of loach (a) and pH of loach raising water (b)
壳聚糖处理的泥鳅pH值为7.22,显著高于对照(pH 7.05)(图5a)。一般活鱼pH值为7.2~7.4,鱼死后pH值会暂时下降,其原因是鱼死后随着糖原酵解成乳酸,pH值下降,达到低点后,因为碱性物质生成,pH值重新上升。壳聚糖处理的泥鳅可能在死前大量消耗掉糖原,因此泥鳅死后肌肉pH值只有轻微下降。泥鳅糖原被消耗,将导致泥鳅无力浮出水面进行肠呼吸。这与壳聚糖处理的泥鳅后期沉在水底症状相符合。
对照泥鳅溶液pH值从6.41缓慢上升到7.08,其溶液一直澄清。壳聚糖处理溶液呈酸性,开始时pH 4.75,其pH值上升较快,4 h时达到7.05(图5b)。处理组溶液在0.5 h稍有浑浊,2.5 h浑浊程度较强,4 h时浑浊程度强,伴有大量泡沫。壳聚糖在中碱性条件下易产生凝絮。没有泥鳅的pH 6.0水溶性壳聚糖溶液是澄清的。说明该浑浊情况除了与pH值上升有关,还可能与泥鳅黏液脱落等有关。壳聚糖处理的泥鳅鱼鳃有黏附物,可能与溶液浑浊有关。
2.4.3 壳聚糖对泥鳅红细胞核的影响

表1 壳聚糖处理对泥鳅红细胞核异常率的影响Table1 Effect of chitosan treatment on erythrocyte cell nucleus abnormality in loach
泥鳅红细胞的细胞质被染成紫红色,细胞核被染成蓝紫色。壳聚糖处理和对照处理的泥鳅均观察到血红细胞的核异常现象,主要有微核、双核、核质外凸和核质内凹4 种。但是24、48、72 h和96 h的处理组与对照之间的核异常率均没有显著差异(表1),因此壳聚糖可能没有进入红细胞内。
2.4.4 壳聚糖对溶液电导率、pH值、NH3溶出率以及泥鳅离子溶出率的影响
壳聚糖本身带有电解质,导致溶液的电导率显著较高。壳聚糖促进泥鳅电解质渗出,其电导率上升速率为3.45 S/(m·min),显著快于对照0.86 S/(m·min)。在2 h时,处理组溶液中NH3溶出率为5.34%,而对照组为0.89%。总氨氮由NH3和NH4+组成,两者比例与pH值有关。酸性条件下以NH4+为主,pH值升高,说明NH3比例升高。如果考虑壳聚糖处理pH值较低,壳聚糖处理泥鳅的NH3溶出率远高于对照(图6)。


图6 壳聚糖对养殖泥鳅溶液电导率(a)、pH值(b)和NH3溶出率(c)的影响Fig.6 Effect of chitosan treatment on conductivity (a), pH (b) and leaching rate of NH3 (c) in loach raising water

图7 壳聚糖对泥鳅中Na+(a)、K+(b)、Ca2+(c)、Cl-(d)溶出率的影响Fig.7 Effect of chitosan treatment on leaching rate of Na+ (a), K+ (b),Ca2+ (c) and Cl- (d) in loach raising water
壳聚糖在0~7 min和40~120 min促进泥鳅钠离子大量渗出。在2 h时,处理组泥鳅Na+、K+、Cl-溶出率为20.84%、7.04%、43.12%,而对照泥鳅Na+、K+、Cl-溶出率仅为2.82%、0.50%、0.69%,壳聚糖处理分别是对照的7.4、14 倍和62 倍(图7)。壳聚糖导致泥鳅Cl-、Na+、K+大量溶出,说明壳聚糖促进细胞内离子渗漏,这可能刺激泥鳅表皮神经,以及影响鱼鳃细胞功能。
对照2 h时,Ca2+溶出率为2.10%,壳聚糖处理2 min,Ca2+溶出率显著上升,为63.04%,尚不清楚该上升是来自壳聚糖解吸还是泥鳅外表脱落,之后Ca2+溶出率迅速下降。30 min后,进入缓慢下降阶段。2 h时溶液中Ca2+溶出率为-95.34%,尚不清楚Ca2+是被壳聚糖吸附沉淀还是被泥鳅吸收(图7)。膜内Ca2+含量升高会引起快速型心率失常,但是解剖没有发现血液异常,说明可能并非心肌异常引起。
3 讨 论
动物急性死亡的常见机制主要是急性心力或循环衰竭(血液循环故障)、中枢神经系统机能障碍(主要是脑损伤)、急性呼吸衰竭(窒息)。壳聚糖是带正电的高分子物质,理论上是会与带负电的大分子物质结合,从而影响酶活性、核酸复制等。带正电的未改性的壳聚糖不能穿透动物细胞,对细胞没有毒性。季铵化壳聚糖的溶解性和细胞渗透性增加,有细胞毒性,会产生活性氧、阻滞细胞周期和抑制细胞增殖,用疏水性基团修饰季铵化壳聚糖,能保留细胞渗透性,明显减少细胞毒活性。带负电荷的琥珀酰壳聚糖能高效地穿透细胞,刺激细胞增殖,具有安全性[14]。田丰等[15]报道,壳聚糖能够促进体外凝血。壳聚糖能够显著提高细菌、酵母细胞膜透性,造成电解质和大分子物质外泄,强烈抑制活体乳酸菌还原酶活性,能凝聚酵母菌并抑制酵母菌还原酶,但是几乎不抑制大肠杆菌的还原酶活性[16]。其原因可能是壳聚糖会进入乳酸菌和酵母菌细胞,而几乎不进入大肠杆菌。因此,壳聚糖是否促进细胞膜渗漏和是否容易会进入细胞,与其是否产生危害或作用有关。从现有报道看,壳聚糖对动物细胞膜透性影响较小,也不容易进入动物细胞。王晓芹等[17]研究表明壳聚糖对兔子无皮肤、角结膜和肌肉刺激性,对角质形成细胞和成纤维细胞无毒性。石玲等[18]报道小鼠的壳聚糖最大耐受灌胃药量为4.98 g/kg,一次性最大腹腔注射耐受量为1.66 g/kg,且体质量、血常规、肝功能、肾功能、血糖和血脂等生化指标均正常。Zhao Yang等[19]认为高浓度羧甲基壳聚糖对小鼠的血液系统没有影响。本研究没有发现壳聚糖干扰泥鳅体内凝血,也没有升高红细胞核异常率,说明壳聚糖可能没有进入红细胞内,其抑制脑部神经的可能性较低。另外壳聚糖导致泥鳅运动加剧,有明显的刺激皮肤神经作用。因此,推测壳聚糖很可能造成泥鳅急性呼吸衰竭导致其死亡。
泥鳅在pH 5.0和pH 9.0水中,经过50 h左右才全部死亡。而壳聚糖处理泥鳅在4 h内死亡,显然泥鳅不是酸、碱中毒而死亡。高浓度的氨会使鱼的次级鳃丝上皮肿胀,使鱼从水中获取氧的能力降低,甚至使鱼窒息死亡。鳜鱼96 h的LC50为0.193 mg/L[20]。壳聚糖引起泥鳅中毒,可能与氨含量过高有关,其破坏泥鳅鱼鳃,抑制鳃呼吸,壳聚糖带有大量氨基,与泥鳅黏液结合,造成泥鳅黏液脱落。泥鳅体表的黏液有防病虫害,协调皮肤渗透压,保持代谢持稳定,维持正常生理作用。泥鳅黏液的主要成分是水和透明质酸(haluronic acid,HA),另外还含有少量的蛋白质、多肽、氨基酸、核酸等[21-22]。HA包覆壳聚糖纳米粒,用于抗肿瘤[23],输送地塞米松药物[24],说明两者能够结合。壳聚糖破坏了HA分子物理交联网络而使黏液脱落,既干扰了皮肤正常渗透压的调节,也可能影响鱼鳃的呼吸作用。壳聚糖处理泥鳅溶液的电导率、Cl-、Na+、K+溶出率显著增加,说明壳聚糖影响泥鳅细胞膜的稳定性,致使膜内电解质大量渗出。壳聚糖可改变大肠杆菌和金黄色葡萄球菌细胞内、外膜的渗透性,从而使细胞膜被破坏,并伴随大量内溶物(DNA和mRNA)的溢出。壳聚糖与细胞膜间的作用主要是壳聚糖中的—NH3+和卵磷脂中—C=O、—P=O形成了新的化合物引起的[25]。离子大量渗漏可能破坏鱼鳃等细胞的功能,并可能刺激皮肤神经,造成泥鳅运动加剧,促进泥鳅呼吸强度大幅上升,耗尽体内糖原,从而导致泥鳅后期无力浮出水面进行肠呼吸,并造成水体氧气含量过低。壳聚糖对泥鳅本身鱼鳃、皮肤、肠呼吸三方面产生的负面影响,以及对环境氧气的消耗,可能造成泥鳅急性死亡。
壳聚糖对口腔癌细胞Ca9-22有毒,对正常细胞HaCaT毒性小。壳聚糖处理Ca9-22导致G1/S细胞周期阻滞和TUNEL法检测阳性细胞(细胞凋亡)增加,有早期凋亡细胞形态和胱天蛋白酶活性少量增加[26],说明壳聚糖对癌细胞和正常细胞具有特异性。
壳聚糖对动植物无毒,可能与动植物含有大量分解壳聚糖的酶有关。许多微生物、动物及植物中都有几丁质酶。几丁质酶、壳聚糖酶都能专一降解壳聚糖。另外还有很多非专一性酶也能降解壳聚糖,例如纤维素酶、蛋白酶、糖苷酶、单宁酶等[27-32]。其水解最适pH值为3.0~5.0[32],说明pH值影响酶对壳聚糖的降解。各种酶降解壳聚糖的能力大小为:纤维素酶>胃蛋白酶>果胶酶>木瓜蛋白酶[31]。
植物有纤维素酶、果胶酶、木瓜蛋白酶、β-甘露聚糖酶等分解壳聚糖,防止受到其危害。人类等动物的消化道具有胃蛋白酶,胃中环境为酸性,能够降解壳聚糖,因此食用壳聚糖具有很高的安全性。但是当胃酸偏少、胃蛋白酶等活性受到其他物质抑制或非正常生理状态导致胃蛋白酶等活力大幅降低,或者联合食用其他物质促进壳聚糖进入人体细胞内,此时壳聚糖对人体是否仍然安全有待进一步研究。壳聚糖会引起泥鳅急性死亡,说明壳聚糖对泥鳅具有物种特殊性,壳聚糖会与泥鳅黏液中的HA快速结合,导致溶液pH值快速上升,从而降低蛋白酶等对壳聚糖的降解,可能加重其危害。壳聚糖引起泥鳅急性死亡主要与损害泥鳅呼吸系统有关,但壳聚糖一般不会进入人类呼吸系统;因此壳聚糖按照食品添加剂标准使用还是安全的。

