不同生长速率肉鸡肠道真菌结构分析
温雪婷,朱江群,朱建芬,肖英平,李娜,杨华*
(1.浙江农林大学 动物科技学院,浙江 杭州 311300; 2.余杭区余杭街道农业公共服务中心,浙江 杭州 311100; 3.余杭区塘栖镇农业公共服务中心,浙江 杭州 311106; 4.浙江省农业科学院 农产品质量标准研究所,浙江 杭州 310021)
动物肠道内寄居着大量共生微生物,包括真菌、细菌、古菌及病毒,其中真菌是肠道菌群的重要组成部分,结构受日龄、性别、饲粮、品种、地域、药物、疾病等因素的影响[1]。与其他肠道菌相比,肠道真菌的丰度和多样性较低,存在明显的个体差异[2-3],且其组成并不稳定,不同时间真菌组成相似性低[4-6]。由于真菌在肠道中的丰度低、含量少,因此通用引物扩增真菌DNA时会出现阴性结果,在某种程度上限制了肠道真菌的研究。
在正常情况下,肠道内细菌、病毒和真菌菌群之间存在稳定的对抗、协同或共生关系[7-8]。肠道中真菌多样性分布可能是饮食和环境因素的体现,同时也是真菌菌群同宿主肠道免疫系统,以及土著微生物与外源真菌之间相互作用的体现。真菌可通过与细菌的相互作用从而改变肠道生物屏障[9-10],引起肠道通透性增加,导致肠腔内真菌易位到肠腔以外部位并引起侵袭性感染。消化道真菌感染可由肠道正常真菌菌群或是外来的致病菌引发,真菌性食管炎及胃炎的主要致病菌为白色念珠菌,毛霉菌属、念珠菌属、曲霉属、隐球菌属等可导致肠道的真菌性炎症[1,11]。不同肠段优势真菌与真菌结构不同[12],研究还发现人类肥胖组与非肥胖组的肠道真菌多样性存在差异,肥胖组的真菌多样性较非肥胖组降低,毛霉菌在非肥胖组中检测率最高,毛霉属的相对丰度与体质量降低程度呈正相关[13-14]。
本研究旨在利用高通量测序技术比较不同生长速率肉鸡盲肠真菌组成差异,探索肉鸡肠道真菌结构与鸡生长速率的关系,为正确定义“肉鸡健康肠道真菌菌群”提供更多理论数据。
1 材料与方法
1.1 试验动物分组与采样
选择10 000只罗斯308肉鸡常规饲养。1~2日龄时,提供24 h的光周期,饲养温度32~34 ℃;随后提供16 h的光周期,温度每周减少2~3 ℃,至20 ℃。所有肉鸡饲喂相同配合饲料,随意采食[15]。38日龄时,从中随机挑选600只公鸡,选取其中体质量最高的8只作鸡H组,(3 146.25±92.57)g,体质量中等的8只鸡作M组,(2 212.5±14.88)g和体质量最低的8只鸡作L组,(1 127.5±93.16)g。颈椎脱位处死,屠宰后立刻取其盲肠内容物,标记为H1~H8、M1~M8和L1~L8,液氮冷冻,-80 ℃储存待测。
1.2 DNA提取、扩增与高通量测序
使用DNA提取试剂盒(德国QIAGEN公司)提取样本DNA,并存储于-80 ℃。以提取的DNA为模板,使用ITS2引物ITS3-2024F(5′-GCATCGATGAAGAACGCAGC-3′)和ITS4-2409R(5′-TCCTCCGCTTATTGATATGC-3′)对细菌进行PCR扩增,扩增产物进行ITS测序分析,由llumina HiSeq 2500平台测序[4]。
1.3 序列分析与系统分类
采用QIIME软件(V1.7.0)进行序列的质量控制及过滤,剔除低质量的DNA序列。在QIIME中调用uCLUST对优质序列按相似度97%进行聚类,定义为操作分类单元(operational taxonomic unit,OTU)。利用聚类 OTUs 构造稀释曲线,并用 QIIME计算各样品的α多样性指数(ChaoⅠ、ACE、Simpson、 Shannon和覆盖度指数),并用R软件包(Version 2.15.3)显示。使用Sliva和RPD数据库对所有OTU的代表性序列进行物种匹配,在门和属的水平上对样品的真菌组成进行统计,得到菌群分布结果,并绘制柱状图。进行主坐标分析(PCoA)和聚类分析,对样本间物种多样性差异进行分析。
2 结果与分析
2.1 α多样性
通过Chao1丰富度估计量、ACE指数计算菌群丰度,香农多样性指数(Shannon diversity index)、辛普森多样性指数(Simpson diversity index)计算菌群多样性,覆盖率指数(Coverage index)刻画序列深度(表1)。研究发现,最低体质量组鸡盲肠内容物真菌丰度最高(Chao1:451.352,ACE:438.521),最高体质量组鸡盲肠内容物菌群多样性最高(Shannon指数:4.413,Simpson指数:0.838)。所测样品覆盖率指数均超过99.8%,表明本次测序结果能够代表样本的真实情况。
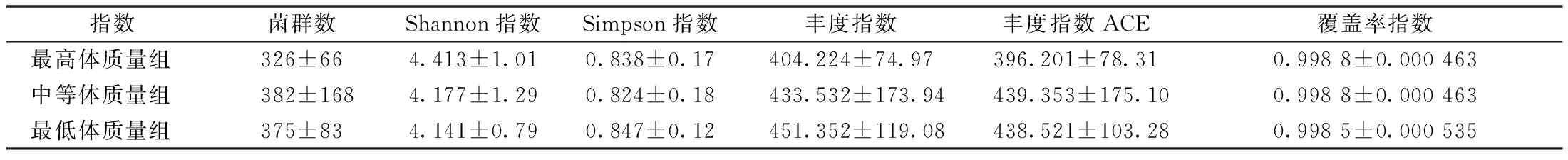
表1 各供试组的α多样性指数
2.2 肠道真菌菌群结构分布
稀释曲线用于评价测序量是否足以覆盖所有类群,并间接反映样品中物种的丰富程度。取样943 0 reads,随着取样reads的增加,新发现的OTUs减少,取样565 80 reads时,稀疏曲线趋于饱和(图1)。这表明,样本库的大小足以估计相似阈值97%的菌种丰度和真菌群落多样性。
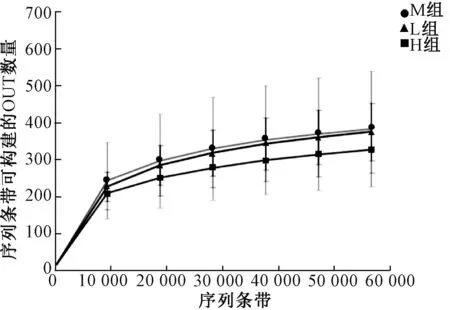
图1 肠道真菌菌群结构分布的稀疏曲线
研究发现,所有序列可分为5个门:球囊菌门(Glomeromycota)、壶菌门(Chytridiomycota)、接合菌门(Zygomycota)、担子菌门(Basidiomycota)和子囊菌门(Ascomycota)(图2)。丰度最高的10个属分别为念球菌属(Candida)、隐球菌属(Cryptococcus)、曲霉属(Aspergillus)、哈萨克斯坦酵母(Kazachstania)、刺盘孢属(Colletotrichum)、赤霉菌属(Gibberella)、微囊菌属(Microascus)、Phialemoniopsis、链格孢属(Alternaria)和木霉属(Trichoderma)。在门水平上,子囊菌门为优势菌门;在属水平上,不同组肠道真菌没有明显的规律,样本间个体差异大。
2.3 菌群聚类分析和主坐标分析
为了对各组肠道真菌群落进行比较,进行聚类分析与主坐标分析(PCoA)。聚类分析根据OUT数据进行标准化处理后,选取数目最多的35个菌属,基于R热点图进行作图,热图中的每1个色块代表1个样品在1个属水平上的丰度。不同分组横向排列,属纵向排列,对样品进行聚类,从聚类中可以了解样品之间的相似性以及属水平上的群落构成相似性(图3)。研究发现,最低体质量组肠道真菌丰度较高的有德巴利氏酵母属(Debaryomyces)、曲霉菌属(Aspergillus)、青霉菌属(Penicillium)、小囊属(Microascus)、毛霉菌(Mucor)等。

图2 不同样品中真菌群落组成
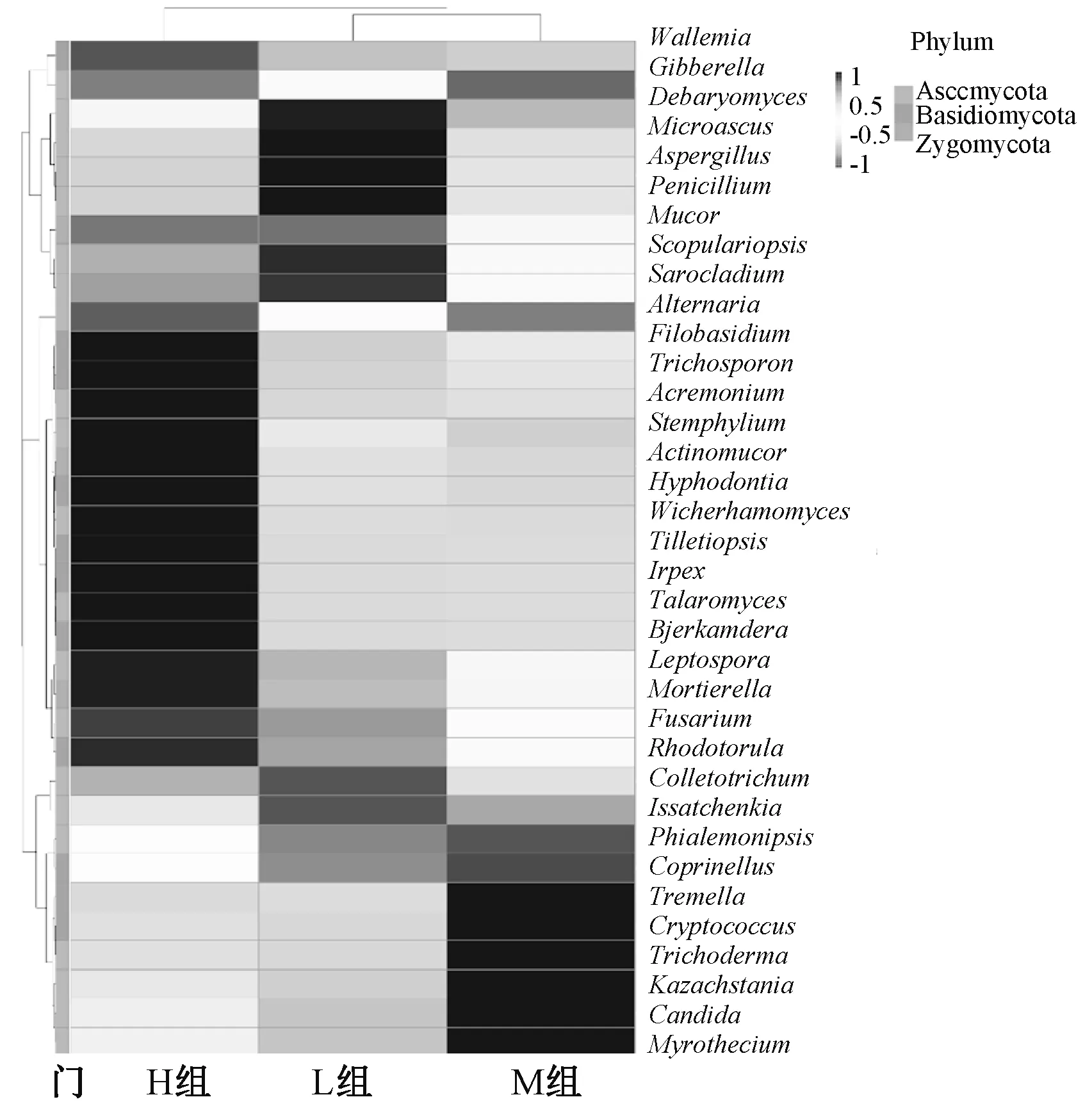
图3 真菌结构的热点
主坐标分析PCoA没有改变样品点之间的相互位置关系,只是改变了坐标系统。通过PCoA可以观察个体或群体间的差异。每1个点代表1个样本,相同颜色的点来自同1个分组,两点之间距离越近表明两者的群落构成差异越小(图4)。研究发现,最低体质量组与最高体质量组肉鸡肠道真菌群落构成差异较大,最低体质量组与中等体质量组、中等体质量组与最高体质量组肉鸡肠道真菌群落构成差异较小。最低体质量组与中等体质量组组内个体差异较最高体质量组小。

图4 菌群的主坐标分析
3 小结
肉鸡肠道真菌序列聚集成2 759个OTUs,分为5个菌门:球囊菌门(Glomeromycota)、壶菌门(Chytridiomycota)、接合菌门(Zygomycota)、担子菌门(Basidiomycota)和子囊菌门(Ascomycota)。丰度最高的10个属分别为念球菌属(Candida)、隐球菌属(Cryptococcus)、曲霉属(Aspergillus)、哈萨克斯坦酵母(Kazachstania)、刺盘孢属(Colletotrichum)、赤霉菌属(Gibberella)、微囊菌属(Microascus)、Phialemoniopsis、链格孢属(Alternaria)和木霉属(Trichoderma)。α多样性指数表明,最低体质量组真菌的丰度最高,其次为中等体质量组和最高体质量组;最高体质量组的菌群多样性最高,其次为中等体质量组和最低体质量组。肉鸡肠道优势菌门为子囊菌门,属水平上肠道真菌有较大的个体差异。最低体质量组与最高体质量组肉鸡肠道真菌群落构成差异较大。已知曲霉菌、毛霉菌可导致肠道真菌性炎症,毛霉属的相对丰度与体质量降低程度呈正相关[13],通过热点图可知,最低体质量肉鸡肠道组曲霉菌属(Aspergillus)、毛霉菌(Mucor)丰度较高。

