不同解冻方式对早熟中华绒螯蟹品质和滋味的影响
徐志善,孙钦军,王锡念,包建强,2,3,*
(1.上海海洋大学食品学院,上海201306;2.上海水产品加工及贮藏工程技术研究中心,上海201306;3.农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海201306)
中华绒螯蟹(Eriocheir sinensis)又名河蟹、大闸蟹、毛脚蟹等,广泛分布于我国沿海、湖泊地区[1]。近年来,河蟹养殖规模迅速扩大,2015年全国蟹类(专指河蟹)产量 82.33万吨,比 2014年增加了3.36%[2]。河蟹养殖过程中,性早熟问题尤为突出,这种河蟹被称为早熟蟹,性腺发育成熟,个体较大(通常 20 g以上)[3]。因其继续养殖死亡率高达60%~90%,且体重远低于成蟹(100~200 g/只),不具备养殖价值[4]。我国早熟蟹年产量20万吨左右,占总产量的20%~30%[3]。可见,对早熟蟹加工利用,可提高养殖户的经济效益,具有巨大的发展潜力。
为了满足市场需求,延长产品的保质期,对于不能及时加工的早熟蟹通常采用冻藏保藏。秦辉[5]研究发现,-24℃冻藏可减缓中华绒螯蟹品质劣化,较好地保持蟹肉的品质。冻藏早熟蟹在加工前需先解冻,解冻方式的选择尤为重要,如果处理不当,将会造成脂肪氧化、蛋白质降解、呈味氨基酸减少等,严重影响产品的品质和风味。目前常见的解冻方式有微波解冻、流水解冻、空气解冻等[6]。曹荣等[7]研究发现,低温空气解冻、室温空气解冻、静水解冻、流水解冻对三疣梭子蟹感官特征和部分理化指标均有显著影响,静水解冻适合解冻三疣梭子蟹。姜晴晴等[8]研究了低温解冻、微波解冻、流水解冻、自然解冻对带鱼蛋白性质及肌肉品质的影响,结果发现,低温解冻后带鱼品质较好,适合带鱼的解冻。但是目前关于早熟中华绒螯蟹解冻方式的理论研究较少,尤其是关于解冻方式对早熟蟹蟹肉蛋白生化特性及游离氨基酸等重要指标的理论研究较少。
本研究以性早熟的中华绒螯蟹为实验材料,探讨不同解冻方式对蟹肉品质和滋味的影响,以期找出合适的解冻方式,减少解冻环节对样品的破坏,最大程度地保留蟹肉原有的品质,为今后早熟蟹的加工提供理论指导。
1 材料与方法
1.1 材料与仪器
早熟中华绒螯蟹 兴化地区河蟹养殖基地,选取活力较强的清洗沥干后,分装于自封袋中放入-50℃超低温环境中快速冻结,冻结完成后取所需实验原料,贮藏在-18 ℃的冰箱中,备用;5,5-二疏基-2,2-二硝基苯甲酸(DTNB) 源叶生物科技有限公司;Maleat(顺丁烯二酸)、Tris(三羟甲基氨基甲烷) 国药集团化学试剂有限公司;其余试剂 国产分析纯。
UV-757型紫外分光光度计 杭州科晓仪器有限公司;SX620型pH测定仪 上海三信仪表厂;H1850R型冷冻离心机 北京北利离心机有限公司;LRH-50CA型低温恒温培养箱 恒科仪器有限公司;90-2型数显恒温磁力搅拌器 金坛市宏业实验仪器厂;BC/D-429H型冰箱 江苏海尔股份有限公司;L-8800型氨基酸自动分析仪 日立公司;TES-1384型四通道温度记录仪 泰仕电子工业股份有限公司。
1.2 实验方法
1.2.1 早熟蟹蟹肉的解冻 低温解冻:将温度传感器的探头插入蟹肉中心,早熟蟹放置于不锈钢铁盘上,置于培养箱(4±0.5)℃内解冻,记录早熟蟹中心温度的变化情况,蟹肉中心温度达到0℃为解冻终点。
微波解冻:将早熟蟹放入烧杯中,置于微波炉内,解冻功率设为150 MHz,蟹肉中心温度达到0℃为解冻终点。
自然解冻:将早熟蟹从-18℃冰箱中取出,放在不锈钢拖盘中,在恒温箱(15±0.5)℃内解冻,以螃蟹蟹肉中心温度达到0℃为解冻终点。
流水解冻:将样品从-18℃冰箱中取出,封装于自封袋内,放入塑料盆中,打开实验室水龙头,流水解冻,水流流速100 mL/s,水温(15±0.5)℃,解冻过程中水流完全没过自封袋,蟹肉中心温度达到0℃为解冻终点。
1.2.2 指标测定
1.2.2.1 解冻损失率的测定 参照常海军等[9]的方法,解冻前蟹肉质量记为m1,解冻后打开蟹壳吸干蟹表面水分,质量记为m2,按照解冻损失率公式(1)计算:
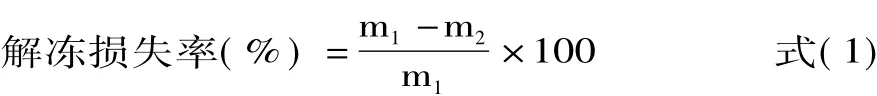
1.2.2.2 蒸煮损失率的测定 参照孙天利等[10]的方法,将早熟蟹去壳去内脏取肉,准确称取5 g蟹肉(m1)密封于蒸煮袋中,在75℃水浴锅内保温30 min,取出后流水冷却,吸干蟹肉表面水分,称重,质量记为(m2),按公式(2)计算:

1.2.2.3 p H的测定 参照Li等[11]方法,煮沸一定量的去离子水,密封冷却后,取45 mL加入到5 g蟹肉中,16000 r/min均质30s。均质后的样品在4℃、10000 r/min条件下离心20 min,测定上清液的p H,试验重复3次,取平均值。
1.2.2.4 TBA值的测定 参照Siu等[12]的方法,略加修改,称取10 g蟹肉,加入50 mL三氯乙酸(7.5 g/100 mL,0.1 g/100 mL 乙二胺四乙酸),均质5 min,磁力搅拌20 min后双层滤纸过滤两次。取一定量的上清液加入0.02 mol/L的2-硫代巴比妥酸,按体积比1∶1混匀,混匀后样品在沸水水浴中保温0.5 h,取出冷却。冷却后的样品中加入10 mL三氯甲烷,混匀,静置分层。取有机相在532、600 nm波长下测定吸光度值,分别记为A532nm和A600nm,按公式(3)计算:
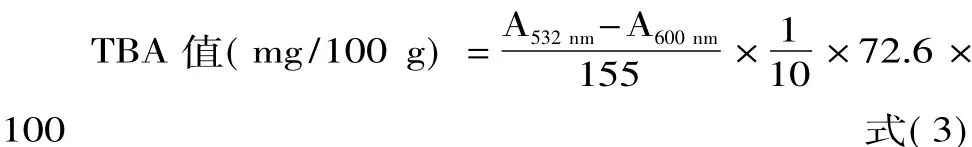
式中,TBA值以每100 g早熟蟹蟹肉中所含丙二醛的毫克数来表示。
1.2.2.5 TVB-N值的测定 参考宋雪等[13]的研究方法,使用凯氏定氮仪测定样品TVB-N值,实验结果以每100 g肌肉中含氮毫克数来表示。
1.2.2.6 肌原纤维蛋白含量的测定 肌原纤维蛋白的提取:参照Yarnpakdee等[14]方法并适当修改。精确称取5 g蟹肉,依次加入缓冲液 A(0.16 mol/L KCl,1% 曲拉通 X-100,40 mmol/L Tris- Maleat,pH7.5)和缓冲液 B(0.16 mol/L KCl,40 mmol/L Tris-Maleat,p H7.5)各20 mL,均质 2 min。均质后的溶液在4℃、10000 r/min离心10 min,去上清液收集沉淀。沉淀中加入40 mL缓冲液B,均质、离心(4℃,10000 r/min,10 min)收集沉淀,上述步骤重复两次。在沉淀中加入 40 mL溶液 C(0.1 mol/L NaCl,pH7.2),经过均质、离心(4 ℃,10000 r/min,10 min)、收集沉淀。沉淀加入15 mL磷酸缓冲液(50 mmol/L,pH7.2),均质、离心(4 ℃,10000 r/min,10 min),收集上清液,沉淀重复上述步骤再提取一次,合并两次收集的上清液,上清液即为肌原纤维蛋白溶液。
肌原纤维蛋白含量的测定:参考刘琴等[15]方法,取2 mL蛋白溶液加入等量的双缩脲试剂,常温反应30 min,测定540 nm下的吸光值,从标准曲线中计算蛋白含量。
1.2.2.7 肌原纤维蛋白总巯基和活性巯基含量的测定 总巯基含量测定:参考卢涵[16]方法适当修改。将肌原纤维蛋白浓度调节至4 mg/mL,取0.5 mL加入4.5 mL溶液A(8 mol/L尿素,1%SDS,3 mmol/L乙二胺四乙酸,0.2 mol/L Tris-HCl,pH8.0),混匀后加0.5 mL 溶液 B(10 mmol/L DTNB,0.2 mol/L Tris-HCl,p H8.0),40 ℃水浴 25 min,冷却后在 412 nm 处测定吸光度值,空白为50 mmol/L磷酸缓冲液,试验重复3次,取平均值。
活性巯基含量测定:溶液A替换为溶液C(1%SDS,3 mmol/L EDTA,0.2 mol/L Tris-HCl,pH8.0),其它步骤同总巯基含量测定,试验重复3次,取平均。

式中:A412是样品在412 nm处的吸光值;n为稀释倍数;ρ为蛋白质量浓度(mg/mL);ε为摩尔吸光系数 13600 mol-1·cm-1·L。
1.2.2.8 肌原纤维蛋白表面疏水性的测定 参考马纪兵等[17]方法将肌原纤维蛋白稀释至2 mg/mL,取2 mL加入200 μL溴酚蓝(1 mg/mL),振荡10 min,离心15 min(4℃、4000 r/min)。取上清液稀释10倍,在595 nm条件下测定样品吸光度值。对照组为20 mmol/L磷酸缓冲液,空白选用磷酸缓冲液,试验重复3次,取平均值。上清液吸光度对应于游离溴酚蓝,溴酚蓝结合量即表面疏水性指数为总溴酚蓝与游离溴酚蓝之差。表面疏水性按计算公式(5)计算:
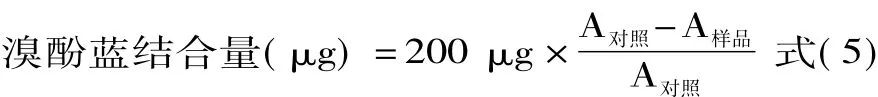
式中:A对照为对照组样品的吸光值,A样品为样品组吸光值。
1.2.2.9 游离氨基酸含量的测定 参考张娜[18]的游离氨基酸测定方法稍作改动,取1 g蟹肉加入5%三氯乙酸溶液15 mL,16000 r/min均质2 min,超声处理15 min。处理样在4℃的恒温箱中放置24 h后离心10 min(4℃、16000 r/min),取上清液5 mL,将其p H调节至2.0后定容到10 mL,用0.22μm水相滤膜过滤后装入进样瓶,使用氨基酸自动分析仪进行测定。
1.3 数据处理
使用SPSS 17.0软件,对实验数据进行单因素方差分析、相关性分析,结果采用平均值±标准偏差(mean±SD)表示,作图使用Origin 8.5软件。
2 结果与分析
2.1 不同解冻方式对早熟蟹解冻时间的影响
如图1所示,采用四种解冻方式,样品到达解冻终点所消耗的时间不同。微波解冻仅为5 min,通过最大冰晶带时间最短。但是微波加热速度较快,早熟蟹组织结构差异大,蟹脚细小,蟹脚部分变红,样品出现熟化现象。低温解冻时间长达675 min,耗时最长,早熟蟹在解冻后有异味,蟹壳松散,腮丝浅棕色,肉质弹性较差。自然解冻为135 min耗时中等,解冻后有异味,肉质浅灰,弹性不足。流水解冻时间为52 min,样品无异味,肉质白色有弹性。
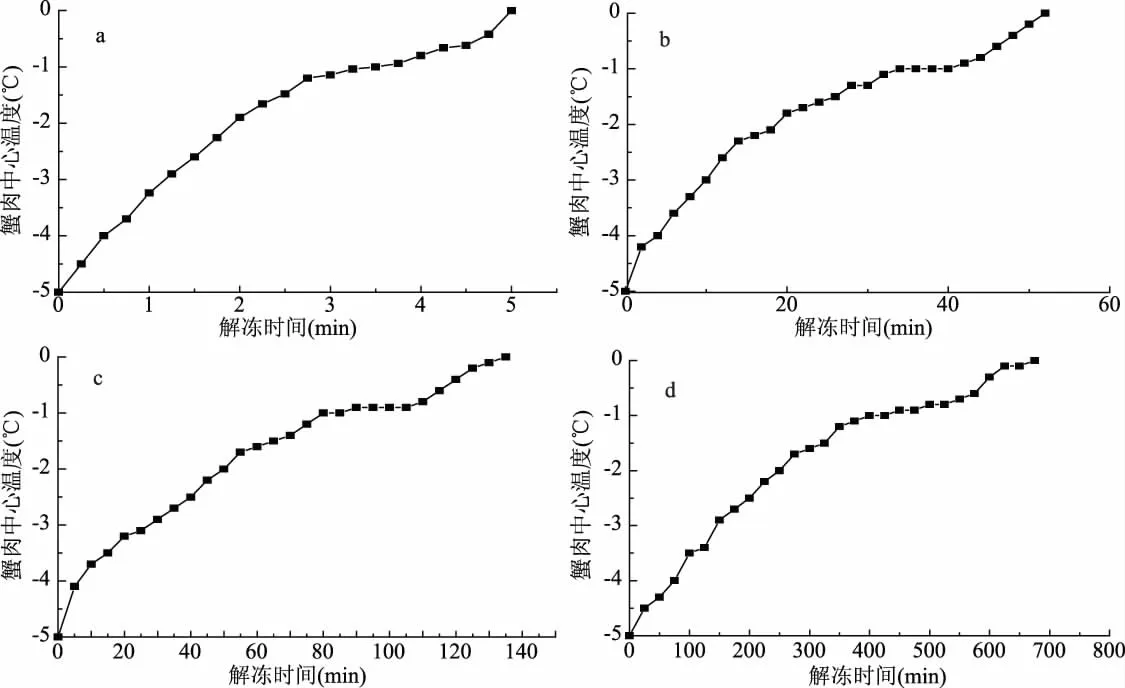
图1 不同解冻方式早熟中华绒螯蟹蟹肉中心温度变化Fig.1 Center temperature changes of crab meat of precocious Eriocheir sinensis with different thawing methods注:图中a、b、c、d分别为微波解冻、流水解冻、自然解冻、低温解冻。
2.2 不同解冻方式对早熟蟹品质的影响
由表1可以得出,微波解冻损失率最高(2.89%),这是由于微波解冻速率较快,通过最大冰晶带时间短,破坏了样品的细胞膜,导致蛋白质结构发生变化,汁液损失[19]。低温解冻损失率最低(1.65%),这是由于低温解冻时间最长,细胞膜损伤小,蛋白结构变化小。四种解冻方式中自然解冻蒸煮损失率最高(50.99%),这是由于解冻过程中蛋白酶活性较高,肌肉蛋白结构发生变化,持水率下降[7]。低温解冻蒸煮损失率最低(42.69%),流水解冻和微波解冻差异不显著(p>0.05)。四种解冻方式中,低温解冻蟹肉的pH最高,为7.23,流水解冻最低,为6.95,微波解冻和自然解冻后的样品p H无显著性差异(p>0.05)。低温解冻pH最高是由于解冻时间过长,微生物繁殖代谢,样品pH上升[20]。
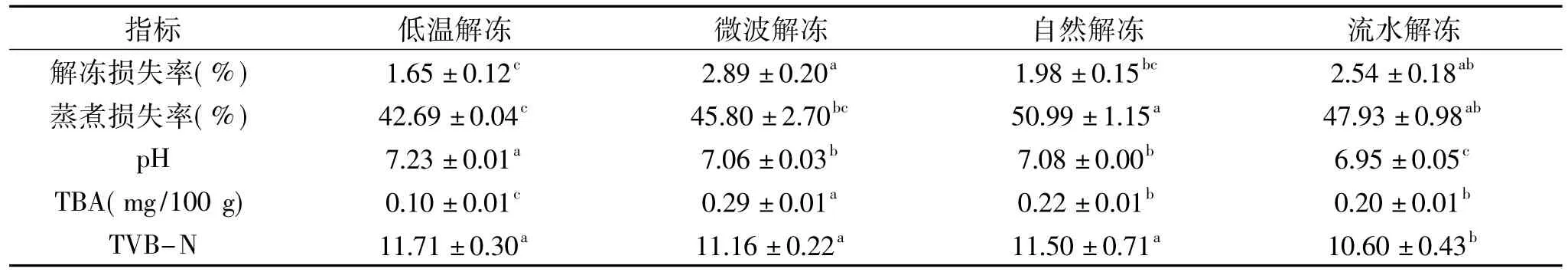
表1 不同解冻方式对早熟中华绒螯蟹品质的影响Table 1 Effects of thawing methods on the quality of precocious Eriocheir sinensis
TBA值的大小可以反应脂质氧化水平的高低。样品的酶促反应和非酶自由基变化越剧烈,TBA值越高,样品氧化程度越高[21]。从表1可以看出,四种解冻方式中,微波解冻TBA值最高为0.29 mg/100 g,脂质氧化较为严重。微波解冻样品时,加热不均匀,导致样品部分熟化。低温解冻TBA值最小,脂质氧化水平最低。自然解冻和流水解冻脂质氧化程度居中。TVB-N反应蟹肉中挥发性盐基总氮含量,蟹肉在解冻过程中微生物大量繁殖代谢,产生大量的氨和胺类,导致TVB-N值变大[22]。从表1可以看出,流水解冻与其它三种解冻方式TVB-N值差异显著(p<0.05),TVB-N值较小为10.60。说明流水解冻过程中微生物繁殖较慢,产生的氨和胺类较少。
综合上述实验结果可知,不同解冻方式下的早熟蟹蟹肉品质差异较大,流水解冻对样品的品质破坏较小,能够保持样品原来的品质,微波解冻时间较短,但是样品氧化情况较为严重,自然解冻后的样品品质一般,低温解冻耗时最长,解冻效果较差,因此流水解冻效果较好。
2.3 不同解冻方式对蟹肉蛋白生化特性的影响
2.3.1 不同解冻方式对蟹肉肌原纤维蛋白含量的影响 从图2可以得出,经过低温解冻、微波解冻、自然解冻、流水解冻后的蟹肉肌原纤维蛋白含量分别为 65.66、63.56、66.49、65.57 mg/g。肌原纤维蛋白可以反应肌肉蛋白的变性程度,是重要的结构与功能蛋白[23]。图2中四种解冻方式下蟹肉肌原纤维蛋白含量差异不显著(p>0.05),说明这几种解冻方式对蟹肉肌原纤维蛋白含量影响不大。

图2 不同解冻方式对蟹肉肌原纤维蛋白含量的影响Fig.2 Effects of different thawing methods on the content of myofibrin in crab meat注:不同字母表示差异显著(p<0.05),下同。
2.3.2 不同解冻方式对蟹肉肌原纤维蛋白总巯基和活性巯基含量的影响 从图3可以看出,微波解冻后蟹肉的肌原纤维蛋白总巯基和活性巯基含量最低,分别为69.09、64.16 nmol/mg;自然解冻后蟹肉的肌原纤维蛋白总巯基和活性巯基含量分别为73.25、69.68 nmol/mg;流水解冻后肌原纤维蛋白总巯基和活性巯基含量分别为74.41、71.78 nmol/mg;低温解冻后肌原纤维蛋白总巯基和活性巯基最高,分别为77.51、72.05 nmol/mg。高泽磊等[24-25]提出,巯基含量的降低可能是由于蛋白质的交联,二硫键的聚集作用导致的,因此,巯基含量越高,说明蛋白氧化程度越低。以上结果表明,低温解冻后蟹肉蛋白交联程度低,二硫键聚集程度低,蛋白质氧化程度低,蟹肉品质较好,流水解冻效果仅次之。
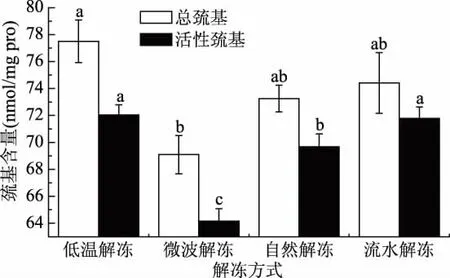
图3 不同解冻方式对蟹肉肌原纤维蛋白巯基含量的影响Fig.3 Effects of different thawing methods on the content of sulfhydryl in myofibrillary protein of crab meat
2.3.3 不同解冻方式对蟹肉肌原纤维蛋白表面疏水性的影响 表面疏水性可以说明蛋白表面疏水性氨基酸的含量,由于蛋白表面疏水基团的相互作用,表面疏水性氨基酸含量越高,生成的溴酚蓝结合量越高,蛋白质氧化程度越高[26]。从图4可以看出,微波解冻样表面疏水性最高为53.54μg,蛋白变性严重。流水解冻后样品表面疏水性最低为35.29μg。低温解冻及自然解冻的样品表面疏水性均较高。综合比较,可以说明流水解冻对肌原纤维蛋白的破坏最小。
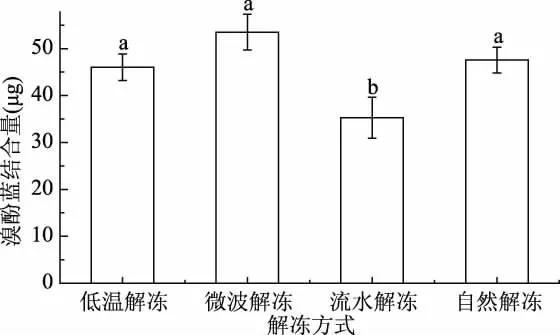
图4 不同解冻方式对蟹肉肌原纤维蛋白表面疏水性的影响Fig.4 Effects of different thawing methods on surface hydrophobicity of myofibrillar protein in crab meat
2.4 不同解冻方式对早熟蟹蟹肉滋味的影响
蟹肉独有的滋味是由于其含有特殊的呈味物质,天冬氨酸、谷氨酸、甘氨酸、精氨酸等是蟹肉中的主要呈味氨基酸[27]。从表2可以看出,低温解冻、微波解冻、流水解冻、自然解冻后样品游离氨基酸含量分别为 9.499、9.745、10.645、9.751 mg/g,流水解冻样含量最高。流水解冻后蟹肉中甘氨酸、丙氨酸、精氨酸含量分别为2.138、2.207、2.813 mg/g,均大于其呈味阀值,呈味氨基酸总量为7.158 mg/g,占总氨基酸比例最高,为67.24%;自然解冻最低,为61.63%。流水解冻后蟹肉中鲜味氨基酸和甜味氨基酸含量分别为0.320、5.059 mg/g,高于其它三种解冻方式;苦味氨基酸含量为0.468 mg/g,高于微波解冻样,低于低温解冻和自然解冻后的样品。以上结果表明,流水解冻能够较好地保留蟹肉滋味成分,因此该解冻方式适宜对冻藏早熟蟹进行解冻。
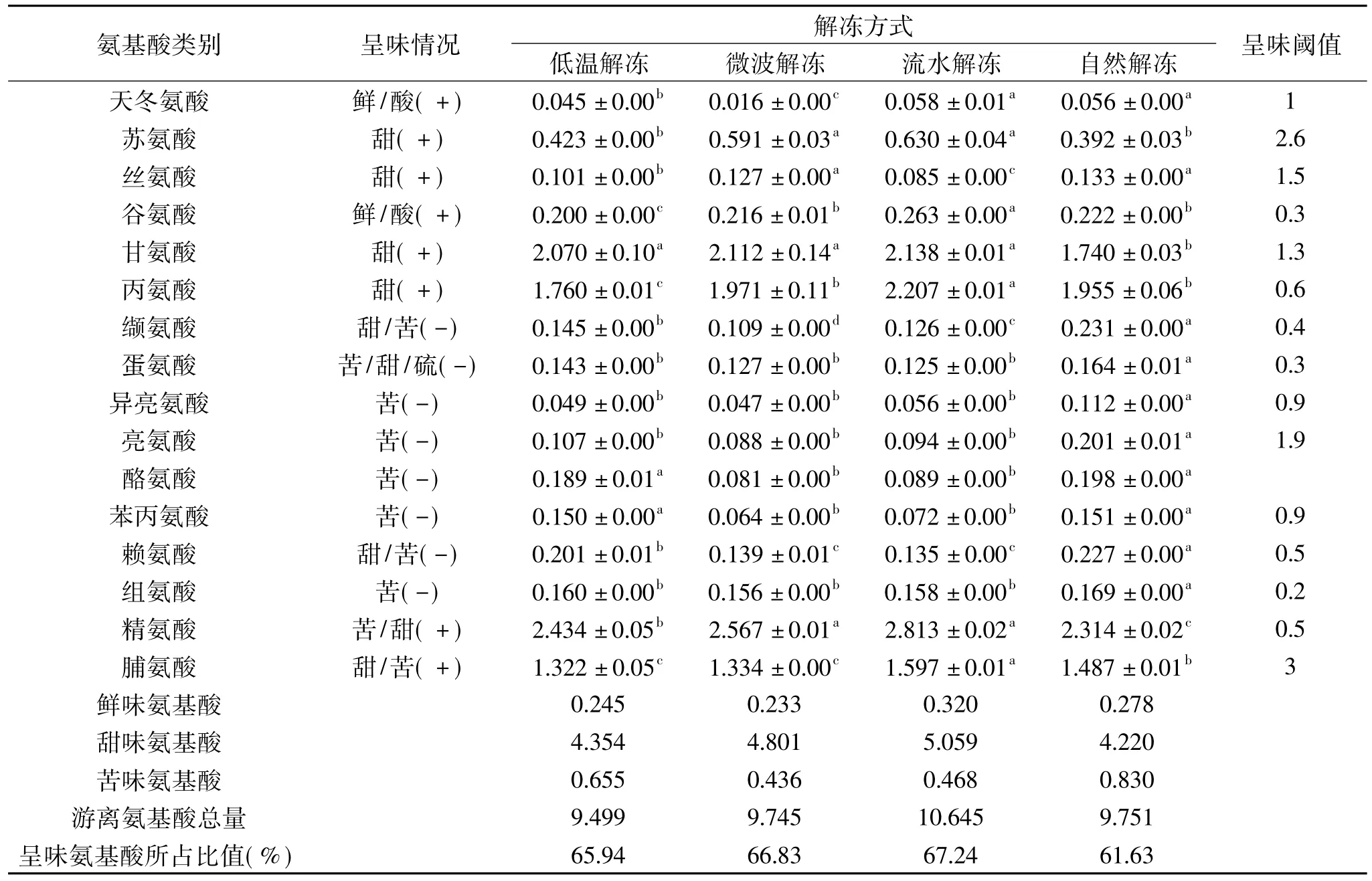
表2 不同解冻方式下的早熟中华绒螯蟹蟹肉中游离氨基酸含量的比较(mg/g)Table 2 Comparison of free amino acids contents in precocious Eriocheir sinensis meat with different thawing methods(mg/g)
3 结论
四种解冻方式中,微波解冻时间最短,为5 min,但脂质氧化严重,TBA值高达0.29 mg/100 g,样品品质下降明显;低温解冻蒸煮损失率最低,但长时间的解冻,造成微生物大量繁殖,导致蟹肉品质较差;自然解冻时间适中,但蒸煮损失率最高,解冻样品品质次于低温解冻样。流水解冻后样品的解冻损失率、蒸煮损失率、p H、TBA值、TVB-N值较低,肌原纤维蛋白性质相对稳定,巯基含量较高,表面疏水性低,说明流水解冻过程对样品品质破坏最小;游离氨基酸中的呈味氨基酸含量最高,为67.24%,说明流水解冻能够较好地保留样品原有的滋味。因此,流水解冻适宜作为冻藏早熟蟹的解冻方式。

