食品过敏原牡蛎成分PCR检测方法的初步研究
张懿翔,曲勤凤,余顺吉,胡雪莲,熊 薇,葛 宇
(上海市质量监督检验技术研究院,上海 200233)
食品过敏原是指能对特定人群产生免疫反应或者过敏反应的蛋白质和其他相关物质。食品过敏属于机体对外源物质产生的一种变态反应[1]。据统计,全球约有1%的成人和2.5%的儿童患有食物过敏症,每年因此造成150人以上的死亡以及超过2万人次的急救处理[2]。在发达国家约有6%的儿童和3%~4%的成年人被这种免疫介导性疾病所困扰[3-4]。食物过敏已被世界卫生组织列为21世纪重点防控疾病之一[5]。目前大约有160多种食品含有可以导致过敏反应的食品过敏原。尤其是对海产品成分过敏现象较为严重。近年来对于海产品过敏原的研究也日益增加,黄榕芳等[6]、伍慧妍等[7]、刘志刚等[8]发现海产品中软体类动物主要的过敏原是蛋白原肌球蛋白,曹际娟等[9]建立了对虾源性成分的PCR方法,沈海旺等[10]对甲壳类食品过敏原三维结构的研究,获得4种过敏原分子特征抗原表位及部分三维结构。牡蛎属于欧盟法规中食品过敏原的种类14个种类中的软体动物。目前对于甲壳类动物与软体动物之间具有交叉过敏原[11-13]的情况有一定报道,然而关于牡蛎过敏原的相关报道却较少。
牡蛎是常见的世界性的贝类,属于软体动物。在我国及世界其他国家都是一种营养价值很高的珍贵海产品,目前已发现有100多种,全世界濒海各国几乎都有存在[14]。牡蛎不仅是重要的食材,而且具有较高的药用价值,但同时牡蛎又可引起各种过敏反应症状,其食用安全性令人担忧,随着牡蛎相关保健品及其他产品的不断开发,对于牡蛎成分检测的需求也在提高。目前基于牡蛎线粒体基因分析的一些研究[15-16],虽然能够检测出牡蛎样品,但是其特异性不足,不能区分出相类似的样品(扇贝、蛤蜊等)。
针对上述问题,本研究旨在建立一种灵敏度高且特异性强的食品过敏原牡蛎成分的检测方法,以期能够快速有效的对牡蛎相关产品进行检测。
1 材料与方法
1.1 材料与仪器
海外牡蛎(澳洲、爱尔兰、法国、加拿大、丹麦) 上海市出入境检疫局;国产牡蛎(山东青岛、山东乳山、福建、浙江、海南等) 来自实验室收集样品;蛤蜊、扇贝、鲍鱼、靑鱼、虾、猪肉、牛肉、羊肉、牦牛肉、鸡肉、鸭肉、猫肉、大豆、玉米、大米、黄瓜、番茄、狗肉、蜗牛等阴性样品 为本实验室收集样品;海蛎干、海蚝罐头、耗油、蚝汁等牡蛎类产品 收集于市场或超市;SYBR Green I PCR扩增试剂2×SYBR® Premix Ex TaqTM(2X) ,货号RR420L 宝生物(大连)有限公司;商业化DNA提取试剂盒High Pure PCR Template Preparation Kit 瑞士Roche公司;十六烷基三甲基溴化铵(CTAB)提取液(54.9 mmol/L CTAB、1.4 mol/L NaCl、0.1 mol/L Tris-HCl、0.02 mol/L 乙二胺四乙酸(EDTA),pH8.0) 实验室自制。
Veriti 96 Well Thermal Cycler PCR仪;7500/7500 Fast Real Time PCR System实时荧光PCR仪 美国ABI公司;DYY-6C型电泳仪 北京六一仪器厂;UNIVERSAL HOOD II 凝胶成像仪 美国BIO-RAD公司;微量紫外分析仪DS-11 美国DeNovix公司;冷冻离心机 Centrifuge 5810R 德国Eppendorf公司;FreeZone 4.5 Plus冷冻干燥仪 美国Labconco公司。
1.2 实验方法
1.2.1 人工污染模拟样品 使用冷冻干燥仪将粉碎好的牛肉和牡蛎肉干燥再磨成粉末状,并于80 ℃烘干6 h。以牛肉为主要基质与其他样品配成牡蛎含量为10%、1%、0.1%的模拟样品。
1.2.2 样品DNA的提取 150 mg左右的样品中加入1 mL CTAB提取液(20 g/L CTAB,1.4 mol/L NaCl,0.1 mol/L Tris-HCl,0.02 mol/L Na2EDTA,pH8.0)和20 μL蛋白酶K溶液(20 mg/mL),56 ℃振荡2 h(或者过夜),13000×g离心5 min,转移上清液800 μL到新的离心管中,加入与上清液等体积的酚/氯仿/异戊醇(25∶24∶1)混合液用力振荡混合后,13000×g离心10 min,将上清液600 μL转移到新的离心管中,再次加入与上清液等体积的氯仿/异戊醇(24∶1)溶液,用力振荡混合后,13000×g离心10 min,将上清液400 μL转移到新的离心管中,加入2倍体积的预冷的无水乙醇溶液,混合均匀后室温放置20 min,13000×g(离心2 min,弃去上清液,加入1 mL 70%乙醇溶液洗涤沉淀2次,倒去乙醇溶液,晾干后加入200 μL TE溶液(1 mmol/L Tris-HCl,0.1 mmol/L Na2EDTA,pH8.0)溶解。DNA提取完成后,用微量紫外分析仪测定DNA浓度,所提取的样品的DNA溶液均稀释到工作浓度(约100 ng/μL)。对于一些含量较低的样品与深加工样品使用High Pure PCR Template Preparation Kit Roche试剂盒进一步纯化。
1.2.3 引物设计及筛选 引物设计:线粒体DNA标记,由于其基因分布的普遍性、序列和结构的相对保守性而被广泛应用于分子系统研究及种的鉴定等方面。利用DNASTAR软件针对牡蛎DNA中序列高度保守的三段基因序列,牡蛎线粒体DNA基因序列(AF177226.1)、细胞色素c氧化酶亚基1(COI)基因序列(AF300616.1)、牡蛎16Sr RNA基因序列(AY510450)设计10对引物,引物均由上海英潍捷基合成。
引物筛选:通过对牡蛎阳性样品扩增效果确定各个引物的最佳退火温度、初步筛选引物;选取扩增特异性最强、扩增效果与熔解曲线最适宜的引物,获得下列最佳引物。
AD-3(5′-3′):TGGGGCTTAGTTTGATAGTAG GTA,AD-4(5′-3′):TAGCTCCAGGGTTATAAAGTC TCC,365 bp。
1.2.4 PCR扩增条件优化 以牡蛎(样品)DNA为模板,使用筛选出的最佳引物进行实验。
普通PCR反应体系和反应条件:DNA模板1 μL,2×Mix 10 μL,上下游引物(10 μmol/L)各0.5 μL,用无菌水补至总体积为20 μL。扩增条件为:94 ℃,3 min;94 ℃,30 s,48 ℃,30 s,72 ℃,30 s,35个循环;72 ℃,7 min。取5 μL PCR产物,加1 μL 6X上样缓冲液点样进行电泳。PCR电泳检测所用的凝胶浓度为2.0%。阴性对照为不含牡蛎成分的样品,空白对照为无菌水。
SYBR Green I实时荧光PCR反应体系和反应条件:SYBR Premix Ex TaqTM2×10 μL,PCR上游引物(5 μmol/L)0.5 μL,PCR下游引物(5 μmol/L)0.5 μL,DNA模板1 μL,用灭菌蒸馏水补足20 μL的总反应体系。PCR反应程序(参照荧光SYBR Green I PCR扩增试剂的说明进行调整):预变性,95 ℃,30 s,循环数1;PCR反应,第一步,95 ℃变性5 s;第二步,65 ℃退火延伸34 s,同时在退火过程中收集荧光信号,共进行40个循环;熔解曲线分析:95 ℃,15 s;60 ℃,1 min;95 ℃,15 s。退火温度摸索范围为61~68 ℃。
1.2.5 PCR产物的测序验证 对PCR产物进行测序,然后于NCBI数据库(https://www.ncbi. nlm. nih.gov/)上进行BLAST,与牡蛎相关序列进行对比。
1.2.6 PCR检测灵敏度实验 用微量紫外分析仪测定通过提取得到的样品DNA浓度,用无菌去离子水将DNA溶液稀释成质量浓度分别为100、50、3.125、0.78、0.2、0.1、0.05、0.025、0.01 ng/μL的溶液,分别取1 μL进行普通PCR扩增以及荧光PCR扩增。反应体系同1.2.4,同时将牡蛎含量为10%、1%、0.1%的人工模拟污染样品提取DNA用于灵敏度实验。
1.3 数据处理
普通PCR结果通过电泳图谱分析,SYBR Green I实时荧光PCR的结果通过ABI 7500自带的曲线分析功能与Ct值数据确认牡蛎的特异峰与Tm温度。每个样品取至少双平行复孔,重复10次实验。TM温度通过各个阳性样品的平均值得出。
2 结果与分析
2.1 引物筛选PCR检测
分别对利用十对设计引物进行PCR扩增,根据特异性等条件筛选如图1。有6对引物能够成功扩增,于是又对上述引物进行SYBR Green I实时荧光PCR实验,只有AD-3,AD-4为上下游引物具有明显的扩增曲线与熔解曲线。

图1 PCR引物筛选Fig.1 Screening results of PCR primers 注:1~22:分别为设计的引物扩增结果;其中19、20为最终选择引物AD3、AD4的扩增结果。
最终选择引物AD-3,AD-4为最佳上下游引物,分别对十种牡蛎阳性样品进行PCR扩增,结果如图2所示,可以看出该引物能够扩增出牡蛎成分,扩增产物大小为365 bp。同时对其他二十余种动植物样品进行PCR扩增,结果样品与空白对照均为阴性如图3。

图2 阳性样品PCR结果Fig.2 Samples with positive PCR results注:1~10:牡蛎样品分别来自澳洲、爱尔兰、法国、加拿大、丹麦、山东青岛、山东乳山、福建、浙江、海南;11:阴性对照;12:空白对照。

图3 阴性样品PCR结果Fig.3 Samples with negative PCR results 注:1~3:为阳性对照、阴性对照、空白对照;4~22为牡蛎阴性样品蛤蜊、扇贝、鲍鱼、靑鱼、虾、猪肉、牛肉、羊肉、牦牛肉、鸡肉、鸭肉、猫肉、大豆、玉米、大米、黄瓜、番茄、狗肉、蜗牛。
2.2 PCR扩增结果的测序验证
通过对扩增产物进行测序,将其结果在NCBI上进行BLAST,结果显示与AF177226.1同源性达到了99%,如图4,同时与KJ855245.1、EU672831.1等牡蛎线粒体序列的同源性也达到了99%。

图4 测序产物BLAST结果Fig.4 Results of BLAST sequencing products
2.3 SYBR Green I荧光PCR结果分析
本实验分别对所收集样品进行SYBR Green I实时荧光PCR检测,获得了S型扩增曲线,得到PCR仪分析出的从基线到指数增长的拐点所对应的循环次数Ct值,结合熔解曲线与其对应的熔解温度(Tm)分析得到的特征峰(见图5),平均Tm值通过对各个样品收集数据计算出为80.08 ℃平均Ct值为19.40(见表1),所有牡蛎样品的Ct值和Tm值与阳性对照相符,由此通过基于SYBR Green I的熔解曲线分析荧光PCR方法可以快速的检测牡蛎成分。在实验过程中初步退火温度选择为60 ℃时,阴性样品中蛤蜊样品与扇贝样品出现了非特异性扩增。在进一步的实验中,分别选择61~68 ℃作为退火温度进行实验,当退火温度为63 ℃时,蛤蜊的Ct值在35左右,扇贝的Ct值在38左右,从熔解曲线分析可知牡蛎样品的特征峰值更高,而蛤蜊、扇贝等样品的特征峰偏低并且Tm值较牡蛎低。随着退火温度的升高(61~64 ℃)蛤蜊、扇贝样品的Ct值、Tm值下降但仍存在一部分非特异性扩增的情况,当退火温度提升至65 ℃时,基本能消除非特异性扩增,阴性样品均无S型扩增曲线出现,并且无特征峰和相应的Tm值(见图6),而退火温度提升至68 ℃时,虽然非特异性扩增被完全消除,但阳性样品的扩增也会受到一定抑制(见表2)。

图6 蛤蜊、扇贝、牡蛎阳性样品的熔解曲线、扩增曲线比较Fig.6 Comparison of dissolution curves and amplification curves for positive samples of clams,scallops and oysters注:a. 60 ℃退火熔解曲线;b. 60 ℃退火扩增曲线;c. 65 ℃退火熔解曲线;d. 65 ℃退火扩增曲线。

表1 牡蛎样品平均Tm值Table 1 Average Tm of oyster samples

表2 不同退火温度下样品Tm值Table 2 Tm of samples at different annealing temperatures

图5 牡蛎阳性样品的SYBR Green I熔解曲线Fig.5 Dissolution curves of SYBR Green Ifor positive oyster samples
2.4 牡蛎成分的PCR检测灵敏度
分别取1 μL浓度为100、50、12.5、3.125、0.78、0.2、0.1、0.05、0.025、0.01 ng/μL的样品DNA溶液进行普通PCR扩增以及SYBR Green I实时荧光PCR扩增。在检测中,普通PCR的电泳结果表明,可以明确检测出浓度为0.05 ng/μL的样品(见图7),当样品DNA浓度的进一步降低的情况下,电泳条带变得不明显,而同样的浓度使用荧光PCR时,则均出现扩增曲线,Ct值随着浓度的降低依次递减(见图8、表3),均出现熔解曲线的特征峰,可以检测出0.01 ng/μL浓度的阳性样品。对于人工模拟污染样品使用SYBR Green I方法检测,结果如图9,10%、1%、0.1%的样品均出现扩增曲线,且Ct值与Tm值符合预期,表明该方法能够在其他基质混合的样品中检测到牡蛎含量为0.1%的样品。
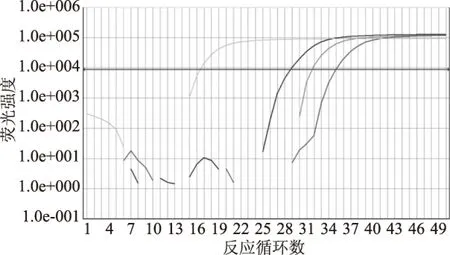
图9 人工污染模拟样品牡蛎成分荧光PCRFig.9 Real-time PCR for low concentration oyster samples注:从左到右牡蛎浓度依次为阳性样品、10%、1%、0.1%牡蛎含量样品。
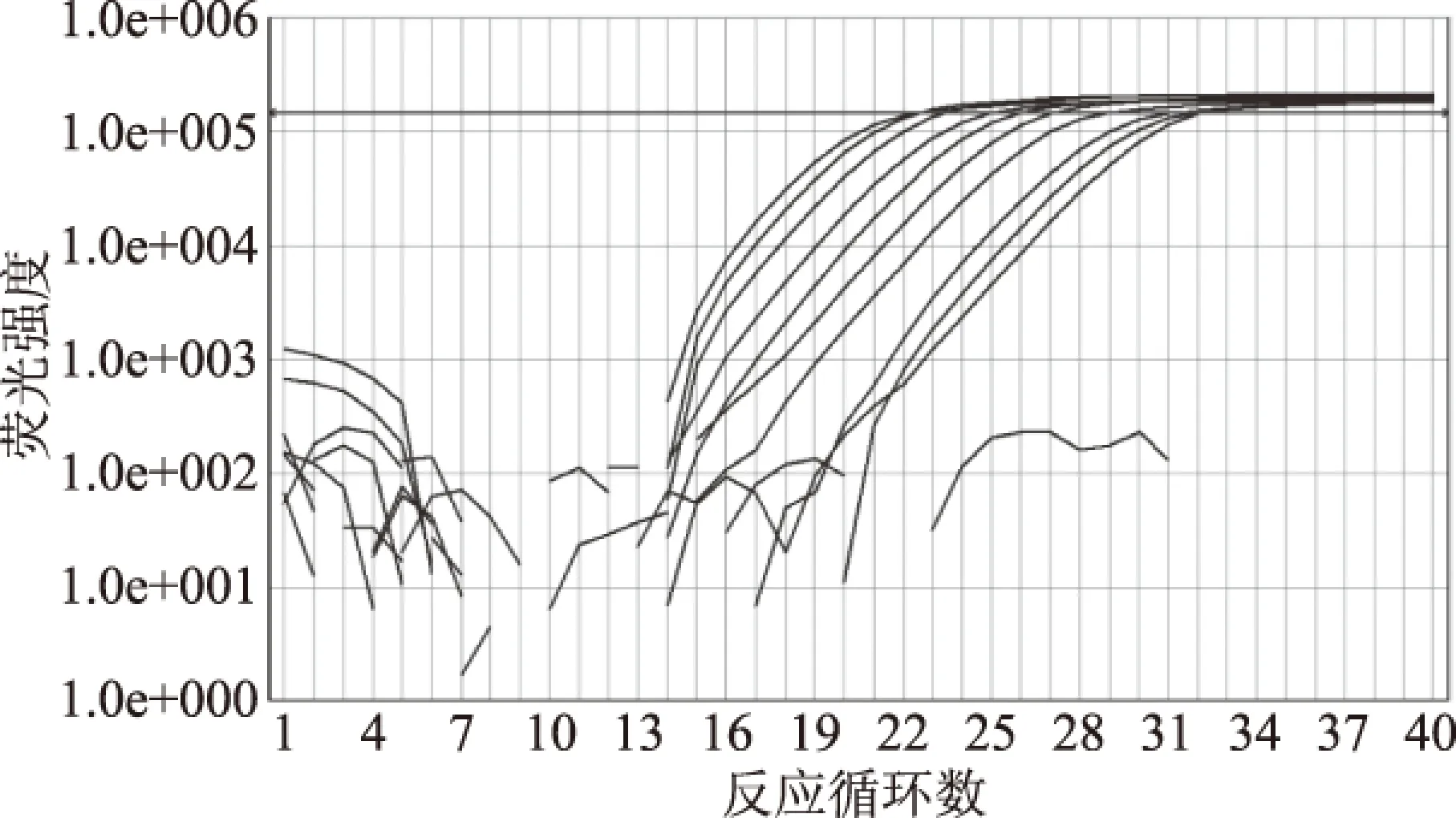
图8 牡蛎成分荧光PCR检测灵敏度Fig.8 Detection sensitivity of real-time PCR sensitivity for oyster samples注:从左到右牡蛎浓度依次为100、50、12.5、3.125、0.78、0.2、0.1、0.05、0.025、0.01 ng/μL。
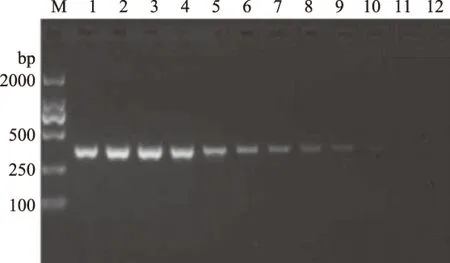
图7 牡蛎成分普通PCR检测灵敏度Fig.7 Detection sensitivity of normal PCR for oyster samples注:1~10:牡蛎浓度分别为100、50、12.5、3.125、0.78、0.2、0.1、0.05、0.025、0.01 ng/μL;11:阴性对照;12:空白对照。

表3 检测灵敏度Ct值Table 3 Ct of detection sensitivity
结果表明普通PCR的方法能够满足一般样品的检测,可作为结果确认的一种方法。而SYBR Green I实时荧光PCR的检测检出限更低,具有更高的灵敏度,通过熔解曲线可以排除一些非特异性扩增,能够满足更低浓度人工模拟污染样品的检测,所以选择此方法进一步对牡蛎相关产品进行实验。
在分析样品是否阳性时,要结合Ct值与熔解曲线进行判定,当Ct值小于35时且具有特异的Tm值时,样品牡蛎成分为阳性;当Ct值小于35,而无特异的Tm值时,应重复检测进行确证;当Ct值大于35,且无特异的Tm值时,样品牡蛎成分为阴性。
2.5 不同牡蛎产品的检测
运用建立的熔解曲线方法对市场收集的海蛎干、海蚝罐头、蚝油、蚝汁、牡蛎粉等样品进行检测,样品类型和检测结果见(见表4、表5),实验中几种即食产品(牡蛎干、牡蛎罐头)的Ct值<35且熔解曲线Tm值与牡蛎阳性样品相符((80.08±0.4) ℃),通过电泳验证也证实含有牡蛎成分;在牡蛎类保健品中,牡蛎粉都能检测出牡蛎成分,而部分胶囊和药片(成分为牡蛎提取物)的产品未能检测出牡蛎成分。对于深加工食品的检测效果,部分蚝油中检测到了信号微弱的牡蛎特异峰,然而样品中的Ct值与Tm值均不能同时符合阳性标准,因此未检测出牡蛎源性成分。

表4 牡蛎制品检测结果Table 4 Test results of oyster products
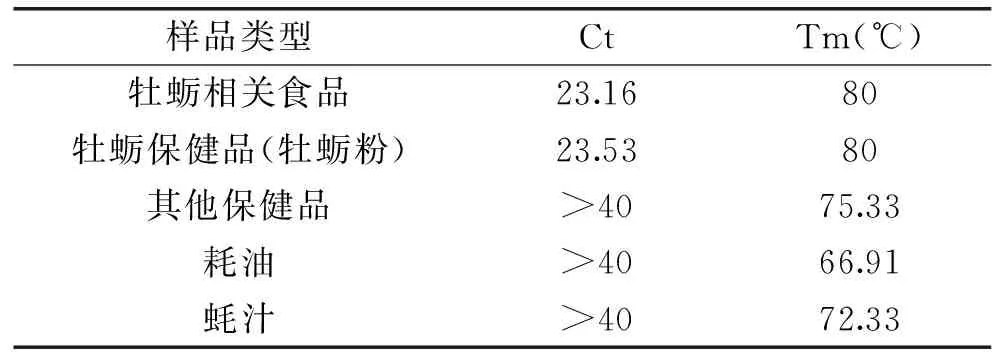
表5 牡蛎制品检测Ct、Tm值Table 5 Ct and Tm results of oyster products
3 结论
本试验利用普通PCR和SYBR Green I荧光PCR的方法进行分析检测牡蛎成分,普通PCR的方法阳性样品与阴性样品的电泳结果以及测序结果均与预期相符,而荧光PCR的检出限达到了0.01 ng/μL,同时适用于低浓度样品的检测,能够检测出牡蛎成分含量为0.1%的样品。通过结合Ct值与熔解曲线的特征峰Tm值分析,SYBR Green I荧光PCR的方法能更快的分析得到结果,不仅操作安全方便,检测方法特异性高,而且可以降低检测成本。针对容易出现非特异性扩增的样品(蛤蜊、扇贝)等样品进行检测,通过调整退火温度后,也具有良好的效果。
通过对牡蛎干、牡蛎粉等牡蛎食品及相关产品的检测,证明这本方法可以快速检测出过敏原牡蛎成分,其中对于收集到的食品相关产品以及保健品中牡蛎粉的检出率为100%。而对于深加工产品(如耗油、蚝汁)的检测中,可能影响结果的原因有:不同的蚝产品前处理方式不同,而且深加工样品DNA在加工过程中破坏较为严重导致提取出的DNA质量不高。样品在加工过程中添加的各类高盐、高渗类辅料对PCR反应产生抑制。样品中牡蛎成分添加量较低或未添加。由此造成提取DNA比较困难,得到的DNA质量也比较差,导致不能检测出牡蛎源性成分。在今后的实验研究中一方面需要对深加工样品进行前处理的优化,另一方面初步建立了探针和环介导等温扩增Lamp技术的方法进行比较检测,Lamp方法试验条件简单,更适合于现场在线检测。

