人参提取物对Ⅰ型干扰素及下游基因表达的调节作用
边 帅, 孙 雪, 韩小伟, 赵大庆, 王佳雯
(长春中医药大学, 吉林省人参科学研究院, 吉林 长春130117)
目前, 已知人体产生的干扰素共有13 种, 分为Ⅰ型、 Ⅱ型、 Ⅲ型三大家族, 其中Ⅰ型干扰素以干扰素-α、 干扰素-β 为主, 由先天性免疫细胞(单核细胞和淋巴细胞) 分泌, 是参与抗病毒免疫的重要效应分子; Ⅱ型干扰素为干扰素-γ, 主要由活化后的T 细胞分泌产生; Ⅲ型干扰素为几种干扰素-λ, 其已知的分布与功能都比较有限[1]。 Toll样受体及维甲酸诱导基因Ⅰ样受体途径是机体感染后产生Ⅰ型干扰素的两大主要途径, 可利用胞内信号分子传递来激活转录因子IRF3/7, 从而启动Ⅰ型干扰素基因表达[2]。 另外, 干扰素可通过促进下游一些干扰素刺激基因表达来达到抑制病毒复制的能力, 这些基因所编码的蛋白包括Mx1 蛋白、BST-2 蛋白、 APOBEC 家族蛋白、 TRIM 蛋白等[3]。
近年来, 对人参提取物及皂苷抗病毒的研究有了初步进展, 发现人参提取物及人参皂苷对多种病毒的感染及病毒感染后的细胞炎症或凋亡有一定抑制作用, 其中人参皂苷Re、 Rf、 Rg2能抑制柯萨奇病毒CVB3、 人鼻病毒HRV3、 肠道病毒EV71 感染[4]; Rb1、 Rg1处理细胞后显著降低猫杯状病毒FCV 和人甲肝病毒HAV 的感染率[5-6]; Rg3 能通过刺激TRAF6/TAK1 降解和抑制JNK/AP-1 信号通路来影响人乙肝病毒HBV 复制[7]; Rb2、 Rg3能保护新生小鼠免受轮状病毒的感染[8]。 同时, 人参提取物作用于细胞时, 可减少H9N2 型流感病毒感染所带来的细胞凋亡和DNA 损伤[9]; 对细胞进行人参提取物的预处理可降低鼠诺如病毒MNV 和FCV的感染[10]; 红参对HIV-1 患者生存期具有一定的延长作用[11], 这可能是通过调控一种或多种宿主抗病毒蛋白来完成, 如广谱抗病毒的APOBEC3G(A3G)、 BST-2 等因子, 从而限制了多种病毒的感染。
本实验以人参提取物为对象, 通过考察其对THP-1 细胞的作用来检测Ⅰ型干扰素表达和分泌变化, 同时测定下游抗病毒因子表达, 在分子水平上研究其抗病毒具体机制。
1 材料
1.1 细胞和试剂 人单核细胞THP-1 (编号TIB-202)、 HEK293T (编号CRL-11268) (ATCC 细胞库); DMEM 高糖培养基 (编号SH30022.01)、1640 培养基 (编号SH30809.01)、 双抗 (编号SV30010) (美国Hyclone 公司); 胎牛血清(美国Gibco 公司, 16000-044); DMSO (北京鼎国昌盛生物技术有限责任公司, 编号77H00150); Trizol( 美 国 Thermo Fisher Scientfic 公 司, 编 号15596026); 转染试剂X-tremeGENE siRNA (瑞士Roche 公司, 编号04476093001); ELISA 试剂盒(美国Cloud-Clone Corp 公司, 编号SEA033Hu、SEA222Hu); 反转录试剂盒(日本TaKaRa 公司,编号RR037 A); siRNA (上海吉玛制药技术有限公司); PCR 引物(长春华大中天生物技术有限公司)。
1.2 仪器 二氧化碳细胞培养箱(美国Thermo 公司); 生物安全柜(苏州净化设备有限公司); Infinite©200 Pro 多功能微孔板分析仪(瑞士Tecan公司); Real-Time PCR 仪(美国Bio-Rad 公司)。
2 方法
2.1 人参提取物制备 干燥人参根(产地吉林抚松) 粉碎-煎煮-浓缩-喷雾干燥-粉碎-过筛。 然后,取100 mg 成品(约为10 g 生药材) 溶于1 mL 无菌水中, 37 ℃下助溶, 测得人参总皂苷含有量≥10%。
2.2 干扰素分泌水平检测 THP-1 细胞接种于24孔板 中, 加 入 人 参 提 取 物 ( 终 质 量 浓 度0.5 mg/mL), 48 h 后收集细胞培养液, 离心去除细胞, 取上清液, 通过ELISA 法检测干扰素-α、干扰素-β 分泌情况。 操作过程如下: (1) 各组分和样品置于室温下; (2) 稀释对照品; (3) 将样品和对照品分别加入孔板中, 37 ℃下孵育2 h;(4) 移除液体, 加入稀释过的一抗, 37 ℃下孵育1 h; (5) 移除液体, 洗涤3 次; (6) 加入稀释过的二抗, 37 ℃下孵育0.5 h; (7) 移除液体, 洗涤5 次; (8) 加入显色液, 37 ℃下孵育10 ~20 min,避光; (9) 加入终止液, 450 nm 波长下检测, 根据标准曲线计算干扰素-α、 干扰素-β 浓度。
2.3 基因表达检测 THP-1 细胞接种于24 孔板中, 加入人参提取物, 24 h 后收集细胞, Trizol 法提取RNA 并检测其浓度, 通过逆转录酶及Oligo(dT) 进行逆转录PCR, 获得cDNA。 然后, 应用荧光标记试剂和特异性引物, 通过荧光定量PCR仪进行扩增, 收集数据, 分析相对mRNA 量。 引物序列见表1。

表1 引物序列Tab.1 Primer sequences
2.4 细胞培养和转染 THP-1 细胞培养于含10%胎牛血清的1640 培养基中, 培养温度37 ℃, CO2体积分数5%; HEK293T 培养于含10%胎牛血清的DMEM 高糖培养基中, 培养温度37 ℃, CO2体积分数5%。 然后, 使用X-tremeGENE siRNA 转染试剂, 按照使用说明书进行细胞转染。
2.5 统计学分析 通过SPSS 19.0 软件进行处理,样本率比较采用卡方检验, 样本均数比较采用成组设计的方差分析。 以P <0.05 为差异有统计学意义。
3 结果
3.1 人参提取物对Ⅰ型干扰素的诱导作用 图1显示, 与空白组比较, 人参提取物组干扰素-α 分泌水平显著提高(P<0.01), 达到(92±7) pg/mL左右, 但对干扰素-β 无明显影响(P>0.05)。

图1 人参提取物对干扰素-α、 干扰素-β 分泌水平的影响Fig.1 Effects of Ginseng Radix et Rhizoma extract on interferon-α and interferon-β secretion levels
3.2 人参提取物对干扰素-α 的诱导途径 图2 显示, 与空白组比较, 在THP-1、 293T 细胞中加入Ⅰ型干扰素诱导剂poly (I ∶C) 后, 培养上清中干扰素-α 分泌水平均显著提高(P<0.01); 人参提取物在THP-1 细胞中能显著诱导其表达(P <0.01), 但在293T 细胞中不明显(P>0.05)。
3.3 干扰素-α 下游基因表达 图3 显示, 与空白组比较, 人参提取物组BST-2、 APOBEC3G 表达显著提高(P<0.01)。
3.4 沉默干扰素-α 对BST-2、 APOBEC3G 表达的影响 图4 显示, 转染靶向干扰素-α 的siRNA 后干扰素-α 表达显著下降(P<0.01); 加入人参提取物后, BST-2、 APOBEC3G 表达显著提高(P <0.01); 但沉默干扰素-α 后, 即使再加入人参提取物两者表达也无明显提高(P>0.05)。
4 讨论
干扰素作为一种广谱抗病毒剂, 并不能直接杀伤或抑制病毒, 而是通过一系列细胞信号通路产生多种抗病毒蛋白, 从而抑制多种病毒复制, 同时它还可增强T 淋巴细胞、 自然杀伤细胞、 巨噬细胞活力, 起到免疫调节的作用, 并增强机体免疫力,目前正应用于病毒性肝炎、 手足口病、 HPV 感染等多种疾病的治疗中[12-15]。 研究表明, 多种中药提取物具有提高机体内源性干扰素表达的能力, 其中人参作为一种使用广泛的中药材, 被认为具有提高机体免疫力的作用[16-17]。 本实验发现, 人参提取物具有较强的诱导THP-1 细胞产生干扰素-α 作用, 但对干扰素-β 无诱导效果。

图2 人参提取物对THP-1、 293T 细胞中干扰素-α 分泌水平的影响Fig.2 Effects of Ginseng Radix et Rhizoma extract on interfeton-α secretion levels in THP-1 and 293T cells
干扰素-α 主要通过Toll 样受体及维甲酸诱导基因Ⅰ样受体途径来进行表达和分泌, 但在293T细胞中仅存在后一种途径诱导方式[18], 故通过该细胞可判断诱导方式是否与维甲酸诱导基因Ⅰ样受体途径相关。 本实验发现, 人参提取物无法激活293T 细胞内源性干扰素-α 分泌, 表明人参皂苷对干扰素-α 的诱导是通过Toll 样受体途径所致。
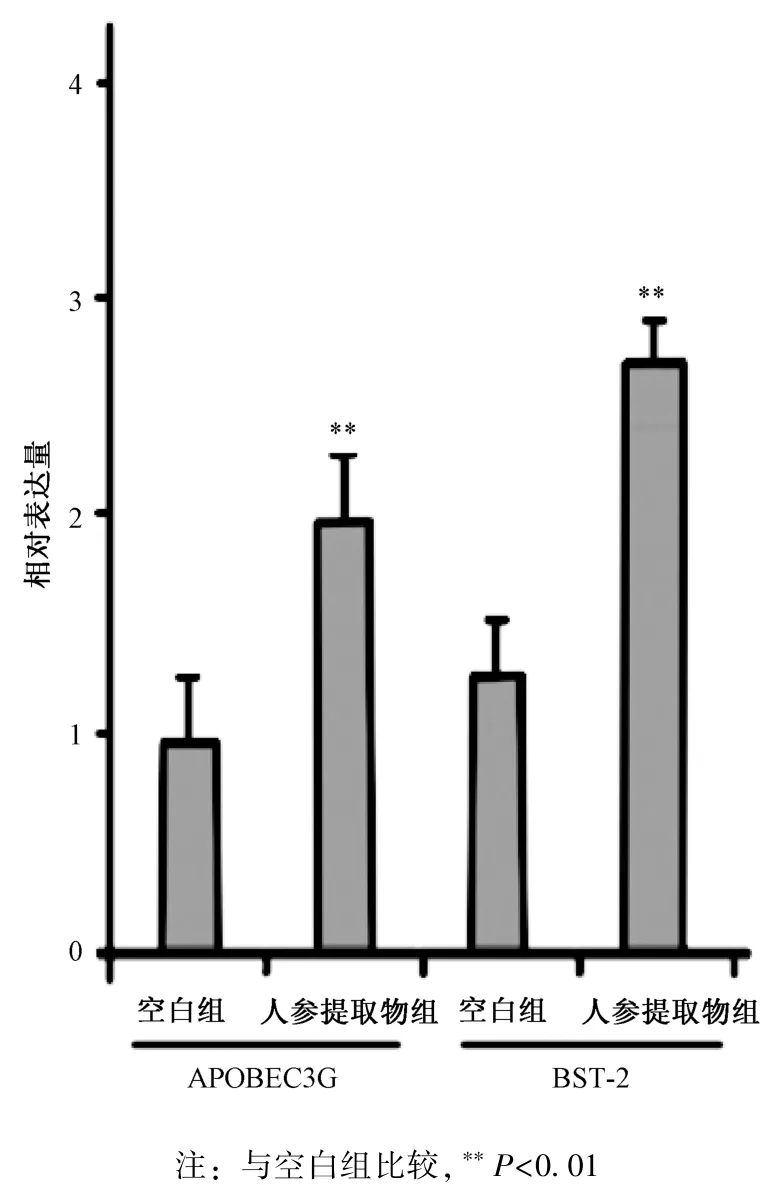
图3 人参提取物对BST-2、 APOBEC3G 表达的影响Fig.3 Effects of Ginseng Radix et Rhizoma extract on BST-2 and APOBEC3G expressions
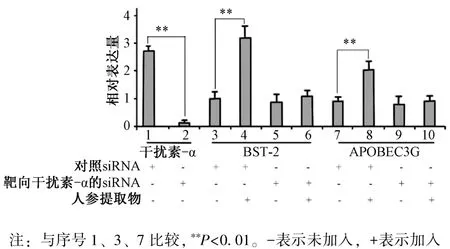
图4 沉默干扰素-α 对BST-2、 APOBEC3G 表达的影响Fig.4 Effects of silenced interferon-α on BST-2 and APOBEC3G expressions
BST-2、 APOBEC3G 是干扰素激活的2 种重要广谱抗病毒因子[19-20], 加入人参提取物后可提高两者表达。 但对干扰素-α 实施基因沉默技术后两者表达均受到抑制, 说明诱导得到的干扰素具备正常的激活抗病毒因子功能, 也提示人参提取物可能提高多种其他抗病毒因子表达, 并激活免疫细胞的活力,一定程度上揭示了人参提高免疫力的分子机制。

