大孔吸附树脂纯化刺梨多酚工艺的优化
刘祖望, 许梦捷, 黄 真, 程汝滨, 钟晓明
(浙江中医药大学, 浙江 杭州310053)
多酚是一类含有羟基和苯环的极性化合物, 包括类黄酮、 酚酸、 单宁(水解和缩合)、 二苯乙烯、 木质素等, 主要分布在植物的叶、 花、 果实中, 对人体健康和营养平衡具有重要作用[1], 在抗炎、 抗肿瘤、 护肝、 抗氧化、 清除自由基、 抑菌等方面具有良好的作用, 显示了广泛的应用前景[2-4]。 此外, 该成分还能有效抑制活性氧及自由基所造成的机体损伤[5], 吸收日光中大部分200 ~300 nm 强紫外线辐射, 起到“紫外线过滤器” 作用[6]。 因此, 在日本有人将植物多酚称为继第六营养素膳食纤维之后的“第七类营养素”[7]。
刺梨为蔷薇科植物单瓣缫丝花Rosa roxburghii Tratt.、 缫 丝 花 Rosa roxburghii Tratt. f. normalis Rehd. et Wils. 的果实, 又名茨梨、 木梨子、 文先果, 为贵州省少数民族用药[8], 其果实营养丰富,具有预防癌症、 抗衰老、 抗动脉粥样硬化、 抗心血管疾病等作用[9-11], 含有多酚、 黄酮、 多糖、 三萜等成分, 其中对黄酮、 多糖的研究相对较多[12-13],而对多酚的研究尚处于起步阶段, 研究表明该成分具有较强的清除自由基等药理作用[14-15]。 为了更好地开发利用刺梨多酚, 本实验考察4 种大孔吸附树脂对该成分的吸附和解吸性能, 以期优化纯化工艺, 为后续相关研究奠定基础, 也有利于刺梨资源和相关产品的深入开发利用, 提高当地经济水平。
1 材料
1.1 试药 刺梨购自香如故食品销售有限公司,经浙江中医药大学中药资源研究所陈孔荣副教授鉴定为单瓣缫丝花Rosa roxburghii Tratt. 的干燥果实。乙醇 (国药集团化学试剂有限公司, 批号20170317); 无水碳酸钠(宁波市化学试剂有限公司, 批号20070728); 福林酚试剂(北京索莱宝科技有限公司, 批号818H017); 没食子酸对照品(北京普天同创生物科技有限公司, 批号17022801)。 ADS-17、 HPD-600、 AB-8、 NKA-9 型大孔吸附树脂购自沧州宝恩吸附材料科技有限公司, 具体物理参数见表1。

表1 大孔吸附树脂物理参数Tab.1 Physical parameters for macroporous adsorption resins
1.2 仪器 电子天平(常州市幸运电子设备有限公司); UV-1800 型紫外可见分光光度计(日本岛津公司); 恒温水浴锅(上海宜昌仪器纱筛厂);超声波清洗机(宁波新艺超声设备有限公司); 层析柱(1.0 cm×15.0 cm)。
2 方法及结果
2.1 多酚提取 干燥果实粉碎, 过50 目筛, 称取适量粉末, 加入100 倍量70%乙醇, 250 W、 30 ℃下超声提取40 min。 过滤, 浓缩, 得粗多酚浸膏。
2.2 多酚含有量测定
2.2.1 供试品溶液制备 取适量粗多酚转移至100 mL 量瓶中, 蒸馏水定容, 摇匀, 即得。
2.2.2 对照品溶液制备 精密称取没食子酸对照品10.0 mg, 置于5 mL 棕色量瓶中, 蒸馏水定容,摇 匀, 得 2 mg/mL 母 液, 蒸 馏 水 稀 释 至0.1 mg/mL, 即得。
2.2.3 检测波长选择 采用Folin-Ciocaltean 法测定多酚含有量[16]。 吸取对照品溶液120 μL, 置于锡箔纸包裹不透光的5 mL 离心管中, 加入蒸馏水至500 μL 后, 再加入0.5 mL 福林酚试剂, 混匀,避光反应2 min, 接着加入2 mL 10%Na2CO3溶液,最后加入1 mL 蒸馏水, 摇匀, 置于40 ℃恒温水浴锅中暗浴30 min, 在200 ~800 nm 波长处扫描。 最终确定, 检测波长为760 nm。
2.2.4 线性关系考察 精密称取对照品溶液30、40、 60、 80、 100、 120、 140、 160、 180 μL, 置于锡箔纸包裹不透光的5 mL 离心管中, 按“2.2.3”项下方法处理, 测定760 nm 波长处的吸光度。 以没食子酸质量浓度为横坐标(X), 吸光度为纵坐标(A) 进行回归, 得到回归方程为A =151.71X+0.009 6 (R2=0.999 5), 在0.4~21.0 μg/mL 范围内线性关系良好。
2.2.5 精密度试验 精密吸取对照品溶液120 μL,按“2.2.3” 项下方法于760 nm 波长处测定吸光度, 连续6 次, 测得其RSD 为0.8%, 表明仪器精密度良好。
2.2.6 重复性试验 取同一份供试品溶液, 按“2.2.3” 项下方法于760 nm 波长处测定吸光度,连续6 次, 测得其RSD 为1.7%, 表明该方法重复性良好。
2.2.7 稳定性试验 取供试品溶液, 在0、 2、 4、8、 16、 24 h 按“2.2.3” 项下方法于760 nm 波长处测定吸光度, 测得其RSD 为2.8%, 表明溶液在24 h 内稳定性良好。
2.2.8 加样回收率试验 取质量浓度已知的供试品溶液60 μL, 加入60 μL 对照品溶液混合, 同法制备6 份, 按“2.2.3” 项下方法于760 nm 波长处测定吸光度, 测得其平均加样回收率为97.6%,RSD 为2.0%。
2.3 树脂性能评价
2.3.1 预处理 将干净树脂用2 倍量95%乙醇浸泡24 h 以除杂, 并使其充分溶胀, 然后用95%乙醇淋洗至淋出液无白色浑浊, 再用蒸馏水淋洗至无醇味, 保存于蒸馏水中备用。
2.3.2 静态吸附量、 解吸率的计算 将树脂滤干,精密称取1.0 g 于250 mL 具塞锥形瓶中。 取粗多酚1 g, 溶于200 mL 蒸馏水中, 测得其多酚质量浓度(C0), 取50 mL 加到含树脂的锥形瓶中, 于30 ℃恒温水浴锅中水浴24 h, 定时摇晃, 每隔一段时间吸取上清液测定吸光度, 测得溶液中剩余多酚质量浓度(C1), 根据式(1) 计算静态吸附量[16](Qs表示吸附量, V 表示粗提液体积, M 表示树脂质量)。

然后, 将充分吸附24 h 的树脂取出, 过滤,置于250 mL 具塞锥形瓶中, 加入70%乙醇50 mL,于30 ℃恒温水浴锅中水浴24 h, 定时摇晃, 每隔一段时间吸取上清液测定吸光度, 测得溶液中剩余多酚质量浓度(C2), 根据式(2) 计算解吸率(D 表示解吸率, V′表示解吸液体积, Q′表示吸附多酚量g)。

由图1 可知, 4 种大孔吸附树脂均可在短时间吸附大量多酚, 并且在吸附时间8 h 时基本达到平衡, 其中AB-8 型吸附量最大(8.19 mg/g), 其次是 HPD-600 型 ( 7.87 mg/g )、 NKA-9 型(6.69 mg/g), ADS-17 型最小(4.17 mg/g); 4 种大孔吸附树脂在解吸初期均具有较大的解吸速率,并且在2 h 时基本达到平衡。 其中AB-8 型解吸率最大(91.47%), 其次是ADS-17 型(87.55%),NKA-9 型、 HPD-600 型较小(71.78%、 63.72%)。综上所述, AB-8 型大孔吸附树脂不仅能在短时间内吸附大量多酚, 而且解吸率高, 解吸速度快, 故选择其作进一步研究。
接着, 称取5 g 树脂装柱, 取0.8 mg/mL 多酚粗提液, 以2 mL/min 体积流量过树脂柱, 分段收集流出液, 每10 mL 为1 份, 共收集30 份, 测定各份流出液中多酚质量浓度, 以其质量浓度为上样液质量浓度的10% 作为泄露点, 100% 作为饱和点[17]。 再称取5 g 树脂充分吸附1 h, 70%乙醇以2 mL/min 体积流量解吸, 分段收集流出液, 每10 mL为1 份, 共收集20 份, 测定各份流出液中多酚质量浓度。
由表2 可知, 随着上样液体积流量增大, 流出液中多酚含有量符合“S” 型增长趋势[18], 流出

图1 大孔吸附树脂吸附、 解吸曲线Fig.1 Absorption and desorption curves for macroporous adsorption resins
60 mL 时, 流出液中多酚质量浓度为0.08 mg/mL,到达 泄 露 点; 200 mL 时, 其 质 量 浓 度 为0.79 mg/mL, 与原溶液基本一致, 到达饱和点,故确定上样量为200 mL。 在解吸初始阶段, 吸附在大孔树脂上的多酚即大量吸出, 解吸液体积为20 mL 时, 流出液中多酚质量浓度达到2.85 mg/mL; 40 mL 时, 其质量浓度达到最大值5.87 mg/mL; 随着体积进一步增加, 其质量浓度开始下降, 在160 mL 时仅为0.10 mg/mL, 可认为解吸基本完成, 故确定解吸液体积为160 mL。

表2 曲线泄露、 解吸液体积Tab.2 Leakage and desorption solution volumes of curves
2.4 吸附单因素试验 固定相应因素不变, 考察上样液体积流量(1、 2、 3、 4、 5 mL/min)、 质量浓度 (0.6、 0.7、 0.8、 0.9、 1.0 mg/mL)、 pH(4、 5、 6、 7、 8) 对吸附量的影响。
由图2A 可知, 上样液体积流量为1 mL/min时吸附量最大, 达到8.17 mg/g; 其体积流量逐渐增大时, 吸附量随之减小, 在大于3 mL/min 时更显著。 上样液体积流量过大时, 多酚尚未被树脂吸附即流出, 导致吸附量较小; 过小时, 会导致操作时间过长, 增加成本, 而且在3 mL/min 时吸附量仍在7 mg/g 以上, 故选择其作为响应面水平。
由图 2B 可知, 上样液质量浓度低于0.8 mg/mL时, 吸附量随着其增大而显著提高; 大于0.8 mg/mL 时, 吸附量趋于平稳, 在1 mg/mL时达到最大值8.16 mg/g, 之后有下降趋势。 上样液质量浓度过低时, 溶液中多酚尚未与树脂充分接触即吸出, 从而造成漏液现象; 过高时, 溶液中杂质增多, 与多酚产生竞争关系, 导致吸附量较小,同时可能会生成沉淀, 故选择0.8 mg/mL 作为响应面水平。
由图2C 可知, 吸附量随着pH 升高而增大,在6 时达到最大值8.17 mg/g, 之后随着pH 进一步升高而呈现降低趋势。 多酚以酚酸类为主, 故溶液具有一定酸性, 而pH 高低会引起多酚存在形式的变化, 即在酸性条件下有利于大孔吸附树脂对该成分的吸附。 经测定, 上样液pH 为5.9, 与最大吸附效果下pH 6 相近, 故选择不作调节的上样液作为响应面水平。
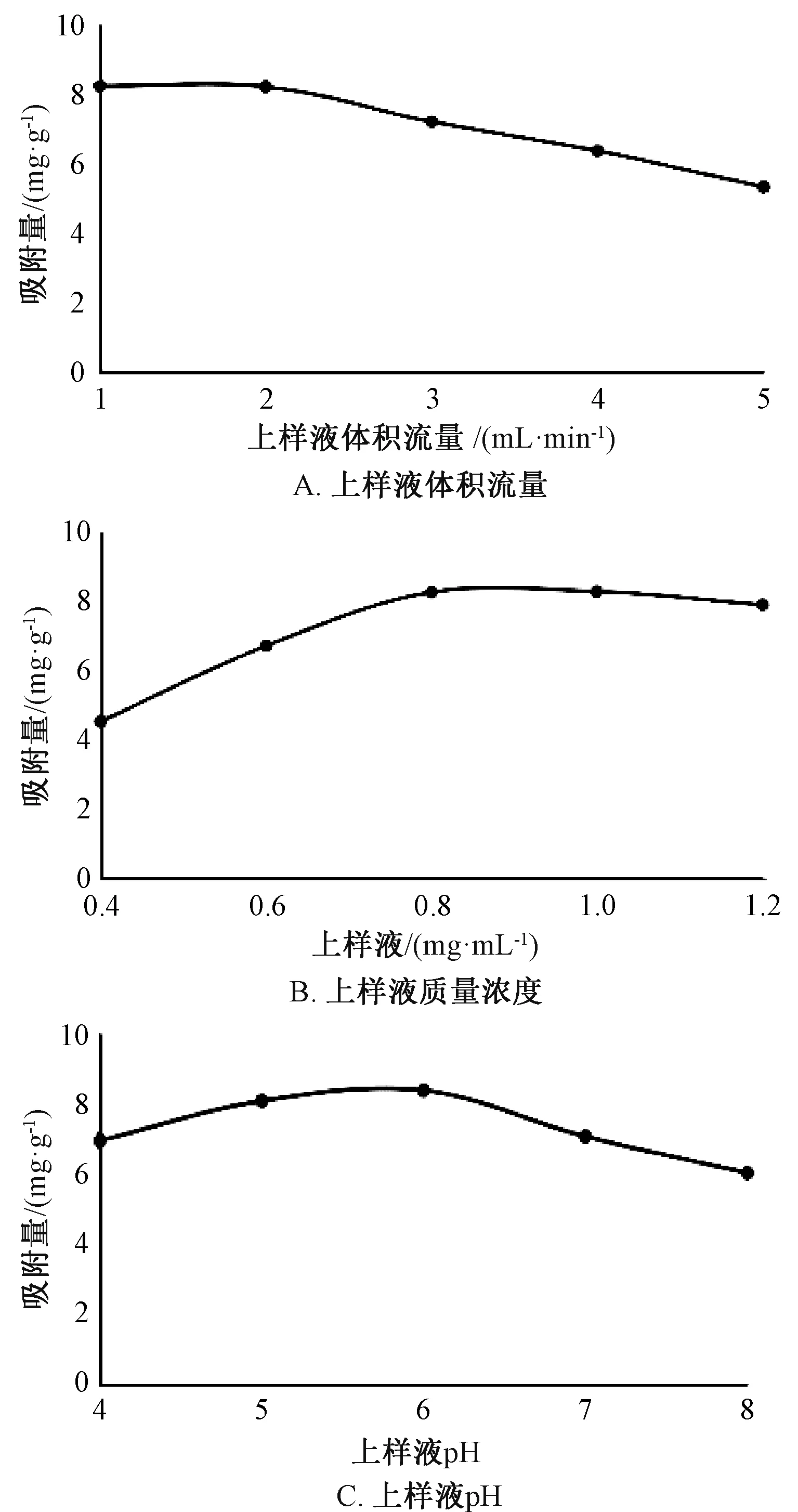
图2 吸附单因素试验结果Fig.2 Results of single factor tests for absorption
2.5 解吸单因素试验 固定相应因素不变, 考察解吸 液 ( 乙 醇) 体 积 流 量 ( 1、 2、 3、 4、5 mL/min)、 体积分数(50%、 60%、 70%、 80%、90%)、 pH (4、 5、 6、 7、 8) 对解吸率的影响。
由图3A 可知, 随着解吸液体积流量增大, 解吸 率 逐 渐 降 低, 1 mL/min 时 为 92.14%, 而5 mL/min时仅为80.15%, 这可能是因为解吸液体积流量较大时, 它与大孔吸附树脂的接触时间较短, 导致多酚无法从大孔吸附树脂中充分解吸出来, 最终造成解吸率降低, 但体积流量过低会造成时间、 成本大幅上升。 由于解吸液体积流量为3 mL/min时, 解吸率仍能达到85% 以上, 故选择其作为响应面水平。
由图3B 可知, 解吸液体积分数低于70% 时,解吸率随着其增大而提高, 在70% 时达到最大值92.51%, 但之后随着其体积分数进一步增大反而减小, 在90%时仅为79.14%, 故选择70%作为响应面水平。
由图3C 可知, 解吸液pH 小于6 时, 随着其增大解吸率提高, 在6 时达到最大值93.12%; pH大于6 时, 解吸率随着其增大反而降低, 这可能与多酚呈酸性有关, 故选择6 作为响应面水平。

图3 解吸单因素试验结果Fig.3 Results of single factor tests for desorption
2.6 响应面法优化 依据中心组合试验设计原理,通过Design-Expert 软件, 选择上样液体积流量(A1)、 上样液质量浓度(B1)、 上样液pH (C1)作为影响因素, 吸附量作为评价指标; 选择解吸液体积流量(A2)、 解吸液体积分数(B2)、 解吸液pH (C2) 作为影响因素, 解吸率作为评价指标。因素水平见表3。

表3 因素水平Tab.3 Factors and levels
在单因素试验基础上, 通过Design-Expert 软件设计3 因素3 水平共17 个试验点, 结果见表4, 得到吸附量(Y1) 回归方程为Y1=8.17-0.025A1-0.086B1-0.34C1-0.010A1B1+0.13A1C1+0.077B1C1-0.14-0.25-0.93, 解吸率(Y2) 回归方程为Y2=92.95-2.66A2-0.81B2+1.10C2-1.51A2B2-1.19A2C2+2.18B2C2-8.95-4.11-3.89, 方差分析见表5。 由表可知, 吸附模型显著 (P <0.05), 准 确 性 和 通 用 性 良 好 (R2=0.937 9,=0.858 0), 各因素影响程度依次为上样液pH(C1) >上样液质量浓度(B1) >上样液体积流量(A1); 解吸模型显著(P<0.05), 失拟度不显著(P>0.05), 准确性和通用性良好(R2=0.995 6,=0.990 0), 各因素影响程度依次为解吸液体积流量(A2) >解吸液pH (C2) >解吸液质量浓度 (B2)。

表4 试验设计及结果Tab.4 Design and results of tests
响应面分析见图4~5, 可知最优吸附条件为上样 液 体 积 流 量 2.65 mL/min, 质 量 浓 度0.72 mg/mL, pH 5.59, 吸附量8.22 mg/g; 最优解吸条件为解吸液体积流量2.69 mL/min, 体积分数69.4%, pH 6.3, 解吸率93.26%。
2.7 验证试验 根据响应面法结果进行修正, 最终确定最优吸附条件为上样液体积流量2.6 mL/min, 质量浓度0.7 mg/mL, pH 5.9; 最优解吸条件为解吸液体积流量2.7 mL/min, 体积分数69%, pH 6.3, 再进行3 批验证试验, 结果见表6, 可知模型拟合效果良好, 可信度高。 同时, 多酚回收率为20.37%, 其含有量由原来的7.40%提高到36.33%, 是纯化前的4.9 倍。

表5 方差分析Tab.5 Analysis of variance

图4 各因素响应面图(吸附)Fig.4 Response surface plots for various factors (absorption)

表6 验证试验结果(n=3)Tab.6 Results of verification tests (n=3)
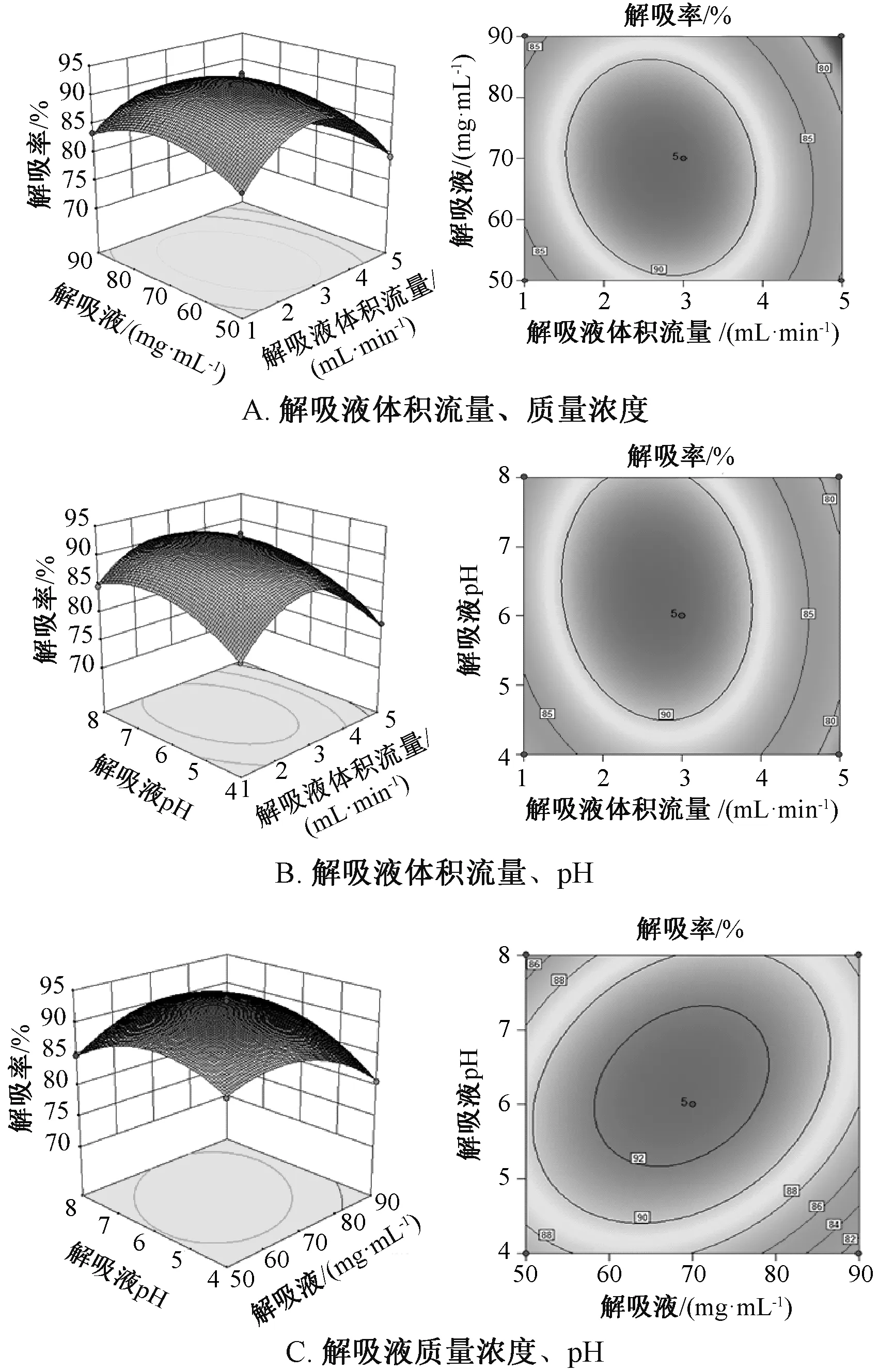
图5 各因素响应面图(解吸)Fig.5 Response surface plots for various factors(desorption)
3 讨论
目前, 关于多酚纯化工艺优化的研究主要是通过正交试验结果, 但其难以筛选出因素最佳组合;响应面法采用多元二次回归方程来拟合因素与响应值之间的函数关系, 通过分析回归方程来寻找最优工艺参数, 从而解决多变量问题, 在提高药用植物提取效率方面具有广阔的应用前景[19-20], 故本实验采用该方法优化大孔吸附树脂纯化刺梨多酚工艺。 研究表明, 多酚药理活性与其纯度密切相关[21-22], 由于刺梨多酚在刺梨果实中的含有量较低, 提取后粗多酚中杂质较多, 故为了加快该成分的开发利用进程, 针对其纯化研究必不可少。 本实验发现, 优化后该成分纯度显著提高, 进一步验证了响应面法的优势。
刺梨为云贵高原特有的野生植物, 其适应性强, 易栽种, 而且果实中含有大量黄酮、 维生素、多糖等成分, 具有广阔的应用前景。 但目前对刺梨的开发利用仅限于其果脯、 果汁, 同时刺梨多酚作为其重要有效成分, 相关研究尚处于起步阶段, 尚无其提取和纯化工艺报道。 本实验通过响应面法优化大孔吸附树脂纯化刺梨多酚工艺, 确定了最佳吸附、 解吸条件, 可有效提高提取物中该成分纯度,为其后续药理评价奠定基础, 也给以其为原料的化妆品、 饮料等相关产品开发提供技术保障。

