三级淋巴样组织在肿瘤微环境中的形成及作用
李 晖,金向宇,洪 卫
(浙江省肿瘤医院肿瘤内科,杭州 310022)
免疫细胞招募和聚集是实体肿瘤微环境的重要特征,并随着肿瘤类型、分期及个体情况的差异呈现出现广泛异质性[1]。免疫细胞在肿瘤中的作用也随着免疫检查点抑制剂的临床应用而日益受到愈来愈多的关注。免疫细胞一方面具备针对肿瘤的特异性免疫应答进而控制肿瘤的作用,另一方面肿瘤微环境中大量炎性细胞的浸润也是造成肿瘤微环境中免疫抑制的重要原因[2-5]。针对免疫细胞在肿瘤患者的分期、预后及临床治疗效果中的作用已经进行了较为深入的研究,同时通过恢复免疫细胞的活化进而控制肿瘤的设想也从理论上进入了临床实践[6]。三级淋巴样组织(tertiary lymphoid tissue,TLS)是慢性感染、肿瘤中出现的具备次级淋巴样组织类似结构并具有启动免疫应答能力的新生免疫结构[7-8]。该结构的形成对于塑造肿瘤微环境中的免疫表型,从而决定肿瘤生物学行为具有重要意义。现就TLS的形成及机制进行综述,分析该结构在肿瘤微环境免疫应答中的作用,进而概述总结其在临床实践中的应用价值。
1 肿瘤微环境
1.1肿瘤微环境的异质性 肿瘤微环境是由多种细胞包括肿瘤细胞、免疫细胞、内皮细胞、成纤维细胞及基质等相互作用形成的网络性的微生态系统[5]。其中,免疫细胞是免疫微环境极为重要的部分,肿瘤微环境在很大程度上反映了机体免疫与肿瘤细胞相互博弈的动态过程,因此,深入分析肿瘤微环境中免疫细胞浸润的位置、密度及类型对于明确肿瘤免疫的状态是极为关键而有效的参数。随着免疫检测点抑制剂的临床应用,免疫微环境中浸润的免疫细胞得到越来越多的关注,其在肿瘤不同生物学进程中多样性的功能备受关注。总之,肿瘤浸润免疫细胞同时扮演完全相反的角色:一方面淋巴细胞通过适应性免疫应答发挥免疫监视功能;另一方面免疫细胞产生的炎性环境提供了肿瘤发生、发展及转移的重要环境基础[3-4]。因此,在肿瘤微环境中既有发挥抗肿瘤作用的活化的T淋巴细胞,又存在M2型巨噬细胞、髓系来源抑制细胞及调节性T细胞等免疫抑制细胞[9-11]。这种看似自相矛盾的情况却在同时存在于肿瘤微环境中,而两部分的平衡则因肿瘤部位及分期的不同存在较大差异。基于此,旨在恢复免疫细胞杀伤肿瘤能力或逆转抑制性的免疫环境的免疫治疗策略以细胞毒T淋巴细胞相关抗原4及程序性细胞死亡受体1/程序性细胞死亡配体1单抗在临床的应用得以实践。但如何更全面且准确地把握肿瘤发生不同阶段介导免疫细胞抗肿瘤的具体因素,并将其应用到临床实践中仍处于起始阶段。肿瘤细胞的异质性对于肿瘤微环境中浸润的免疫细胞数量、种类、位置及预后有重要意义。利用此特点通过检测免疫细胞浸润情况评估肿瘤的生物学特点及临床病理特征是目前研究的热点。一般认为,肿瘤微环境中浸润T淋巴细胞往往与术后患者的预后密切相关[12],另有学者认为采用免疫细胞浸润进行分期对于临床预后的预测较TNM分期未见明显差异[13]。
1.2肿瘤免疫循环 随着临床及转化性研究数据的积累,Chen和Mellman[14]提出了肿瘤免疫循环理论,该理论全面地论述了以T细胞为代表的适应性免疫细胞实现肿瘤细胞杀伤的7个关键步骤:①肿瘤抗原的释放;②肿瘤抗原的呈递;③T细胞预刺激及活化;④T细胞迁移至肿瘤部位;⑤T细胞浸润至肿瘤内部;⑥肿瘤细胞被T细胞识别;⑦T细胞杀伤肿瘤细胞。其中,T细胞的活化建立在适当的抗原释放,正确的抗原呈递以及合适的预刺激基础上,而T细胞活化一般发生在次级淋巴组织中,但在肿瘤中往往缺乏特异性的次级淋巴组织。而有多位学者观察到在肿瘤免疫及炎症免疫的微环境中存在一种类似淋巴结的TLS结构[15-16]。TLS具备一个完整淋巴结的结构,包括包含成熟树突状细胞(dendritic cells,DC)的T细胞区域;包含滤泡DC、增殖的B细胞及高内皮静脉(high endothelial venule,HEV)的生发中心区域[17-18],并能够成功而有效地触发适应性免疫应答[19-20]。鉴于TLS在诱发适应性免疫应答中的重要作用,很多研究发现其与肿瘤的临床预后密切相关[9,16,21-24]。
2 TLS的形成与肿瘤微环境
2.1次级淋巴结的形成 在胚胎发育时期,次级淋巴结的形成依赖于造血前体诱导细胞与基质形成细胞的相互作用[25]。而这种相互作用主要是由表达于基质形成细胞表面的淋巴毒素β受体及表达于前体诱导细胞表面的相应配体介导的,两者结合后可诱导基质形成细胞表面表达特异性的黏附分子,包括血管细胞黏附分子1、细胞间黏附分子(intercellular adhesion molecule,ICAM)-1、黏膜黏附分子1以及淋巴形成趋化因子,包括CC趋化因子配体[chemokine (C-C motif) ligand,CCL]19、CCL21及CXC趋化因子配体[chemokine (C-X-C motif) ligand,CXCL]13,进而招募T细胞及B细胞组织性的聚集。TLS的形成与次级淋巴结的形成过程类似[26]。受到来自肿瘤微环境导致淋巴样结构形成的各种信号刺激,基质细胞活化后亦可通过表达多种黏附分子启动TLS的形成,而肿瘤微环境中的各种炎性因子则可促进这一进程的发生。临床前研究发现组织特异性过表达淋巴毒素α或CCL21和CXCL13可诱导TLS的形成[8,27-29],而这些基因的缺失造成多种感染及自身免疫性疾病动物模型的病理部位中TLS的形成障碍[28,30]。
2.2肿瘤微环境中TLS的形成 无论是免疫细胞聚集还是细胞代谢出入,都需要血管和淋巴管提供畅通的道路,因此,在TLS形成过程中脉管系统的构建是极为关键的步骤。首先,基质细胞表面的淋巴毒素β受体激活后可诱导下游的淋巴血管形成相关基因表达,如血管内皮生长因子C、血管内皮生长因子D、成纤维细胞生长因子2等,从而进一步诱导淋巴管内皮透明质酸受体1阳性淋巴管的形成[31-32]。其次,血管及淋巴管内皮细胞与周围免疫细胞(如DC)之间的相互作用对组织内脉管系统的维续也较为重要。以目前研究较为清楚的HEV为例,在多种实体瘤组织中,HEV的密度与患者的临床预后明显相关,还对T细胞的招募有正性调控作用[26]。在偶氮甲烷/硫酸葡聚糖诱导的肠癌模型中,肿瘤组织的TLS明显多于正常组织,而其中T细胞的浸润与CD31的表达及外周淋巴结地址素(peripheral node addressin,PNAd)阳性HEV明显相关。尾静脉注射绿色荧光蛋白标记的脾淋巴细胞更多地在肿瘤的TLS中聚集,而在正常组织中并未发现,也进一步证实TLS在招募免疫细胞中的重要作用[24]。
肿瘤微环境中的TLS最早发现于肺癌及黑色素瘤。Ladanyi等[33]在黑色素瘤原位肿瘤术后标本中发现TLS中溶酶体相关膜糖蛋白(lysosome-associated membrane glycoprotein,LAMP)阳性的成熟DC与肿瘤微环境中活化T细胞的浸润以及患者的无病生存期呈正相关。而在非小细胞肺癌中,DC-LAMP+成熟DC选择性的聚集于T细胞浸润区域,并且与生发中心区域(包含Ki-67阳性B细胞、滤泡T辅助细胞、CD68+巨噬细胞以及CD21+CD23+滤泡CD)邻近[34]。肿瘤微环境中的TLS被特异性的PNAd阳性血管和淋巴管包围,脉管内皮细胞表面还表达多种黏附分子(如ICAM-2、ICAM-3、血管细胞黏附分子1)及黏膜地址素细胞黏附分子1,从而形成典型的HEV系统[34]。而在肿瘤微环境中HEV往往与TLS共存,也从另一个侧面说明HEV对于TLS形成的关键作用。进一步研究发现,TLS浸润的淋巴细胞表面大部分表达PNAd的CD62配体,而TLS中则组成性表达一系列招募免疫细胞的黏附分子及趋化因子,如黏附分子(ICAM-2、ICAM-3、血管细胞黏附分子1、黏膜黏附分子1)、整合素(αL、α4、αD)、趋化因子(CCL19、CCL21、CXCL13)、CC趋化因子受体4配体(CCL17、CCL22)[15]。
目前无法严格的区分是典型的TLS还是简单的淋巴细胞聚集,已有大量研究报道了类似于TLS的结构在多种人类肿瘤组织中发现,如结直肠癌[24]、乳腺癌[21,23]、黑色素瘤[23,35]、黏膜相关淋巴组织淋巴瘤[36]以及非小细胞肺癌[15,23]。进一步的研究发现[16],无论是在早期(接受新辅助化疗)还是转移性阶段的肿瘤中均发现TLS存在,说明TLS的产生是肿瘤中较为普遍的现象。而在TLS结构方面也存在较大异质性,有研究发现在黑色素瘤的转移病灶中,淋巴样组织区域中T/B细胞、HEV、滤泡DC及DC的聚集并不完全相同,多种细胞可以不同组合进行聚集,从而形成不同成熟程度的淋巴样组织[35]。不仅如此,在不同的原发肿瘤中存在的淋巴样组织亦差别较大。有学者分析了多种肿瘤的肺转移灶中淋巴样组织的差别,发现来源于肺癌、前列腺以及结肠癌的肺转移灶较乳腺癌及肾癌的肺转移灶具有更高密度的TLS[37]。
3 TLS与抗肿瘤免疫应答
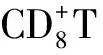
4 TLS与临床预后
5 结 语
TLS作为肿瘤微环境中的重要组成部分,在临床预后中的价值已得到学术界的公认,而使用不同的TLS标志物并没有改变对临床预后的价值。因此,TLS作为肿瘤局部形成的淋巴结类似结构对于肿瘤微环境中淋巴细胞的招募、活化和增殖均具有无可替代的作用,这也提示通过恰当的临床治疗策略如肿瘤疫苗、免疫检测点抑制剂等增加肿瘤微环境中TLS的密度,对于塑造正性的抗肿瘤免疫应答,从而改善患者的无病生存期、无进展生存期甚至总生存期均是未来的研究方向。但TLS产生的具体机制,如何调控肿瘤免疫应答,如何与肿瘤局部沟通、交流等一系列问题尚无结论,仍需大量的基础研究和临床转化性研究深入挖掘。相信随着对整个肿瘤免疫更清晰的认知,TLS将会在已经到来的肿瘤免疫治疗时代发挥重要作用。

