同位素稀释技术结合超高效液相色谱-四极杆/线性离子阱质谱快速精准测定饲料及原料中16种霉菌毒素
符金华, 杨琳芬, 董泽民*, 徐国茂, 姜文娟 , 邢 磊,黄艳清, 李瑾瑾, 周仁丹, 叶 金, 吴 宇, 廖 丰
(1.江西省兽药饲料监察所,江西南昌 330096;2.南昌大学分析测试中心,江西南昌 330047;3.国家粮食局科学研究院,北京西城 100037;4.双胞胎(集团)股份有限公司,江西南昌 330096)
霉菌毒素是真菌在适宜环境条件下产生的次级代谢产物,其对人和畜禽具有致癌、致畸、致突变作用(朱聪英等,2010)。饲料及其原料特别易于被霉菌毒素污染(Binder等,2007),从而降低饲料的口感与质量,给畜牧业发展和畜产品安全造成极大的危害。其中,对人和畜禽毒性较大毒害的主要有黄曲霉毒素、呕吐毒素、T-2毒素和玉米赤霉烯酮等数十种(Marin 等,2013;郑翠梅等,2012)。因此,饲料及原料中各种毒素的限量和检测要求日趋严格。
目前,霉菌毒素的检测方法主要有薄层色谱法(TLC) 、荧光/酶联免疫法(ELISA) 、高效液相色谱法(HPLC)及气相色谱串联质谱(GC-MS)等(朱 聪英等 ,2010;Cavaliere 等,2007;Chiar 等 ,2007)。虽然在一定程度上能够满足目前部分毒素的检测,但也存在诸多问题。如TLC法的稳定性和重复性差,易受外界环境的干扰;ELISA法通常作为筛选方法,不能准确定量,且易出现假阳性;HPLC法容易受到基质干扰,检测通量不够,且部分毒素的检测限达不到限量标准要求;GC-MS法的操作步骤繁琐,衍生化的效率低等。另外,实际的饲料样品中霉菌毒素污染通常是多种霉菌毒素同时污染 (Monbaliu等,2009),而这些方法检测的毒素种类比较单一。
因此,开发出饲料及原料中多种霉菌毒素一步检测方法具有十分重要的现实意义。超高效液相色谱-串联质谱(HPLC-MS/MS)是一种集高效分离和多组分同时定性、定量于一体的检测技术,具有较强抗基体干扰能力、高通量、高选择性、高灵敏度等优势,成为近年来痕量检测中发展非常快的新技术之一 (Markus等,2012;Johannes等,2012;Mira等,2010;Micheal等,2009)。 但HPLC-MS/MS法均需要专用的前处理设备耗材,提取净化步骤繁琐,且霉菌毒素的检测种类面仍然比较窄 (Shephard 等,2012;赵孔祥等,2011)。 本研究建立了一种饲料及原料中16种霉菌毒素的超高效液相色谱-四极杆/线性离子阱质谱检测法(Q-trap-UPLC-MS/MS)。样品经简单的提取、同位素稀释后直接检测,不需要过多功能净化柱及脱脂等操作,实现了一次前处理和一针进样,同时精确检测16种霉菌毒素。该方法具有操作简单、快速、低成本、定量准确,对批量饲料及原料样品中霉菌毒素的快速监测意义重大。
1 实验部分
1.1 仪器和试剂 质谱型号为Sciex4500 Qtrap(美国 Sciex公司);液相为岛津LC-20AD XR(日本Shimadzu公司);赫西离心机(中国 湖南赫西仪器装备有限公司);HY-3多功能振荡器 (中国江苏光都机电设备有限公司):Milli-Q超纯水纯化系统(美国Millipore公司);METTLER TOLEDO ME104分析天平(中国 梅特勒-托利多(上海)有限公司)。
甲醇、乙腈(HPLC级,德国Merck公司);乙酸铵、甲酸、乙酸(HPLC 级,美国 Sigma公司);0.2 μm PTFE膜针头过滤器 (PALL公司);实验用水为Milli-Q超纯水。分别移取一定体积的16种霉菌毒素标准溶液 (浓度为0.01~2.5μg/mL,购自Romer公司)于10mL容量瓶中,水定容,得到16种霉菌毒素混标,于-20℃保存,浓度详见表1。
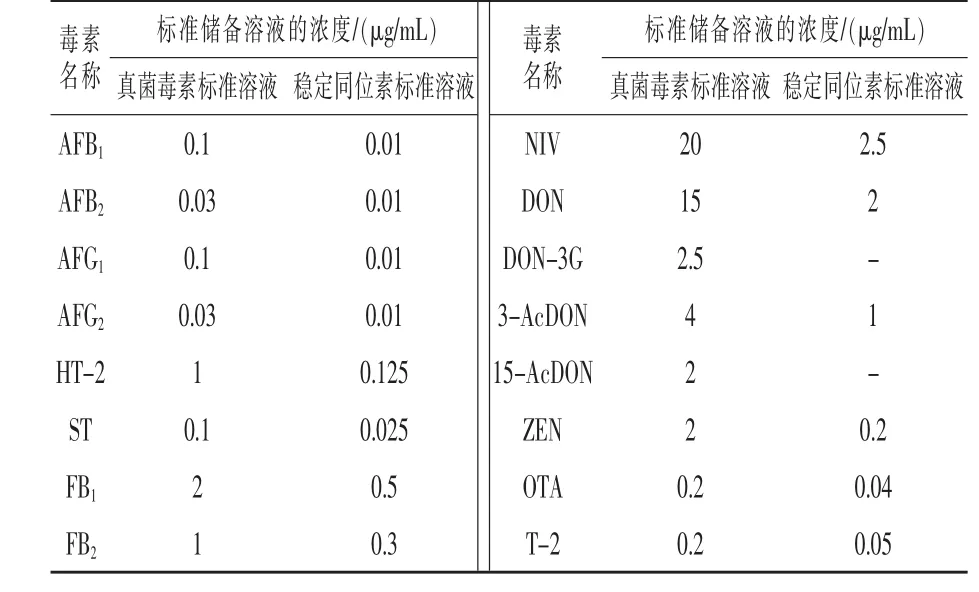
表1 真菌毒素混合标准储备液的浓度及相应的稳定同位素混合溶液
稳定同位素内标混合工作液:分别移取一定体积的14种霉菌毒素稳定同位素单标 (浓度为0.01~2.5μg/mL,购自 Romer公司)于 4mL储液瓶中,用水稀释至2mL配制稳定同位素混标,充分混匀后于-20℃避光保存。准确移取适量混合标准中间储备液,用乙腈-水-乙酸溶液(35:64.5:0.5)逐级稀释,配制成不同浓度系列的混合标准工作液。向400μL内插管中加入20μL 14种稳定同位素混合工作液,再分别吸取180μL系列标准工作液于内插管中,涡旋混匀后准备上机检测。1.2 实验方法 液相色谱条件:Waters公司CORTECSTM UPLC C18柱 (100 mm ×2.1 mm,1.6μm);柱温40℃;进样量2μL;流动相A为甲醇,B为含0.1%(体积分数)的甲酸和1mmol/L乙酸铵的水溶液;流速为0.3mL/min;采用梯度洗脱。
质谱条件:加热电喷雾离子源温度为500℃;喷雾电压为5500 V;离子传输管温度为320℃;gas1和 gas2均为50 psi,气帘气为35 psi。EPI扫描速度 10000 Da/s,扫描质量范围50~1000,分段多反应监测扫描模式,MRM检测窗口设置为30 s,锥孔电压50 V;正、负离子采集;监测离子、碰撞池能量等参数见表2。
称取饲料样品 (5±0.1)g于50mL离心管中,准确加入 20mL 乙腈/水/乙酸 (V/V/V:70/29/1)提取溶剂,涡旋2min,振荡30min,以4000 r/min离心10min使固液分离。准确转移0.5mL上清液于1.5 mL离心管中,加入0.5 mL水稀释,涡旋混匀1 min,然后以12 000 r/min离心10min,取上清液用0.22μm的PTFE滤膜过滤,吸取20μL预先涡旋混匀的稳定同位素混合溶液于400μL内插管中,再加入180μL的样品滤液,混合后待测。
2 结果与讨论
2.1 实验条件考察 本研究选择的样品前处理提取溶剂为乙腈/水/乙酸(V/V/V:70/29/1),提取液经直接提取稀释,加入同位素内标后,上机检测。选择含有0.1%甲酸的1mmol/L NH4Ac的水相作为弱洗脱流动相,甲醇为强洗脱流动相,且采用梯度洗脱程序。质谱采用正、负离子模式下获得[M+H]+、[M+NH4]+吸收峰,采用分段多反应监测模式(MRM)扫描模式,离子源温度为500℃,驻留时间为100ms,得到精确保留时间和选择离子精确质量数、信号采集的特征离子对及质谱条件见表2。

表2 16种真菌毒素的精确保留时间、质量数及质谱条件
按照上述优化的条件,得到了16种毒素的高质量离子信号、低干扰离子信号及理想的总离子色谱峰(图 1)。

图1 16种真菌毒素标准混合溶液的总离子流色谱图
2.2 方法学考察
2.2.1 基质效应 常见5大类配合饲料和4种原料的基质效应见图2所示。以目标物在空白基质液中的峰面积与溶剂中峰面积的百分比来评估基质效应,当结果接近100%时,表明无明显的基质效应,而高于100%说明有基质增强效应,低于100%则说明有基质抑制效应。在5类配合饲料和4种原料基质中,16种霉菌毒素的基质效应较为相似。FB1、FB2、OTA和T2四种毒素呈现基质增强效 应 ,DON、DON-3G、3-AcDON、15-AcDON、AFB1、AFB2、AFG1、AFG2、NIV 及 ZEN 等 10 种 毒素呈现基质抑制效应,HT-2和ST毒素的基质效应较弱。在5类配合饲料和4种原料中,各霉菌毒素的基质效应分别为60.3%~122.3%和54.0%~124.3%,说明存在一定的基质增强或抑制效应。
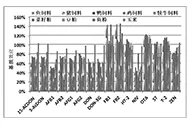
图2 16种霉菌毒素在5种配合饲料及4种原料中的基质效应(n=3)
然而,基质匹配标准曲线是一种常见的减少基质效应的方法,但由于霉菌毒素污染的普遍性,空白基质不易获得,特别是完全匹配的基质更难获得,而代表性基质的普适性面临挑战,具有较大的不确定性,导致基质匹配定量在标准化检测中的应用受到局限。因此,为了更好消除基质效应的影响,本实验采用稳定同位素稀释法进行定量,以确保结果的准确可靠。
2.2.2 线性范围、检出限及定量下限 由表3可知,在各自的线性范围内,16种霉菌毒素线性关系良好,相关系数(R2)均>0.998。对混合标准溶液进行逐级稀释,以3倍信噪比(S/N)计算检出限(LOD),10倍信噪比计算定量下限(LOQ)。 16种霉菌毒素的LOQ均低于我国和欧盟规定的饲料及原料中的限量值,说明本方法可以满足日常检测的需要。

表3 16种霉菌毒素的线性范围、检出限及定量下限
2.2.3 准确度与精密度 取16种霉菌毒素含量较低(低于方法检出限)的5类常见的配合饲料和4种常见的饲料原料样品。分别添加高、中、低3个浓度水平的混合标准溶液,每个加标水平进行6次重复实验,添加浓度、回收率及相对标准偏差(RSD)见表4和表5。其中,16种霉菌毒素在5种常见配合饲料中的回收率绝大数为70.2%~129.5%,只有极个别毒素的回收率为66.9%~69.9%。如犊牛饲料中AFG1、DON、DON-3G毒素的回收率偏低,FB1、FB2毒素的回收率偏高;但FB1、FB2毒素在鱼、鸭饲料中的回收率偏低,这可能与这些饲料中含有菜籽粕、DDGS等原料有关,且与基质效应的结果保持一致。同时,16种霉菌毒素回收率的RSD值均在0.1%~14.5%。
16种霉菌毒素在豆粕、玉米、菜籽粕和鱼粉4种常见的饲料原料中的回收率绝大部分为80.2% ~116.1%,只有FB1、FB2毒素在豆粕中的回收率为66.4%~70.9%,稍微偏低,这可能是豆粕中的蛋白质含量较高,对部分毒素具有一定的吸附性而造成。同时,所有16种毒素回收率的RSD值均在0.1%~7.7%,两大类基质中的回收率和RSD均符合相关法规的检测要求。
2.2.4 质控样品的考察 为了进一步验证本方法的准确性和适用性,使用本方法FAPAS能力测试玉米样品。结果如表6所示,证书标示的8种真菌毒素的检测值均在范围内,且接近标示中值,表明本方法准确可靠。相比于传统的商品化MycoSpin 400多毒素净化小柱和普通三重四极杆质谱 (安捷伦6410B)的检测方法,两种方法的相对平均偏差均不大于7.1%,结果无显著性差异。但Qtrap质谱技术结合稳定同位素稀释方法定量更加简单,且无需对样品提取液进行净化,对多目标物的分析时可有效减少建立仪器方法的难度与时间,便于实验室快速建立准确可靠的定量方法以开展批量样品的日常检测。
2.3 实际样品检测 按照上述优化的各项条件,16种霉菌毒素的系列混合标准溶液进行上机分析,以稳定同位素稀释法进行定量。结果表明,16种毒素标准品能够有效分离,得到精确保留时间。同时,得到了所有的选择离子精确质量,质量数与理论计算值非常接近。因此,16种毒素的HPLC/MS/MS方法条件优化完成,可以满足实际应用于样品的日常检测。
采用本研究中建立的方法对某地区的134份猪饲料、禽饲料、牛饲料及各种原料样品进行检测。 饲料卫生标准(GB 13078-2001,2001)规定了饲料及原料中最高限量的6种霉菌毒素:AFB1、ZEN和DON超标率分别为4.5%、3.0%、2.2%,T-2、(FB1+FB2)及OTA 超标率均为0.0%。对饲料卫生标准未规定限量值的其他毒素,参考本方法中各毒素的检出限,16种毒素的检测数据见表7和表8。结果显示,其他尚没有限量值的霉菌毒素均有 不 同 程 度 的 检 出 ,15-AcDON、AFG1、AFG2、DON-3G、AFB2、HT-2、ST 等毒素的检出较高,均超过80%。说明了近年来由于气候的异常,可能导致我国部分地区的饲料及原料中霉菌毒素污染较为普遍。因此,加强日常监测尤为重要,而本方法可适用于大量饲料及原料样品中多毒素污染的风险预警及快速准确定量筛查。
3 结论
基于Q-trap-UPLC-MS/MS结合稳定同位素稀释技术,建立了饲料及原料中16种霉菌毒素的快速准确检测方法。样品通过简单的提取、稀释、离心和过膜等步骤即可上机检测,无需净化操作。采用加标回收法和测定基体标准物质验证了方法的准确度和精密度,方法可适用于国内外的饲料及原料中霉菌毒素的限量检测要求。本方法前处理快速,有效避免了基质效应的干扰及检测结果准确,可满足日常批量饲料及原料样品中霉菌毒素快速定性和精确定量分析的要求。

表4 常见5种饲料中16种霉菌毒素的回收率与相对标准偏差(n=6)

表5 常见4种饲料原料中16种真菌毒素的回收率与相对标准偏差(n=6)
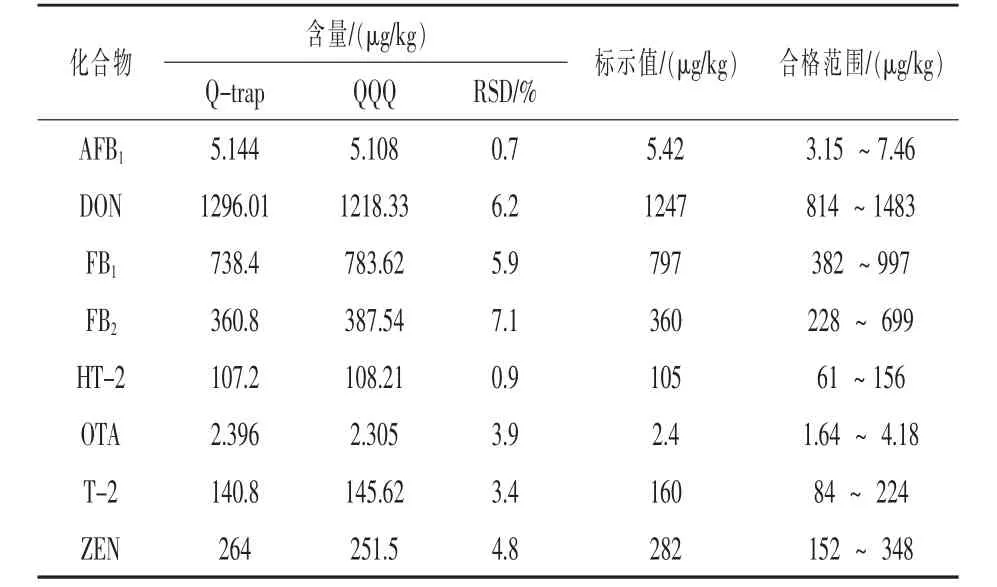
表6 FAPAS能力测试样品的检测结果
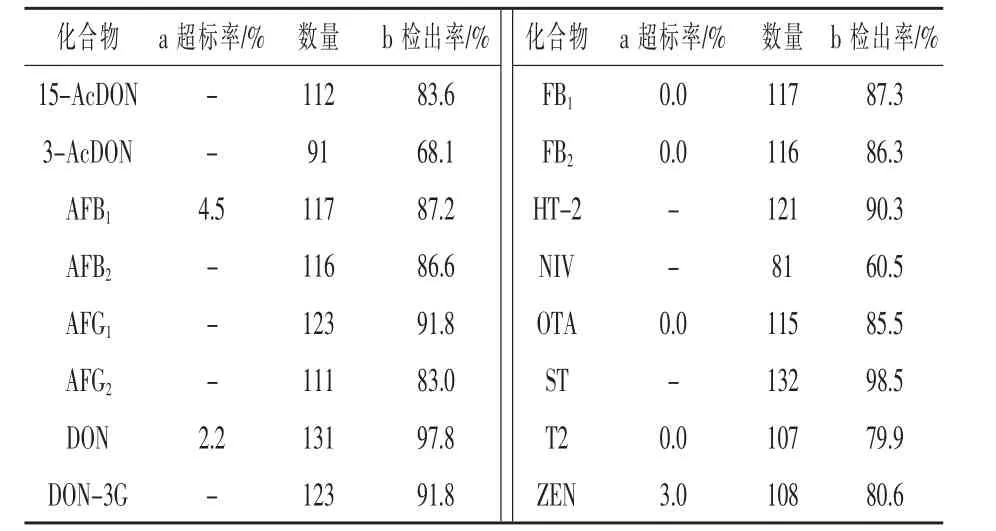
表7 134份饲料及原料样品中16种霉菌毒素的检测结果
表8 10份饲料样品中霉菌毒素的含量
注:“N/F”:未检出或低于方法检出限。
化合物 样品49 样品52 15-ACDON N/F 1320.57 3-ACDON N/F 4878.66 AFB167.36 102.4样品58 623.2 83.2 56.24样品88 N/F N/F 332样品97 N/F N/F 9.92样品99 样品100 样品101 样品102 样品132 88.8 4.728 100 59.6 54.40 35.12 N/F 25.04 25.36 N/F 1.872 0.3336 N/F 2.824 16.48 AFB247.83 75.94 54.64 257.31 4.57 1.647 0.005 0.002 2.147 12.76 AFG12.04 2.544 0.6528 4.464 N/F N/F N/F N/F 0.065 0.1224 AFG236.56 40.08 3.456 N/F 1.72 N/F 1.24 N/F 1.688 1.184 DON 47.12 73.36 1632 145.6 146.4 620 384.8 485.6 583.2 450.4 DON-3G 5.084 242.4 136 110.4 246.4 558.4 112.8 152.8 208.8 125.6 FB1N/F N/F 4216 377.6 64.4 880 210.4 237.6 121.6 1912 FB2N/F 1.168 1380 76.16 27.6 389.6 150.4 57.12 28.88 428 HT-2 6.784 6.16 24.56 5.976 N/F 2.584 12.48 4.176 2.064 3.384 NIV 960.0 N/F N/F N/F 411.2 N/F 297.6 N/F 247.2 N/F OTA 41.76 2.976 14.08 5.248 2.792 2.56 2.76 2.408 2.568 3.400 ST 0.7088 0.4992 5.24 3.20 1.376 2.936 1.760 1.056 1.176 1.632 T2 N/F N/F 1.776 0.2168 0.596 1.976 7.552 3.560 1.264 1.448 ZEN N/F N/F 1360 236.8 N/F 288 108.8 N/F N/F 133.6

