红壤土浸出液中SO42-对铜包钢耐蚀性能的影响研究
刘 欣,李志美,裴 锋,田 旭,贾蕗路,崔素梅,毛荣军,万军彪,李财芳,孟墙国,朱嘉伟
(1.国网江西省电力有限公司电力科学研究院,南昌 330096;2.南昌大学 化学学院,南昌 330031;3.江西问天科技有限责任公司,南昌 330096)
接地系统是维护变电站安全运行的重要保证[1-2].我国的接地系统目前大多使用扁钢或镀锌钢.虽然这些材料成本比较低廉,但是这些材料电阻值较高,且易于腐蚀,已成为变电系统安全运行的潜在隐患.由于铜具有良好的电气性能,如良好的导电性能,而且铜的化学性能稳定,在酸性土壤中使用更显优势.因此一些发达国家如美国和日本大多等采用纯铜作为接地材料.由于纯铜成本较高,在我国还没有得到广泛地使用.结合铜的优良化学稳定性和钢的良好导电性能,人们制备了一些新型接地材料,如以碳钢为基底表面覆盖铜[3]或铜合金[4].查柏林等[4]采用超音速电弧喷涂技术将镍铜合金喷涂在碳钢基底表面,并研究了该材料的电化学腐蚀特性.结果表明在酸性溶液中,随着H+的增大,基底腐蚀程度也增大;在碱性溶液中镍铜合金涂层能很好地保护碳钢基底.詹涛[5]等人研究了铜包钢在高盐分酸性土壤中的腐蚀状况;闫爱军[6]等研究了铜包钢在不同酸度的土壤浸出液中的腐蚀行为,结果表明在土壤溶液中,碱性越强,铜包钢越不容易腐蚀;随着浸泡时间的延长,铜包钢的阻抗随之增加,达到某个最大值之后开始降低.周佩朋[7]、韩钰[8]、俞越中[9]等对铜镀钢材料与其他材料进行比较研究,结果表明铜钢复合材料同时具有铜的高耐蚀性和钢的高强度的特点. 朱敏等[10]研究比较了铸铜包钢和电镀铜包钢的电偶腐蚀,结果表明铸铜包钢的电偶腐蚀比电镀铜包钢严重得多.但是这些研究还远远不够,如含氧量、氯离子、硫酸根离子、杂散电流等因素对铜包钢使用寿命及耐蚀性能的影响还需要进一步研究,才能全面了解铜包钢在不同理化性质的土壤中的耐蚀性及使用寿命,为新型接地材料的使用提供合理的建议.江西南昌为我国酸雨重灾地区之一,且酸雨的类型主要是硫酸型酸雨.由于酸雨的沉降,导致江西土壤明显呈酸性;由于大量的SO42-离子的累积,使土壤中的SO42-含量极高[11].因此研究江西土壤中SO42-对接地材料的使用性能的影响有着非常重要的意义.
本文主要利用了电化学极化、阻抗和扫描电镜、能谱技术研究了在红壤土浸出液中SO42-含量对铜包钢的腐蚀行为的影响,为我省电力系统铜包钢接地材料的选用提供理论依据,也为其它土质接地材料提供参考.
1 实 验
1.1 实验土壤及浸泡液制备
实验土壤样本采自江西南昌某地区,土壤外观为砖红色,其主要成分见表1.
表1江西红壤土理化性质
Table 1 Physical-chemical properties of Jiangxi red soil (mg/kg)
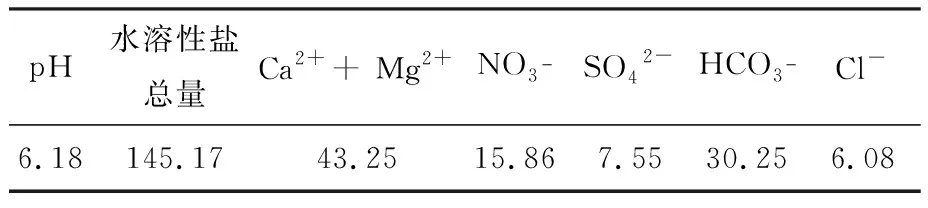
pH水溶性盐总量Ca2++ Mg2+NO3-SO42-HCO3- Cl-6.18145.1743.2515.867.5530.256.08
土样自然干燥、去除其他杂物后,破碎,经20目筛过筛,在105 ℃烘6 h后备用.参照聂新辉等[12]土壤浸出液配制方法,将红壤土与超纯水以1∶1的比例配制红壤土浸出液.腐蚀溶液配制:分别在红壤土浸出液加不同浓度的SO42-配制为0.005、0.025、0.050、0.1、0.2 mol/L的梯度溶液各80 mL腐蚀溶液,待用.
1.2 实验材料及准备
实验材料:铜包钢为Φ1.6 cm, 高为5 cm的小圆柱,其内芯为Φ1.2 cm的Q235钢,外层包着厚度为0.2 mm的纯铜(99.995%以上),Q235钢主要化学成分为C(0.13%)、Si(0.14%);Mn(0.30%),P(0.017%),S(0.020%),Fe(余量).
铜包钢材料的准备:1)SEM-EDS实验:准备5份上述规格的铜包钢材料,两端面用环氧树脂密封,外侧面(铜层面)为腐蚀工作面;2)电化学实验:另准备5份与上述相同的铜包钢,靠近一端部用铜导线焊接,铜包钢侧面预留1 cm2为实验工作面,其余部分用环氧树脂密封.工作面依次经300~1 000#砂纸打磨抛光,用无水乙醇除油,去离子水清洗(去离子水-无水乙醇-去离子水清洗),吹干后备用.
铜包钢除锈剂的准备:浓HCl(p=1.19 g/mL)和蒸馏水按照1∶1配制除锈剂,使用前用纯氩对溶液除氧.
1.3 实验仪器药品及测试方法
铜包钢在电化学实验前分别浸泡在不同浓度的SO42-含量的红壤土浸出液中,浸泡时间为20 d(各种溶液中分别浸泡6支铜包钢).浸泡期间定期(每隔两天)更换新配制的土壤浸出液(更换新配制的腐蚀溶液).实验均处于室温条件下进行.
1.3.1 电镜扫描技术(SEM-EDS)
将已浸泡20 d的待测试样取出后,用超纯水轻洗去表面的腐蚀溶液,其中3支直接利用氩气吹干后,置于氩气存储箱中保存;另3支采用除锈剂对表面腐蚀产物进行清洗(除锈剂溶液中浸泡3 min),然后用超纯水进行彻底清洗,无水乙醇浸泡后经氩气吹干,置于氩气存储箱中保存.采用美国FEI公司的QUANTA 200 (SEM-EDS),进行上述处理后金属试样表面的微观腐蚀形貌扫描,以及分析表面腐蚀产物的元素组成.
1.3.2 电化学测试技术
电化学检测实验采用三电极体系,工作电极分别为铜包钢(有效工作面积为1 cm2),辅助电极为铂电极,参比电极为银-氯化银电极(Ag-AgCl).利用CS310电化学工作站进行EIS和极化曲线测试.红壤土浸出液为电化学实验电解质溶液.
首先对浸泡20天的铜包钢进行电化学阻抗谱测试,交流阻抗测试频率范围为100 kHz~10 mHz,交流激励信号幅值为10 mV.利用ZView软件对交流阻抗数据进行拟合.然后对腐蚀后铜包钢进行动电位极化实验.设置恒电位下(相对于参比电极-1.3 V)预极化,实验时间为200 s.极化曲线扫描速率为0.5 mV/s,扫描范围为-500~500 mV(-1.1~-0.4 V)(相对于开路电位), 实验开始前让体系稳定20分钟后,再开始记录数据,利用仪器自带软件对极化数据进行拟合.
2 结果与讨论
2.1 扫描电镜/能谱分析(SEM-EDS)
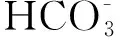
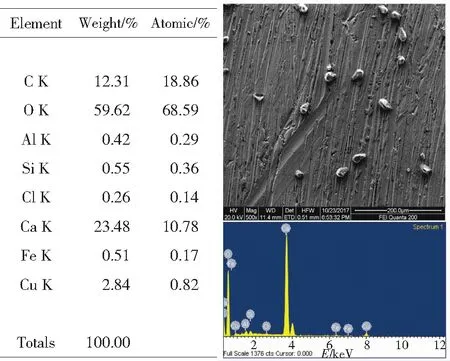
图1铜包钢在0.005mol/L土壤浸出液中浸泡20d的SEM和EDS及其数据图
Fig.1 SEM and EDS with its value of copper-clad steelimmersed in the red soil solution of with SO42-concentration of 0.005 mol/L for 20 days
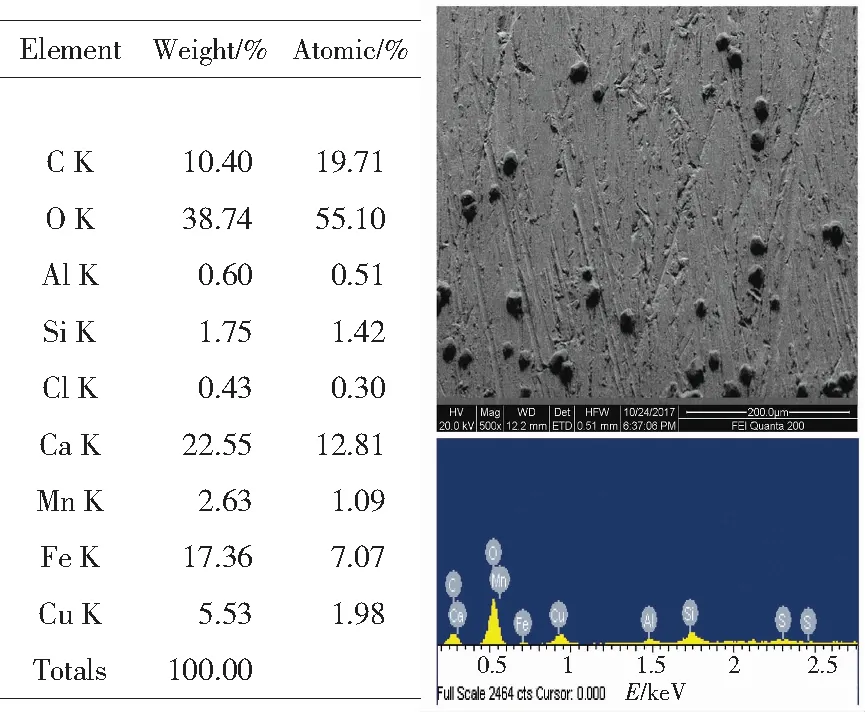
图2铜包钢在0.05mol/LSO42-土壤浸出液中浸泡20d的SEM和EDS及其数据图
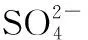
图3为去除腐蚀产物后的SEM图.由图可知,在0.005 mol/L和0.05 mol/L SO42-红壤土浸出液中浸泡20 d,铜包钢都已经发生点蚀,后者腐蚀程度大于前者.

图3腐蚀产物清除后试样表面SEM.(a)0.005mol/LSO42-;(b)0.05mol/LSO42-红壤土浸出液中浸泡20d
Fig.3 SEM of copper-clad steel immersed in the red soil solution with SO42-concentration of (a) 0.005 mol/L; (b) 0.05mol/L SO42-for 20 days after removing corrosion products on the surface.
2.2 极化曲线分析
利用电化学动电位极化方法对浸泡腐蚀后的铜包钢进行耐腐蚀性分析(所有电化学电解质溶液都是1∶1红壤土浸出液,不额外增加SO42-的量).由图4可以看出,阳极极化曲线都呈现随电位升高电流密度急剧增大-增大变缓-急剧增大现象.增大变缓的过程可能是在在金属表面生产了一层电阻高、耐腐蚀的钝化膜.当电位高于0.25 V后,随着电位升高电流密度急剧增大,可能是钝化膜在0.25 V处被击穿后金属表面重新露出活化区.
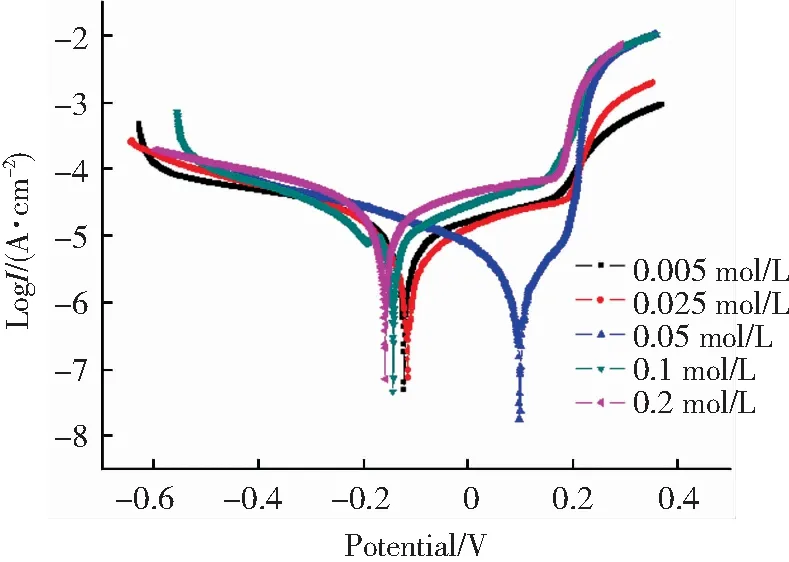
图4在不同SO42-含量的红壤土浸出液中浸泡20d的铜包钢的极化曲线
Fig.4 Dynamic potential polarization curves of copper-clad steel in red soil solution with different concentrations of SO42-for 20 days
对弱极化区极化曲线进行数据拟合,分别得自腐蚀电位Ecorr(图5(a))、自腐蚀电流Jcorr(图5(b)),腐蚀速率Vcorr(图5(c))、阳/阴极极化曲线斜率βaβc(图5(d))随SO42-浓度变化曲线.热力学研究表明,电位越正,材料的耐腐蚀性能越强;自腐蚀电流密度越小,说明材料越不易被腐蚀.从图5(a)看出,在所测试浓度范围内,随电化学实验前浸泡液SO42-浓度增大,铜包钢的腐蚀电位随浓度增加电位值先增后减的趋势,在SO42-浓度为0.05 mol/L时,腐蚀电位最高;从图5(b)看出,在低浓度范围内,浸泡腐蚀后的铜包钢腐蚀电流密度逐渐减小,说明其耐蚀性能随SO42-浓度增大逐渐增强;当SO42-浓度达到0.05 mol/L后,浸泡后的铜包钢腐蚀电流密度逐渐增大,说明其耐蚀性逐渐减弱.在浓度为0.05 mol/L SO42-的浸出液中浸泡后的铜包钢的腐蚀电流密度最低,说明其耐蚀性最强.这是由于0.05 mol/L SO42-的浸出液中浸泡后的铜包钢表面覆盖的不导电的腐蚀产物多于其他浓度的浸泡液中.浸泡腐蚀后的铜包钢腐蚀速率图5(c)和图5(d)阳极的Tafel斜率实验结果也得到相同的结论.铜包钢阴极极化曲线Tafel斜率的绝对值均比阳极大,说明其腐蚀反应受阴极去极化过程控制.

图5极化曲线弱极化区拟合结果:(a)自腐蚀电位(Ecorr)、(b)腐蚀电流密度(Jcorr)、(c)腐蚀速率(Vcorr)、(d)阳阴极极化曲线斜率(βa
Fig.5 The results of polarization curve fitting in weak polarization region of copper-clad steel in red soil solution for 20 d:(a) the corrosion potential Ecorr; (b)the corrosion current Jcorr;(c)corrosion rate Vcorr;(d) slope of polarization curve of anode and cathode(βa
对极化曲线进行线性拟合,分别得阴极Rp、阳极Rp随SO42-浓度变化曲线(图6).从图6可以看出,阴、阳极电阻值都是随SO42-浓度增加呈现先增加后降低的趋势,浓度为0.05 mol/L时达到最大.这一实验结果进一步说明铜包钢浸泡后,在其表面覆盖了不导电物质所致,浓度为0.05 mol/L覆盖量最多,因此其阴极阻值最大.
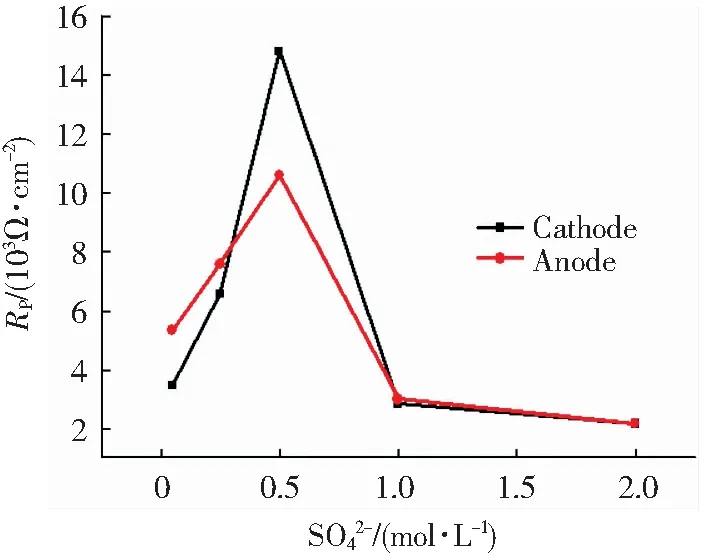
图6极化曲线线性拟合结果:阴极、阳极Rp随SO42-浓度变化曲线
Fig.6 The results of polarization curve fitting of copper-clad steel immersed in red soil solution for 20 days:the change curve of the Rp values of anode and cathode (βa
2.3 阻抗谱分析
利用电化学阻抗测试技术对不同SO42-含量的红壤土浸出液中浸泡20 d的铜包钢接地材料的耐蚀性进行分析.图7为铜包钢在不同SO42-含量的红壤浸出液中浸泡20 d的Nyquist图及其Bode图.从Nyquist图可以看出,在SO42-浓度为0.005 mol/L的阻抗值最小,0.05 mol/L的阻抗值最大, 其他3个浓度条件下比较接近;5种浓度中腐蚀的铜包钢阻抗谱中都出现较瘪的容抗弧,说明存在弥散效应,这是由于铜包钢表面被一些不导电的物质所覆盖,铜和铁离子只能在局部区域穿透包盖层形成阳极电流,导致金属电极表面电流分布不均匀所致.Bode图中峰形较宽或者出现两个峰,可能都存在2个时间常数.
利用频率f=0.05 Hz时的阻抗膜值|Z|0.05的大小来比较腐蚀后的铜包钢的耐蚀性能,|Z|0.05值越大,材料的耐蚀性能越好[13].图7右边Bode图中内插图为腐蚀后的铜包钢阻抗膜值|Z|0.05随浸泡腐蚀液中SO42-含量变化的曲线.从内插图中可以看出,|Z|0.05值在SO42-浓度为0.05 mol/L时最大,这一规律与极化实验结果一致.
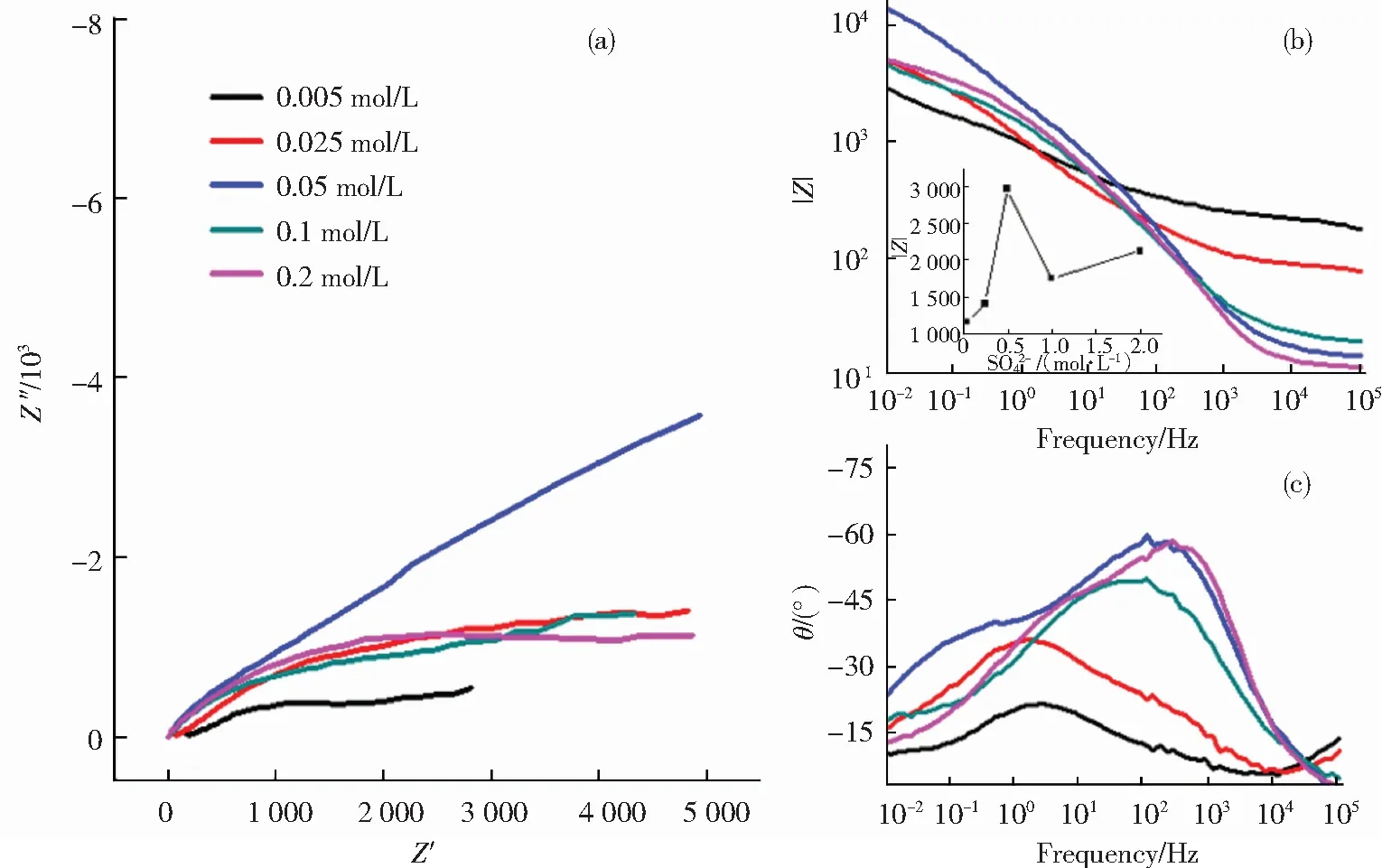
图7铜包钢在不同浓度红壤土浸出液中浸泡20d后的阻抗图:(a)Nyquist图、(b)模值-频率、(c)角度-频率图((b)中内插图为阻抗膜值|Z|0.05随SO42-含量变化的曲线)
Fig.7 Impedance diagram of copper-clad steel immersed in red soil solution with different concentrations of SO42-for 20 days:(a) Nyquist; (b) The value of |Z|-Frequency; (c) theta-Frequency. Inset is the change curve of value of |Z|0.05with different concentrations of SO42-.
依据阻抗谱模拟的相关性和材料腐蚀特征分析结果,分别对SO42-含量为0.005 mol/L和0.05 mol/L的红壤土浸出液浸泡腐蚀后的铜包钢体系构建等效电路模型及利用此模型对Nyquist图进行数值模拟,其结果如图8(a)和8(b)所示.由于存在弥散效应,用长相位角元件代替电容.相位角的Bode图中峰形较宽或者出现两个峰,这也符合金属表面被覆盖的特征.等效电路模型中R1为溶液电阻,R2为铜包钢界面与溶液之间的电荷转移电阻,R3为蚀点内溶液电荷转移电阻、CPE为常相位角元件,CPE1代表点蚀后内层界面的电容,CPE2代表铜包钢界面本身的电容.
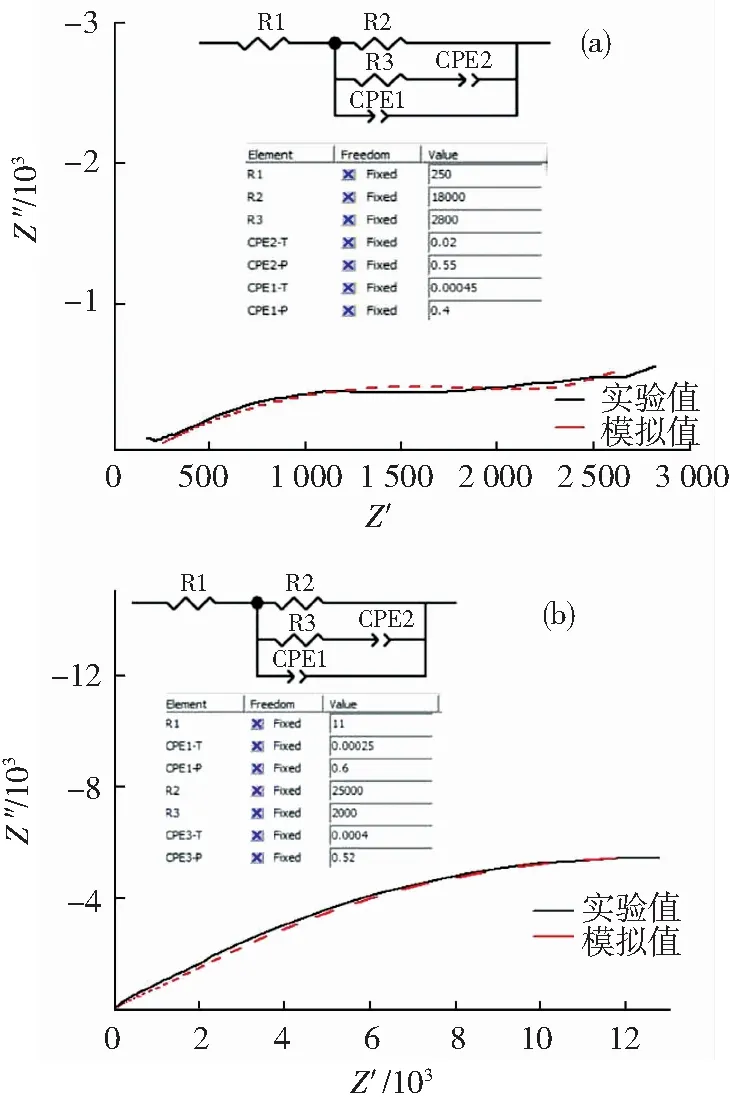
图8铜包钢阻抗Nyquist的实验和模拟结果对比图:(a)0.005mol/L(b)0.05mol/LSO42-红壤土腐蚀液(内插图为等效电路及其相关参数)
Fig.8 Impedance diagrams of copper-clad steel, immersed in red soil solution with SO42-concentrations of (a) 0.005 mol/L, (b) 0.05 mol/L (black solid lines), and their simulated ones (red dot line), respectively. (Insets are the equivalent circuits and their fitting parameters.)
从模拟的结果看,0.05 mol/L SO42-含量浸出液腐蚀后铜包钢界面与溶液之间的电荷转移电阻R2值是在0.005 mol/L的1.39倍,说明前者铜包钢表面覆盖物的量比后多.而将两者蚀点内溶液电荷转移电阻R3相比较的结果表明前者比后者小,这说明前者腐蚀后裸露出的金属面更大.这些现象都说明0.005 mol/L SO42-浸出液对铜包钢的腐蚀更严重,但是腐蚀后产物覆盖在材料表面后增大了其电阻值,在后续腐蚀试验中表现为不易被腐蚀.
3 结 论
本文研究了铜包钢接地材料在不同SO42-浓度红壤土浸出液中浸泡20 d的腐蚀行为,结果表明SO42-含量影响其腐蚀行为.5种腐蚀溶液中铜包钢都存在点蚀现象,已腐蚀至内层钢.在浓度为0.005~0.2 mol/L范围内,随着SO42-含量增加,铜包钢腐蚀程度呈现先增后减弱的趋势,在浓度为0.05 mol/L SO42-的浸出液中最为严重.由于腐蚀产物覆盖在金属材料表面,阻碍其进一步腐蚀,因此在后续电化学实验中,5种溶液腐蚀后金属耐蚀性相比较,0.05 mol/L SO42-溶液中浸泡后材料反而表现出耐蚀性最强.

