青花菜病程相关蛋白基因BoPR2的克隆与表达
金魏佳,何 佳,章燕如,范灵希,唐露静,叶佳燕,郑 颖,蒋 明
(台州学院生命科学学院,浙江 台州 318000)
青 花 菜(Brassica oleracea var. italica) 又名西兰花、绿菜花和绿花椰菜等,为十字花科(Cruciferae)芸薹属1年生或2年生草本蔬菜,是甘蓝的一个变种[1]。青花菜以花球为主要食用部位,营养价值高,富含矿质元素、碳水化合物、蛋白质、维生素及抗癌活性成分萝卜硫素(Sulforaphane),是一种深受人们喜爱的保健蔬菜[2-5]。在我国,随着青花菜种植面积的不断扩大,病害的发生日趋严重,根肿病和菌核病已成为青花菜大田生产过程中的两种常见病害,每年造成的产量损失十分巨大[5-6]。根肿病由芸薹根肿菌(Plasmodiophora brassicae)引起,而菌核病由核盘菌(Sclerotinia sclerotiorum)造成,两种病害在其他芸薹属蔬菜中的发生也十分普遍,是世界性病害[7-8]。我国不是青花菜的原产地,种质资源十分匮乏,而抗病材料更为稀缺,通过挖掘抗病相关基因开展分子育种是解决种质短缺的重要途径之一,也是解析植物-病原菌互作机理的基础和开展抗病分子育种的重要前提[9-10]。
病程相关蛋白(pathogenesis-related protein,PR)是植物体内的一类重要蛋白,在病原菌或物理、化学因子的诱导下表达或积累,在植物抵御病害及适应不良环境方面发挥着重要作用[11-12]。根据氨基酸序列的相似性、酶活性或其他生物学特性,PR可分为17个家族,不同类型的PR具有不同的结构特点和功能[13]。其中PR2具有β-1,3-葡聚糖酶活性,其主要作用是水解β-1,3-葡聚糖,这种糖类物质是病原菌细胞壁的主要成分,因此,PR2的生成与积累能抑制病原菌的生长和增殖[14-15]。近年来,已从烟草(Nicotiana tabacum)、番茄(Lycopersicon esculentum) 和 水 稻(Oryza sativa)等植物中克隆到PR2基因,并明确了它们的序列特征和抗病功能[16-18],但是,有关PR2在青花菜中的研究未见报道。本研究以青花菜为材料,在克隆BoPR2基因的基础上,利用生物信息学手段分析序列特征,用实时定量PCR明确其在芸薹根肿菌和核盘菌侵染下的表达模式,为开展基因功能鉴定和抗病机理研究奠定基础。
1 材料与方法
1.1 试验材料
供试青花菜材料为Bo0112,栽植于人工气候箱,在16 h光照/8 h黑暗的光周期下培养,两叶一心期时用于病原菌的接种。核盘菌采自浙江临海上盘青花菜基地,经纯化后保存于台州学院生命科学学院实验室。核盘菌接种采用菌丝块法,对照用同样大小的马铃薯葡萄糖琼脂(Potato Dextrose Agar, PDA)培养基块,采集接种0、6、12、24、36、72 h的叶片,用于RNA的提取。芸薹根肿菌采自温岭石桥头青花菜基地,采用张小丽等[19]的方法接种,对照用等量的无菌水,采集接种0、5、10、15、20、25 d的根用于RNA的提取。
1.2 试验方法
1.2.1 DNA和RNA的提取 基因组DNA的提取采用SDS法[20],RNA的提取采用Trizol法[21],经电泳鉴定后置于超低温冰箱保存备用。cDNA的合成采用TaKaRa公司的试剂盒,按其提供的说明书进行操作。
1.2.2 青花菜BoPR2基因的克隆 用于基因克隆的上、下游引物分别为BoPR2UP:5'-ATGGTACGATTCAAACATAT-3'和BoPR2DN:5'-TTAGTTGAACTTGACACCATATTT-3',由北京鼎国生物技术有限公司合成,用无菌ddH2O配制成20 μmol/L备用。分别以DNA和cDNA为模板进行PCR扩增,20 μL体系中加入以下试剂:10×PCR缓冲液2 μL,20 ng模板DNA或cDNA,0.5 μL 10 m mol/L的dNTPs,0.8 U的Taq DNA聚合酶,上、下游引物各0.1 μL,加ddH2O至终体积。PCR扩增程序:94℃预变性5 min;94℃变性30 s、51℃退火45 s、72℃延伸45 s,共32个循环。PCR扩增结束后,产物用1 %的琼脂糖凝胶进行电泳检测。
1.2.3 PCR产物的回收、转化和测序 用无菌刀片割取含目的条带的胶块,采用试剂盒法(上海碧云天生物技术研究所)回收DNA。取1.5 μL回收产物与p-GEM-Teasy载体(Promega),置于4℃连接,用热激法导入Trans5α感受态细胞(北京全式金生物技术有限公司)。经涂布平板,挑取白色单菌落于37℃振荡培养12 h。用菌液PCR鉴定阳性克隆,PCR程序同基因克隆,模板改为0.5 μL菌液,经电泳检测后取3个阳性克隆测序。
1.2.4 序列分析 利用DNAMAN5.2.2、在线工具SMART(http://smart.embl.de)和Compute PI/Mw(http://web.expasy.org/compute)对 BoPR2基因序列及其编码蛋白进行理化性质分析[22]。从NCBI数据库中下载甘蓝型油菜(B. Napus,登录号:XP_013742178.1)、野甘蓝(B. oleracea var. oleracea, 登 录 号:XP_013636025.1)、白 菜(B. rapa subsp.chinensis, 登 录 号:BAG68207.1)、萝卜(Raphanus.sativus,登录号:XP_018458775.1)、拟南芥(A. thaliana,登录号:ANM63774.1)、玉山筷子芥(A. lyrata subsp.Lyrata,登录号:EFH54399.1)、亚麻荠(Camelina sativa,登录号:XP_010516340.1)和荠菜(Capsella rubella,登录号:EOA24328.1)等8种十字花科植物的PR2序列。用Clustalx 1.81进行序列比对,再利用Mega 3.1构建进化树,构建方法为邻接法(Neighbor-Joining),经1 000次自举检验[23]。
1.2.5 基因表达分析 根据测序结果,设计实时定量PCR引物,上、下游引物序列分别 为5'-AAGCAGTACAGCATCCCTCG -3'和5'-TGGGAACGTCGAGGATGAAC -3'。表达采用肌动蛋白基因作为内标,上、下游引物分别 为: 5'-ACGTGGACATCAGGAAGGAC-3'和5'-GAACCACCGATCCAGACACT-3'。PCR 反 应在Roche Light Cycler 96 PCR仪上进行,反应程序:50℃ 5 min,94℃ 30 s;94℃ 5 s、55℃ 15 s、72℃ 10 s,共40个循环。实验重复3次,用公式2-ΔΔCt计算相对表达量。
2 结果与分析
2.1 BoPR2基因的特征
以BoPR2UP和BoPR2DN为引物,分别以青花菜叶片基因组DNA和cDNA进行PCR扩增,经测序后得到各自的序列。结果表明,BoPR2基因组全长为1 188 bp,包含1个内含子(96 bp),第1与第2外显子的长度分别为130 bp和962 bp(图1)。

图1 BoPR2基因结构
2.2 BoPR2编码蛋白的特征
BoPR2编码351个氨基酸,经Compute pI/Mw tool在线工具预测,BoPR2的理论等电点为6.85,分子式为C1740H2663N467O520S15,分子量为38 925 u,不稳定指数为40.48,为不稳定蛋白;其总平均亲水性系数为-0.304,BoPR2为亲水性蛋白。序列中的天冬酰胺含量最高、达到8.8%,丝氨酸次之、为8.5%,而半胱氨酸最少、仅0.3%。通过NCBI的Blast程序分析发现该蛋白含有1个保守的Glyco hydro 17结构域,位于+34 ~ +350处(图2)。

图2 BoPR2基因的编码区及推导的氨基酸序列
2.3 BoPR2与同源序列的比对
为研究BoPR2的进化地位,从NCBI数据库下载8种十字花科及其近缘植物的PR序列,用Clustalx 1.81进行序列的多重比对。由图3(彩插一)可知,9个PR2蛋白由338~365个氨基酸残基组成,其中,野甘蓝的序列最长、氨基酸残基数365个,甘蓝型油菜次之、为363个,玉山筷子芥的最短、338个。序列比对结果表明,9种植物PR2的相似性较高,仅个别氨基酸存在差异,说明十字花科植物的PR2在进化上十分保守。与BoPR2相比,野甘蓝在+9、+10位有2个氨基酸残基的插入,甘蓝型油菜则在+41、+86、+170、+173、+238、+260、+324、+327位存在差异;荠菜与其他同源序列之间的差异较大,在 +1~+15、+152~+153、+173、+247、+317、+341~+343、+360位发生氨基酸残基的缺失,在+131、+230、+231位发生氨基酸残基的插入。
2.4 BoPR2的系统发育分析
利用Mega 3.1构建进化树,构建方法为邻接法。结果(图4)表明,8个不同物种的PR2在进化树上可分为5组。其中,青花菜与同为芸薹属的野甘蓝、甘蓝型油菜和白菜的遗传距离最小,它们之间的亲缘关系最近,在系统发育树上聚于I组;同为拟南芥属的拟南芥和玉山筷子芥PR2之间的遗传距离最近,它们在进化树上处于同一组(Ⅴ);萝卜、荠菜、亚麻荠均单独成组,分别为II、III、IV组。
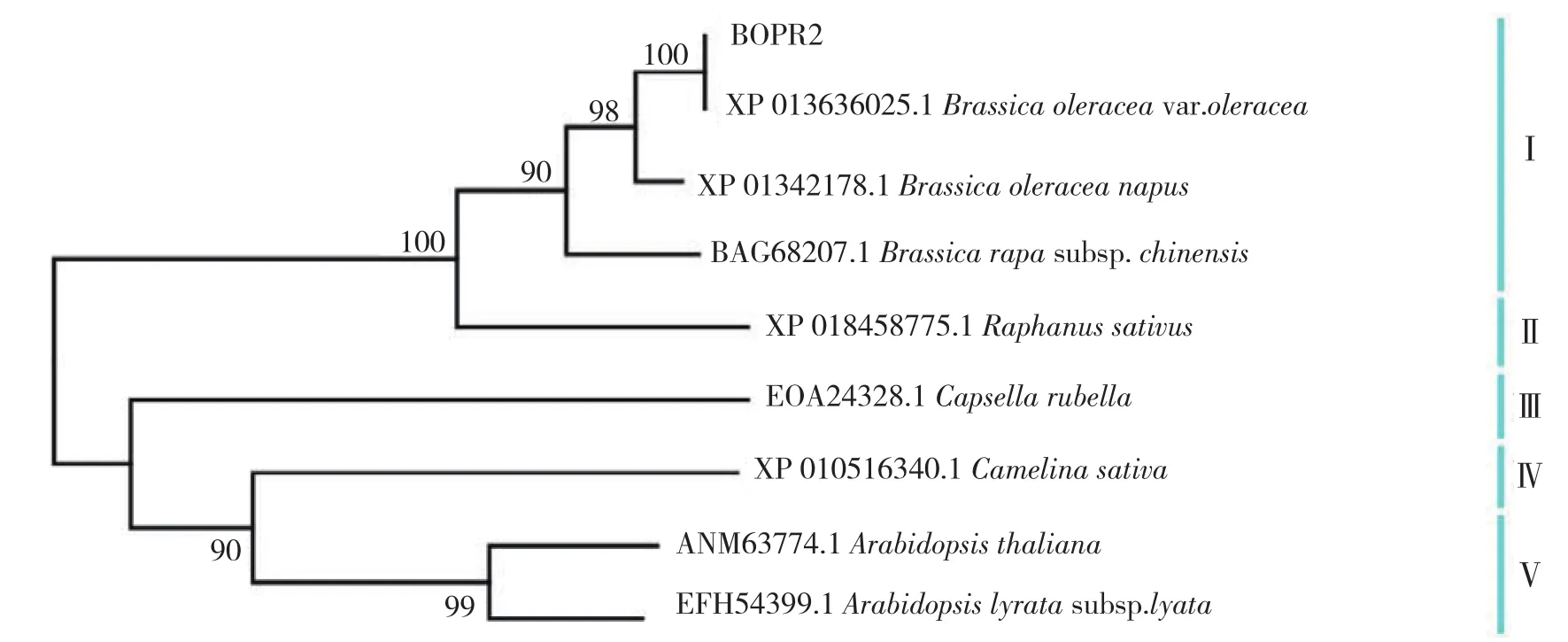
图4 BoPR2及其同源序列的进化树
2.5 BoPR2的表达分析
为研究病原菌胁迫对青花菜BoPR2表达的影响,采用实时定量PCR检测表达水平。结果(图5)表明,核盘菌不能诱导BoPR2的表达,在侵染0~72 h期间,表达量未见显著变化(图5A);在芸薹根肿菌的诱导下,BoPR2的表达量逐渐增加,在10 d时的相对表达量最大,约为对照的6倍,随后逐渐降低,在15 d和20 d时的相对表达量分别为对照的3.60、3.22倍(图5B)。

图5 青花菜BoPR2基因的表达
3 结论与讨论
植物PR2是一类重要的病程相关蛋白,在生长发育及抵御病原菌、昆虫和非生物胁迫等方面起着重要作用[24-25]。PR蛋白可分为17类,其中PR1的功能未知,PR2编码β-1,3-葡聚糖酶,PR3、PR4、PR8和PR11则编码几丁质酶[26]。已从多种植物中克隆到PR2基因,大豆(Glycine max)GmBG1基因编码347个氨基酸,等电点为8.71[14];海岛棉(Gossypium barbadense)GbGLU基因的全长为1 086 bp,编码361个氨基酸,分子量为 39.66 ku[27];小麦(Triticum aestivum)TcLr19PR2基因的编码区全长为1 005 bp,编码334个氨基酸[28]。本研究从青花菜中克隆到1个PR2基因,定名为BoPR2。该基因的编码区全长为1 092 bp,编码351个氨基酸,BoPR2与野甘蓝PR2的相似度最高,仅存在2个氨基酸残基的差异,而与同属的甘蓝型油菜、青菜的序列差异稍大,在进化树上处于相邻的分枝,这与芸薹属植物的分类结果一致。BoPR2编码区的大小与芥菜(B. juncea)PR2相仿,芥菜BjPR2的编码区全长为1 020 bp,编码339个氨基酸[29]。
在正常环境条件下,植物体内的PR2含量较少,活性很低,但经病原菌侵染后,PR2的积累量显著增加,表明PR2与植物抵御病害有关[30]。大豆GmBG1基因的表达受腐霉菌(Pythium ultimum)诱导,在抗病材料中表达量呈先上升后下降的趋势,在24 h时达到最大值[14];海岛棉GbGLU基因受黄萎病菌(Verticillium dahliae)的诱导,在接种48 h时表达量开始升高,96 h时达到最大值[27];半定量RT-PCR结果表明,该基因受小麦叶锈菌(Puccinia triticina)的诱导,表达量在48 h达到最大值[28]。芸薹根肿菌是活体寄生菌,可激活植物的水杨酸信号途径,而核盘菌为腐生营养菌,它激活寄主的茉莉酸/乙烯信号途径,而PR2是水杨酸信号途径的一个标志基因[31]。本研究中,在芸薹根肿菌的诱导下,青花菜BoPR2的表达量逐渐增加,在10 d时的相对表达量达到对照的6倍,但是,BoPR2基因的表达并不受核盘菌的诱导。在黑斑病菌(Alternaria brassicae)侵染下,芥菜BjPR2的表达量也呈先上升后下降的趋势,在24 h时表达量达到最大值[29]。
本研究以青花菜为材料,克隆得到1个PR2基因,并明确了其序列特征和表达特点,该基因的表达受芸薹根肿菌的诱导。下一步,将利用遗传转化方式研究该BoPR2在抗病反应中的功能。

