水稻种子特异性谷蛋白GluB1启动子在水稻愈伤组织中驱动外源基因表达
赵艳 唐湧洲 史玉倩
水稻种子特异性谷蛋白GluB1启动子在水稻愈伤组织中驱动外源基因表达
赵艳*唐湧洲 史玉倩
(浙江工商大学 食品与生物工程学院, 杭州 310018;*通讯联系人, E-mail: yanzhao9918@163.com)
【目的】水稻谷蛋白启动子GluB1(GluB1 promoter,pGluB1)常用于外源基因在种子中特异性高效表达的研究,也是研究种子储藏蛋白基因表达调控机制的模型。前人研究表明,pGluB1只在水稻胚乳中表达,而在根、茎、叶片、叶鞘、颖壳等组织中均无表达活性。研究的目的是为了克服种子特异表达启动子筛选周期长的缺点。【方法】将由pGluB1驱动的霍乱毒素B亚单位和重组胰岛素原组成的融合基因(a fusion gene of the cholera toxin B subunit and human proinsulin,)表达载体pCAMBIA1302-pGluB1sig-CTBIN-NOS经农杆菌介导法转化水稻成熟胚愈伤组织。通过RT-PCR和蛋白质印迹杂交试验检测融合基因在水稻愈伤组织中的转录和翻译表达。【结果】获得的7个转基因愈伤克隆中,有6个克隆的融合基因在转录水平上表达。选取其中4个克隆进一步进行蛋白质印迹杂交试验检测证实融合基因均在翻译水平上表达,而且从分子量大小推断融合蛋白包含的谷蛋白GluB1的N-端信号肽序列(24个氨基酸残基)在所测的愈伤组织细胞中均被成功切除。【结论】水稻种子特异性启动子pGluB1在愈伤组织中具有驱动外源基因表达活性,种子蛋白体亚细胞定位信号肽序列可在愈伤组织细胞中被切除。这为在愈伤组织细胞中快速检测种子特异表达启动子活性和探索愈伤组织中蛋白质的亚细胞分拣机制奠定了基础。
谷蛋白B1启动子;信号肽;水稻;成熟胚愈伤组织;表达活性
启动子是RNA聚合酶识别并与之结合从而起始基因转录的一段DNA序列,通常位于基因上游。在错综复杂的基因表达调控网络中,启动子控制的基因转录起始是关键枢纽[1]。根据表达方式,启动子分为组成型、时空特异型、诱导型三类,其中,时空特异型表达启动子包括发育阶段特异表达和器官组织特异表达两种[2]。种子生物反应器是应用种子特异表达启动子驱动重组蛋白基因在谷物种子中大量表达生产目标蛋白的新兴生物技术。水稻作为主粮作物,由于种子产量大,基因转化技术成熟,容易规模化种植且自花授粉特性,具有天然的生态安全优势,很快发展为表达药用重组蛋白和口服疫苗的优选种子生物反应器[3]。种子特异表达启动子的筛选和克隆是构建种子生物反应器的重要环节。谷蛋白是水稻种子的主要储藏蛋白,含量可达种子蛋白总量的80%,水稻谷蛋白分为GluA、GluB、GluC和GluD四个亚类,约由15个基因编码[4]。研究表明,谷蛋白GluB1启动子(GluB1 promoter,pGluB1) (1.3 kb和2.3 kb)是水稻胚乳特异性高效表达启动子,在转基因水稻根、茎、叶片、叶鞘、颖壳等组织均不表达[5-7],也是水稻种子生物反应器生产重组药用蛋白研究中的热点启动子[8-9]。如pGluB1驱动大豆球蛋白基因()在水稻中的高表达,其表达量可达种子蛋白总量的4%~5%[10],而且与非转基因对照相比,转基因水稻种子除蛋白含量增加20%,水分含量有所降低外,其他营养成分及生理功效指标均无明显变化,食用安全性好[11]。2.3 kb的pGluB1驱动人工合成杂交肽7 Crp基因转化水稻后,每粒大米能获得约60 µg重组7Crp蛋白[12]。然而,试验周期长是谷物种子特异表达启动子筛选的主要缺点,启动子能否在种子中正常表达要等转基因植株成熟结实后才能检测,寻找快速鉴定种子特异启动子的表达方法对种子生物反应器的构建具有突破性意义。
水稻GluB1的启动子也是研究种子储藏蛋白表达调控机制的重要模型[4,8]。前人研究一致认为pGluB1属于胚乳特异性高效表达启动子[5-7,10,12],未见其在其他组织表达的有关报道。但某些种子特异性启动子也能在花粉中表达,如Chesnokov等[13]报道烟草种子特异性未知蛋白(unknown seed protein,USP)基因和豆球蛋白B4(legumin B4,LegB4)基因的启动子,在中波红斑效应紫外线辐射诱导条件下,可驱动绿色荧光蛋白()报告基因在烟草花粉粒中表达。Russell等[14]发现种子特异表达的玉米淀粉粒结合淀粉合成酶基因和水稻ADPG焦磷酸化酶基因的启动子能同时在玉米胚乳和花粉中特异表达。但迄今尚未见植物种子特异表达启动子在愈伤组织中表达的有关报道。愈伤组织是植物细胞的一种特殊的脱分化状态,其代谢较普通细胞旺盛,蛋白质和核酸合成更为迅速,并具有形成体细胞胚和完整植株的潜能。我们课题组将水稻pGluB1启动子及其信号肽序列(GluB1 promoter and its signal peptide,pGluB1sig)驱动人工合成的霍乱毒素B亚基与人胰岛素原的融合基因(cholera toxin B subunit fused with human proinsulin,)构建农杆菌表达载体并成功转化水稻[15]。本研究通过RT-PCR、蛋白质印迹杂交试验证明融合基因在水稻愈伤组织中也能成功表达,报道水稻种子特异启动子pGluB1在水稻成熟胚愈伤组织中的表达活性,为应用愈伤组织快速筛选鉴定种子特异表达启动子提供了新线索。
1 材料与方法
1.1 材料
粳稻品种日本晴水稻种子由中国水稻研究所馈赠。含有载体pCAMBIA1302-pGluB1sig-CTBIN- NOS的农杆菌LBA4404由本实验室构建保存。T-DNA区结构框架示于图1,其中包括绿色荧光蛋白(modified green fluoresent protein, mGFP)报告基因表达框和潮霉素磷酸转移酶(Hygromycin B phosphotransferase, hpt)抗性筛选标记基因表达框。
1.2 方法
1.2.1 农杆菌介导法转化水稻愈伤组织
水稻成熟胚愈伤组织的诱导、继代培养和农杆菌介导转化参照文献[16]。本研究选用NB为基本培养基,愈伤组织的诱导及继代、筛选在28℃黑暗条件下进行。挑选继代培养3~5 d的水稻胚性愈伤组织与含有载体pCAMBIA1302-pGluB1sig- CTBIN-NOS的农杆菌共培养3 d后,用无菌水冲洗6次,含有250 mg/L羧苄青霉素的无菌水浸泡杀菌1 h,无菌滤纸上吹干,转移至筛选培养基(NB+2 mg/L 2,4-D+50 mg/L潮霉素+250 mg/L羧苄青霉素,pH 5.8)筛选两轮,每轮14~20 d,挑选出抗性愈伤组织进行继代扩培和基因表达检测。
1.2.2 抗性愈伤组织的PCR鉴定和报告基因表达观察
使用卢江扬等的方法[17]提取水稻愈伤组织基因组DNA,根据基因序列设计引物对(正向引物P1: 5′-TCTTCTCCTACACCGAGTCCCT-3′;反向引物P2:5′-TCCTATTACAGCTCGTCCTTGC-3′;扩增产物为567 bp片段,由上海生工生物工程有限公司合成)对转基因愈伤组织克隆进行PCR鉴定。PCR扩增程序如下:95℃下预变性5 min;95℃下变性30 s,58℃下退火30 s,72℃下延伸45 s,30个循环;72℃下终延伸10 min,4℃下保存。
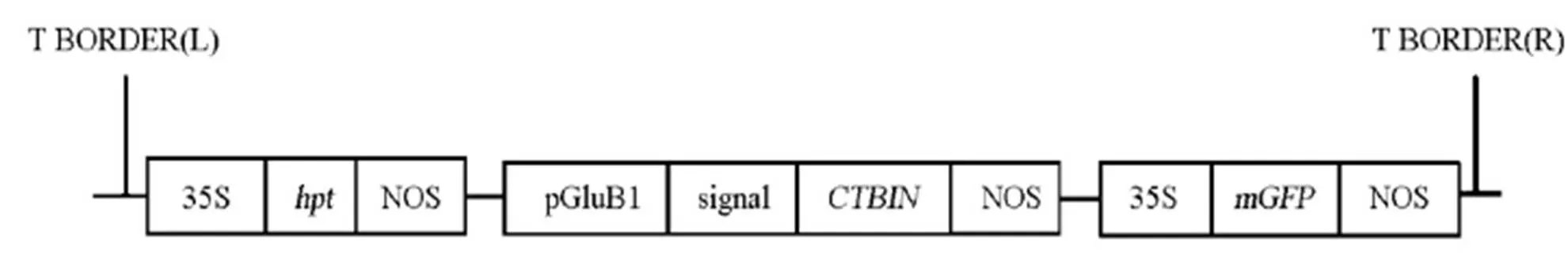
T BORDER(L)―左边界; T BORDER(R)―右边界; 35S―烟草花椰菜病毒35S启动子; hpt―潮霉素B磷酸转移酶基因; NOS―胭脂碱合成酶终止子; pGluB1―水稻 2.3 kb谷蛋白GluB1启动子; signal―水稻谷蛋白GluB1信号肽序列; CTBIN―人工设计合成的胰岛素原与霍乱毒素B亚单位融合基因,C端附加KDEL ER滞留信号基因序列; mGFP―修饰的绿色荧光蛋白基因。
Fig. 1. Sketch map of T-DNA of pCAMBIA1302-pGluB1sig-CTBIN-NOS vector.
使用DMI3000型荧光显微镜在蓝色滤光片下观察绿色荧光蛋白基因在水稻愈伤组织中的表达情况。
1.2.3 RT-PCR检测转基因水稻愈伤组织中基因表达
取约100 mg转基因水稻愈伤组织,用Trizol法提取总RNA。根据序列采用Primer 5.0设计RT-PCR特异性引物(正向引物P3: 5′-CAACAA GACCCCGCACGC-3′;反向引物P4: 5′-GGAGCA GATGGAGGTGCAGC-3′)。以水稻作为内标设计特异引物(正向引物P5: 5′-CCGTGAGAA GATGACCCAG-3′;反向引物P6: 5′-GGCGAAACC CTCGTAGATGG-3′)。反转录实验,gDNA去除和cDNA第1链合成按逆转录试剂盒(TOYOBO, Revertra Ace qPCR RTMaster Mix with gDNA Remover)说明书操作。以cDNA作为模板PCR分别扩增和,体系如下:Premix10 μL,cDNA 2 μL,正反引物各加1 μL,ddH2O 7 μL。反应程序如下:95℃下预变性3 min;95℃下变性30 s,60℃下退火30 s,72℃下延伸40 s,30个循环;72℃下终延伸10 min,4℃下保存。1%琼脂糖凝胶电泳,拍照。
1.2.4 Western blot检测转基因水稻愈伤组织CTBIN蛋白表达
水稻愈伤组织可溶性总蛋白提取方法参照Jang等[18],略有修改。选取几个生长较好的转基因水稻愈伤组织克隆0.1~0.2 g于研钵中,液氮迅速研磨成粉,加入500 μL蛋白质提取液(10 mmol/L EDTA,20 mmol/L Tris-Cl pH 6.8,30 mmol/L NaCl,2% 巯基乙醇,2 mmol/L PMSF),4℃下浸提1 h,离心得上清即为蛋白提取液,Bradford法[19]进行蛋白质含量的测定。SDS-PAGE电泳的分离胶为15%,浓缩胶5%,保证每泳道蛋白上样量一致,均为20 µg。SDS-PAGE电泳结束后,用电转移法转移到PVDF膜,进行Western blot杂交检测。一抗采用兔抗人胰岛素原抗体(1∶500,镇江博研生物科技有限公司);二抗采用辣根过氧化物酶标记的羊抗兔IgG(1∶5000,Santa公司),采用ECL显色试剂盒(Invitrogen 公司)显色。
2 结果与分析
2.1 抗性愈伤组织的筛选、继代培养
经农杆菌侵染的水稻愈伤组织共培养后,转移至含有50 mg/L潮霉素的筛选培养基中筛选后,部分愈伤组织褐化死亡,抗性愈伤组织从褐化愈伤组织中长出(图2-A)。选取颜色淡黄,生长状态较好的愈伤组织在筛选培养基中继代培养,每两周继代一次(图2-B)。
2.2 抗性愈伤组织PCR鉴定和报告基因gfp表达检测
利用重组胰岛素原基因的引物对获得的水稻抗性愈伤组织克隆的基因组DNA进行PCR扩增,以质粒pCAMBIA1302-pGluB1sig-CTBIN- NOS为阳性对照,未转化愈伤组织为阴性对照,进行PCR(图3)。鉴定的7个转基因愈伤克隆全部为阳性,获得与预期片段大小相符的约567 bp目的基因片段,转基因阳性率为100%。
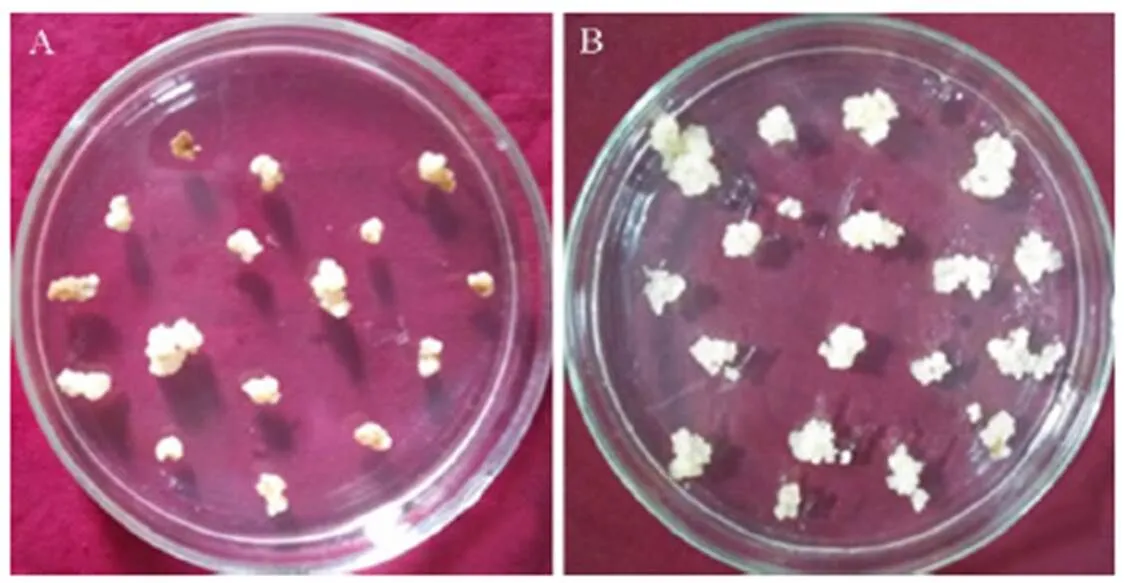
图2 筛选中的抗性愈伤组织(A)和继代中的抗性转基因愈伤组织(B)
Fig. 2. Resistant rice calli on screening medium(A) and resistant transgenic calli on subculture medium(B).
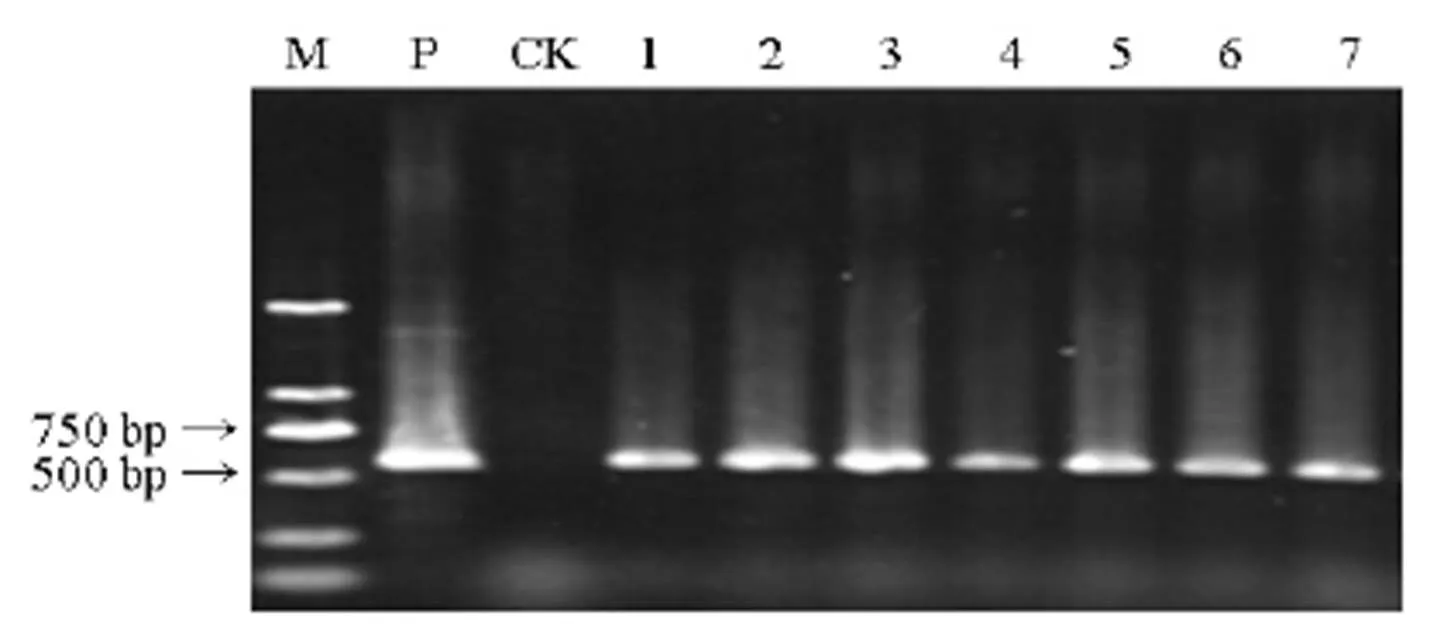
M−DL 2000 DNA 标记; P−质粒阳性对照; CK−非转基因愈伤组织阴性对照; 1~7分别代表转基因水稻愈伤不同克隆。
Fig. 3. PCR analysis ofgene in ricetransgenic callus clones.

图4 绿色荧光蛋白基因gfp在水稻转基因愈伤组织中表达的荧光显微镜观察
Fig. 4. Fluorescence microscope detection of thegene expression in rice transgenic calli.
将抗性愈伤组织克隆在荧光显微镜下观察,可见明显绿色荧光(图4),说明口服胰岛素原载体pCAMBIA1302-pGluB1sig-CTBIN-NOS确实成功转化了水稻愈伤组织。
2.3 转基因水稻愈伤组织CTBIN基因转录表达的RT-PCR鉴定
提取上述7个转基因水稻愈伤克隆的总RNA,以水稻为内参基因进行反转录实验,检测基因的转录表达,结果见图5。7个克隆中均扩增出了内参基因约为200 bp的条带,说明RT-PCR实验系统正常。有6个克隆扩增出了目的基因的300 bp预期片段,说明转基因水稻愈伤组织细胞中的种子特异的pGluB1启动子成功驱动了外源基因的转录表达。只有3号转基因克隆的未检测到转录表达,原因可能是该克隆中基因整合位点特殊或序列不完整影响了基因表达。
2.4 Western blot检测转基因水稻愈伤组织CTBIN基因的翻译表达
以非转基因水稻愈伤组织为对照,提取1、2、4、5号转基因水稻愈伤组织克隆的细胞总蛋白,以兔抗人胰岛素原抗体进行Western blot检测,结果如图6。检测的4个转基因水稻愈伤克隆均表达了特异性的目标蛋白条带,分子量约25 kD,而对照中未出现杂交信号,表明种子特异性谷蛋白GluB1启动子在水稻成熟胚愈伤组织中成功驱动了外源基因的表达。理论上,如果目标蛋白包括谷蛋白GluB1的N-端信号肽序列(24个氨基酸残基),分子量约为28 kD, 但检测到的目标蛋白分子量在25 kD左右,相当于CTB-人胰岛素原融合蛋白,由此推测融合蛋白中的N-端信号肽序列已被切除。
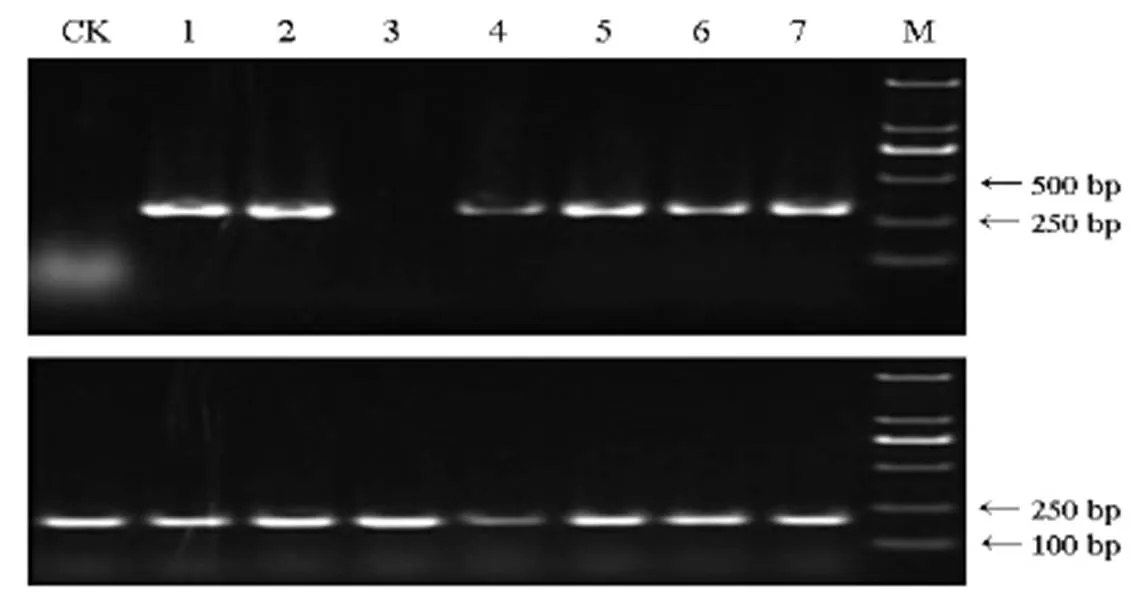
上图为目的基因CTBIN扩增条带,下图为水稻内参基因β-actin扩增条带。M−DL2000 DNA标记;CK−非转基因愈伤克隆阴性对照;1~7代表转基因水稻愈伤不同克隆。
Fig. 5. Detection of transcriptional expression ofgene in transgenic rice calli by RT-PCR.
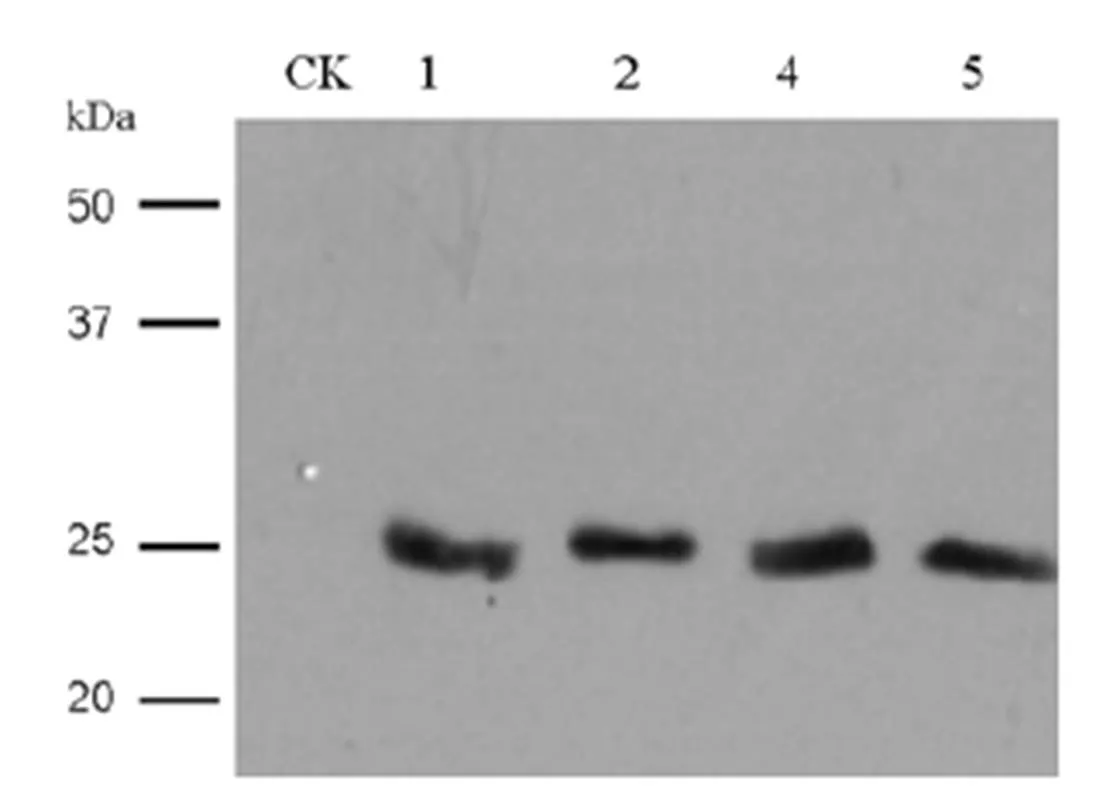
CK―非转基因愈伤克隆阴性对照;1, 2, 4, 5―不同转基因愈伤克隆编号。
Fig. 6. Detection of translational expression ofgene in transgenic rice calli by Western blot.
3 讨论
水稻作为基因组研究的模式生物,深入研究其基因表达的调控模式对理解植物的形态、发育和代谢调控等机理具有重要意义。pGluB1是近年来水稻种子生物反应器的研究热点[6-12,20],迄今未见关于pGluB1在植物种子以外组织中表达的报道。本研究结果证明,pGluB1启动子能驱动外源基因在水稻成熟胚愈伤组织中转录和翻译,而且融合蛋白包含的谷蛋白GluB1的N-端信号肽序列(24个氨基酸残基)在愈伤组织细胞中也被切除。
影响植物启动子表达的因素很多,所有基因表达调控都是通过细胞内的反式作用因子和启动子上游各种顺式作用元件的相互作用来实现的。本研究采用的2.3 kb pGluB1启动子除了包含植物启动子表达所必需的基本上游启动子元件如 TATA-box (TATAAA)、核糖体结合位点(AGGAGG)外,还包含与种子特异表达相关的顺式作用元件如AACA (AACAAAC)、GCN4(TGAGTCA)、(GTCAT)、ACGT、醇溶谷蛋白框(AAAG)、PROL(TGCAAAG)等基序。其中,AACA基序的作用是抑制种子特异性基因在胚乳以外的其他组织表达[21],GCN4和其他几个基序联合控制基因的胚乳特异性表达活性和表达水平[22]。GCN4基序是启动子种子特异性表达所必需的,属于基本亮氨酸拉链(basic leucine zipper, bZIP)转录因子家族成员及其同源蛋白的识别位点,水稻种子特异的bZIP蛋白RISBZ1与GCN4基序作用可使启动子表达活性增加100倍以上[23]。而AACA基序被MYB蛋白识别,在种子以外的其他组织作为抑制下游基因表达的负调控元件。OSMYB5蛋白在水稻多种组织中表达,但在种子以外的组织中,OSMYB5蛋白与AACA基序结合从而抑制水稻谷蛋白B1基因的表达[24]。然而,AACA基序与CaMV 35S启动子核心序列融合成人工启动子驱动构建报告基因载体,并与基因表达载体共同转化水稻胚盾片愈伤组织来源的原生质体并进行瞬时表达测试,发现OSMYB5未能对AACA基序产生作用[24],说明在水稻种子和愈伤组织来源的原生质体中反式作用因子与顺式作用元件的相互识别和作用存在差异。本研究中pGluB1成功驱动外源基因在水稻成熟胚愈伤组织中表达的原因,一方面可能是在愈伤组织中,某些反式作用因子如MYB蛋白无法与负调控基序如AACA发生作用,从而解除了对下游基因的表达抑制。另一方面,植物愈伤组织形成的体细胞胚与合子胚的发育大体相似,只是在细胞分裂方式、排列方式及形态特征上存在一些差异[25],推测愈伤组织细胞的基因表达模式和种子基因表达模式可能具有一定的相似性。Chen等[4]报道水稻CCCH型锌指蛋白OsGZF1在原生质体瞬时表达时,降低pGluB1启动子的表达活性的调控机制与其在转基因水稻种子中的调节机制确实存在一致性。因此,种子中特异表达的某些反式作用因子如RISBZ1也可能在愈伤组织中表达,本研究中可能这类反式作用因子通过与pGluB1启动子元件作用从而参与了基因的表达激活。由于水稻种子储藏蛋白的特异启动子元件在其他禾谷类作物如玉米、小麦种子储藏蛋白启动子序列中具有保守性,因而调控机制也相似[4,26]。本研究发现为探索植物种子特异启动子在愈伤组织中的表达活性及其机制提供了基础线索,也为应用愈伤组织初步快速筛选鉴定种子特异表达启动子提供了可能。
亚细胞定位靶向表达是植物生物反应器中提高重组蛋白表达量的有效手段。Jang等[18]报道,水稻叶绿体靶向运输信号肽序列(Target peptide, Tp)能介导外源GFP重组蛋白在水稻愈伤组织的非绿质体中高水平积累并正确加工,将N-端Tp序列切除。本研究的Western blot检测结果表明(图6),从分子量上看,pGluB1驱动融合基因在愈伤组织中表达时,融合蛋白N-端融合的谷蛋白GluB1信号肽序列(GluB1 signal peptide, GSp)能被成功切除。在水稻种子胚乳细胞中,谷蛋白前体在内质网腔合成,然后通过内膜系统分拣输送到蛋白储存囊泡,形成PB-I和PB-II,谷蛋白的信号肽序列在起源于高尔基器的PB-II中由特异的天冬酰胺内肽酶切除。由pGluB1驱动并在N-端添加GSp和C-端添加KDEL内质网滞留信号的重组7Crp多肽在水稻种子特异表达时,却主要在起源于内质网的PB-I中大量积累[20]。在成熟胚愈伤组织中表达的重组CTBIN蛋白是否也被分拣输送到囊泡中储存积累?其N-端GSp的加工切除机制是否与种子中相似?植物愈伤组织细胞内是否可形成类似于种子蛋白体的重组蛋白亚细胞储存机构?这些基本科学问题的探寻有望为植物愈伤组织细胞生物反应器的研究和应用开辟新思路,本研究结果为此提供了重要线索。
[1] de Los Reyes B G,Mohanty B,Yun S J, Park M R, Lee D YUpstream regulatory architecture of ricegenes:Summarizing the baseline towards genus-widecomparative analysis of regulatory networks andallele mining., 2015, 8(1): 14.
[2] Ye R, Zhou F, Lin Y. Two novel positive cis-regulatory elements involved in green tissue-specific promoter activity in rice (L.ssp.).,2012, 31(7): 1159-1172.
[3] Fumio T, Yuhya W, Shimpei H. An overview on the strategies to exploit rice endosperm as production platform for biopharmaceuticals., 2017, 263: 201-209.
[4] Chen Y, Sun A,Wang M, Zhu Z, OuwerkerkP B F. Functions of the CCCH type zinc finger protein OsGZF1 in regulation of the seed storage protein GluB-1 from rice., 2014, 84: 621-634.
[5] Qu L Q, Takaiwa F. Evaluation of tissue specificity and expression strength of rice seed component gene promoters in transgenic rice., 2004, 2(2): 113-125.
[6] 张宪银, 薛庆中. 水稻胚乳特异性启动子Gt1的克隆及其功能验证. 作物学报, 2002, 28(1): 110-114.
Zhang X Y, Xue Q Z. Cloning of a rice endosperm specific promoter Gt1 and its functional verification.2002, 28(1):110-114. (in Chinese with English abstract).
[7] 刘峰,赵伊英, 郑金贵. 籼稻胚乳特异性启动子Gt1的克隆及其功能验证. 长江大学学报:自然科学版, 2010, 7(2): 44-48.
Liu F, Zhao Y Y, Zheng J G. Isolation of endosperm-specific promoter Gt1 from indica rice and verification of its function in transgenic rice., 2010, 7(2): 44-48. (in Chinese with English abstract).
[8] Takaiwa F, Yang L, Wakasa Y, Ozawa K. Compensatory rebalancing of rice prolamins by production of recombinant prolamin/bioactive peptide fusion proteins within ER-derived protein bodies., 2018, 37: 209-223.
[9] Takaiwa F, Takagi H, Hirose S, WakasaYEndosperm tissue isgood production platform forartificial recombinant proteins intransgenic rice., 2007, 5:84-92.
[10] Katsube T, Kurisaka N, Ogawa M, Maruyama N, Ohtsuka R, Utsumi S, Takaiwa F. Accumulation of soybean glycinin and its assembly with the glutelins in rice., 1999, 120(4): 1063-1074.
[11] Momma K, Hashimoto W, Ozawa S, Kawai S, Katsube T, Takaiwa F, Kito M, Utsumi S, Murata KQuality and safety evaluation of genetically engineered rice with soybean glycinin: analyses of the grain composition and digestibility of glycinin in transgenic rice., 1999, 63(2): 314-318.
[12] Takagi H, Saito S, Yang L, Nagasaka S, Nishizawa N, Takaiwa FOral immunotherapy against a pollen allergy using a seed-based peptide vaccine., 2005, 3(5): 521-533.
[13] Chesnokov Y V, Manteuffel R. Dose effect of UV-B irradiation on pollen tube growth and seed-specific promoter activities in irradiated pollen grains of., 2000, 12(6): 361-364.
[14] Russell D A, Fromm M E. Tissue-specific expression in transgenic maize of four endosperm promoters from maize and rice., 1997, 6(2): 157-168.
[15] 唐湧洲, 俞越, 赵艳. 种子蛋白体靶向表达口服重组胰岛素原载体构建及转化水稻. 中国水稻科学, 2015, 29(5): 481-489.
Tang Y Z, Yu Y, Zhao Y. Construction of seed protein body targeted expression vector and transformation rice for oral recombinant proinsulin., 2015, 29(5): 481-489. (in Chinese with English abstract)
[16] 陈惠, 赵原, 种康. 一种改进的水稻成熟胚愈伤组织高效基因转化系统. 植物学通报, 2008, 25(3): 322-331.
Chen H, Zhao Y, Zhong K. Improved high efficient system for rice transformation using mature embryo-derived calli., 2008, 25(3): 322-331. (in Chinese with English abstract)
[17] 卢江扬, 郑康乐. 提取水稻DNA的一种简易方法. 中国水稻科学,1992, 6(1): 47-48.
Lu J Y, Zheng K L. A simple method for isolation of rice DNA., 1992, 6(1): 47-48. (in Chinese with English abstract)
[18] Jang I C, Nahm B H, Kim J K. Subcellular targeting of green fluorescent protein to plastids in transgenic rice plants provides a high-level expression system., 1999, 5(5): 453-461.
[19] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding., 1976, 72(1): 248-254.
[20] Takaiwa F, Hirose S, Takagi H, Yang L, Wakasa YDeposition of a recombinant peptide in ER-derived protein bodies by retention with cysteine-rich prolamins in transgenic rice seed., 2009, 229(5): 1147-1158.
[21] Jiang S Y, Vanitha J, Bai Y, Ramachandran S. Identification and molecular characterization oftissue-preferred rice genes and their upstreamregularly sequences on a genome-wide level., 2014, 14:331-345.
[22] Wu C,Washida H,Onodera Y, Harada K, Takaiwa FQuantitative nature of the prolamin-box, ACGT and AACA motifs in ariceglutelin gene promoter: Minimal-element requirements forendosperm-specific gene expression., 2000, 23(3): 415-421.
[23] Onodera Y,Suzuki A,Wu C Y, Washida H, Takaiwa FA rice functional transcriptional activator, RISBZ1, responsible for endosperm-specific expression of storage protein genes through GCN4 motif.2001, 276(17): 14139-14152.
[24] Suzuki A, Wu C Y, Washida H, Takaiwa HRice MYB protein OSMYB5 specifically binds to the AACA motif conserved among promoters of genes for storage protein glutelin.,1998, 39(5): 555-559.
[25] 张东向. 禾本科植物愈伤组织的形成分化和体细胞胚胎发生. 齐齐哈尔大学学报: 自然科学版, 2002, 18(4): 112-115.
Zhang D X. Differentiation and somatic embryo genesis of forming gallus of Gramineae.:, 2002, 18(4): 112-115. (in Chinese with English abstract)
[26] Duan M, Sun SS. Profiling the expression of genes controllingrice grain quality.2005, 59(1):165-178.
Rice Seed-specific Glutenin GluB1 Promoter Drives Exogenous Gene Expression in Rice Callus
ZHAO Yan*,TANG Yongzhou, SHI Yuqian
(,,,;Corresponding author,:)
【Objective】The promoter of rice glutelin B1(pGluB1) has been intensively used to study high seed-special expression of exotic genes, and as a model to understand regulation mechanism of seed-storage protein genes. Former researchers reported that pGluB1expressed only in rice seed endosperm with no expression activity in other tissues such as root, stem, leaf, sheath and glume etc. The present study is aiming to overcome the shortcoming of time consuming for screening of seed-special expression promoters.【Methods】The expression vector pCAMBIA1302-pGluB1sig- CTBIN-NOS, in which a fusion gene of the cholera toxin B subunit and human proinsulin () was driven by the 2.3 kb promoter sequence of rice glutelin GluB1 with its signal peptide (), was transformed into the rice calli from mature embryo via-mediated method. The expression of fusion geneat both transcription and translation level was tested by RT-PCR and Western-blotting assay.【Results】Among the seven transgenic calli clones, six clones of the fusion genewere expressed at transcription level. The selected four clones subjected to Western-blotting assay were all fatherly verified in their expression at translation level. Additionally, according to the molecular weight, we speculated that the signal peptide (24 aa) of GluB1 at N-terminus of the fusion protein CTBIN has been excised successfully from callus cells of all the test clones.【Conclusion】The rice seed-specific expression promoter pGluB1 can drive an exotic gene expression in callus, and the seed protein body subcellular-targeted signal peptide could be excised from callus cells. The results lay a foundation ofthe quick detection of expression activity of plant seed-specific expression promoters in callus and exploiting the mechanism of protein subcellular sorting selection in callus cells.
glutelin B1 promoter; signal peptide; rice; mature embryo calli; expression activity
10.16819/j.1001-7216.2018.8036
Q755;S511.01
A
1001-7216(2019)01-0028-07
2018-03-28;
2018-07-04。
国家自然科学基金资助项目(31772100);浙江省一流学科建设经费资助项目(食品科学与工程1110JYN6517001G)。

