安罗替尼治疗晚期进展性肉瘤的回顾性研究
龙作尧 鲁亚杰 李明辉 陈国景 王凤伟 刘冬 黄海 张红梅 王臻
肉瘤是一类起源于间叶组织的、具有高度异质性的恶性肿瘤,主要可分为软组织肉瘤 ( softtissue sarcoma,STS ) 和原发性骨肉瘤 ( primary bone sarcoma,PBS ) 两类[1]。STS 发病率约为 3.4 / 10 万,主要的病理类型包括脂肪肉瘤 ( liposarcoma,LPS )、平滑肌肉瘤 ( leiomyosarcoma,LMS )、多形性未分化肉瘤 ( undifferentiated polymorphous sarcoma,UPS )、腺泡状软组织肉瘤 ( alveolar soft part sarcoma,ASPS )等。手术是治疗 STS 的主要方法,但单纯手术治疗的局部复发率很高,而且易发生远处转移[2];因此结合阿霉素和异环磷酰胺为主的化疗,已成为 STS 多学科综合治疗的重要组成部分[3]。PBS 主要包括骨肉瘤 ( osteosarcoma,OSS )、尤文肉瘤 ( ewing sarcoma,EWS )、软骨肉瘤 ( chondrosarcoma,ChS )等。随着新辅助化疗的概念、广泛性切除的外科边缘原则和方法的广泛推广,外科手术已被认为是 PBS 的基础治疗手段,也使保肢治疗成为肢体骨肉瘤的标准治疗方法之一[4]。
晚期进展性肉瘤 ( advanced progressive sarcoma,APS ) 是指经一线治疗失败 ( 化疗耐药或术后复发 )或全身广泛转移或无法接受手术,且仍持续生长的终末期肉瘤。对于 APS,临床上主要采用全身姑息性化疗或局部放疗,减轻患者症状、改善生活质量,但对患者的总生存期无明显影响,且化疗相关不良反应难以忍受,使得 APS 治疗效果欠佳,预后不容乐观。随着新型药物的不断涌现,新型化疗药物、分子靶向药物、肿瘤免疫治疗药物等的逐渐应用,极大地丰富了 APS 的内科治疗,为患者带来了新的曙光,也引发了临床工作者更多的探索和思考[5]。安罗替尼是我国自主研发的多靶点小分子酪氨酸激酶抑制剂,能抑制 VEGFR、c-Kit 等激酶活性,阻断肿瘤血管生长,从而抑制肿瘤生长[6]。本研究对服用安罗替尼的 APS 患者进行随访,评估其疗效和不良反应。现报告如下。
资料与方法
一、纳入与排除标准
1. 纳入标准:( 1 ) 选自 2018 年 6 月 1 日~11 月30 日就诊于我院者;( 2 ) 有明确的病理诊断者;( 3 )就诊前已经一线治疗失败 ( 化疗耐药或术后复发 ) 或全身广泛转移或无法接受手术,且肿瘤仍持续生长者;( 4 ) 肝肾功、血常规、甲状腺、血脂基本正常者;( 5 ) 签署知情同意者。
2. 排除标准:( 1 ) 病理诊断未明确者;( 2 ) 未经过一线治疗者;( 3 ) 无法耐受药物不良反应者;( 4 )无法按规律服药者;( 5 ) 拒绝签署知情同意书者。
本项研究已通过西京医院伦理委员会认证。
本研究共纳入 17 例。男 10 例,女 7 例,平均年龄 ( 41.7±22.4 ) 岁。其中 4 例 OSS,3 例 ChS,3 例 UPS,2 例上皮样肉瘤 ( epithelioidsarcoma,ES ),2 例 LMS,1 例 ASPS,1 例腹腔促纤维组织增生性小圆细胞瘤 ( desmoplasticsmallroundcelltumor,DSRCT ),1 例纤维肉瘤 ( fibrosarcoma,FS )。
二、治疗方法
17 例早餐前均口服安罗替尼 12 mg 1 次 / 日,连续服用 2 周,停药 1 周,即 3 周 ( 21 天 ) 为 1 个疗程。连续服用,直至疾病快速进展或出现不可耐受的不良反应 ( adverseevent,AE )。当 AE 级别达到3 级及以上时,暂停用药,待恢复到<2 级后,下调一个剂量 ( 第一次调整 10 mg,第二次调整 8 mg ) 后继续给药;若 2 周后仍未恢复,则永久停药。
若患者出现肿瘤危象 ( 肿瘤破溃 / 出血、严重压迫 / 剧痛,骨折 / 将要骨折 ) 时,建议先停药 2 周减少对伤口的影响,后行减瘤手术 ( cytoreductive surgery,CRS ),在不危及患者生命的情况下尽可能切除,降低总体肿瘤负荷 ( total tumor burden,TTB )。服药过程中,视患者全身状况及肿瘤控制情况,给予放疗、CRS 或氩氦刀等局部治疗。
三、疗效及不良反应评估
开始服药后每 2 个疗程 ( 6 周 ) 评估疗效。采用计算肿瘤体积 ( tumor volume,TV ) 的变化来反映临床疗效。△TV ≥ 72.8% 为疾病进展 ( progressive disease,PD ),-65.7%<△TV<72.8%且肿瘤相关症状无加重为疾病稳定 ( stable disease,SD ),△TV ≤-65.7% 为部分缓解 ( partial response,PR ),肿瘤消失为完全缓解 ( complete response,CR )。若 72.8%≤ △TV<100%,但肿瘤相关症状无加重且瘤内出现液化、坏死,仍考虑 SD ( 图 1 )。若有多个可评估病灶,需根据 TTB 的变化判断整体疗效。总缓解率( overall response rate,ORR )=CR+PR;疾病控制率( disease control rate,DCR )=CR+PR+SD。
不良反应根据国家癌症研究所常见药物毒性反应分级标准 ( National cancer institute common toxicity criteria version,NCICTC ) 4.03 版本进行分级,共分为 1~5 级。

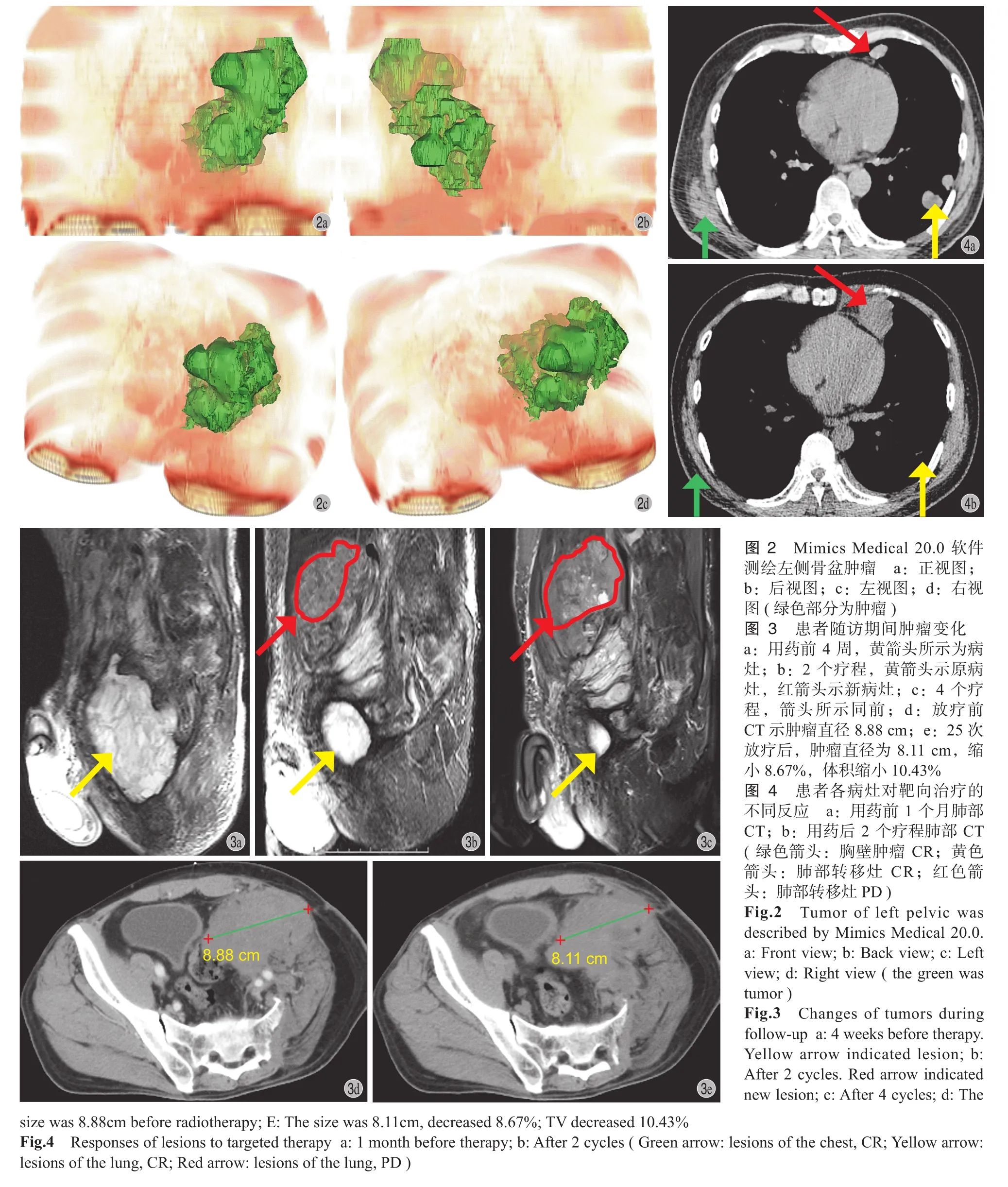
图 1 用药前后肿瘤变化 a:用药前肿瘤最长径 D:6.39 cm,TV:52.25 cm3;b:2 个疗程后,D:7.37 cm,TV:95.43 cm3。D:增加 15.34%,RECIST1.1 评价 SD;TV:增加 82.64%,但瘤内出现坏死、钙化,评价 SDFig.1 Efficacy a: Before the therapy, the maximum diameter D:6.39 cm, TV: 52.25 cm3; b: After 2 cycles, D: 7.37 cm, TV: 95.43 cm3.D: increased 15.34%, SD by RECIST1.1; TV: increased 82.64%, but tumor had necrosis and calcification, SD by TV
四、统计学分析
采用 Mimics Medical 20.0 进行肿瘤测绘及体积计算 ( 图 2 ),采用 SPSS 18.0 进行统计学分析,组间疗效比较采用 χ2检验,以 P<0.05 为差异有统计学意义。
结 果
就诊于我院的 17 例 APS 患者,病理类型:4 例 OSS,3 例 ChS,3 例 UPS,2 例 ES,2 例 LMS,1 例 ASPS,1 例 DSRCT,1 例 FS;原发部位:4 例上肢,6 例下肢,7 例躯干;12 例转移:6 例肺,3 例盆腔,2 例淋巴结,2 例肝脏,2 例腹腔,1 例脊柱,1 例颅骨,1 例脑;6 例术后复发:4 例OSS,2 例 UPS;AJCC 分期为:7 例 PBS 均为 III期;STS 中 3 例 IIIB 期,7 例 IV 期。14 例 ( 82.35% )有手术史;既往接受一线化疗 ( 蒽环类药物和异环磷酰胺 ) 11 例 ( 64.71% ),阿帕替尼等靶向治疗 2 例( 11.76% ),放射治疗 5 例 ( 29.41% )。安罗替尼为一线治疗者 6 例 ( 35.29% ),其中 3 例拒绝化疗,3 例 ChS 未化疗;9 例 ( 52.95% ) 为二线治疗,2 例( 11.76% ) 为三线及以上治疗 ( 表 1 )。
17 例中,药物治疗前有 6 例行 CRS;治疗过程中由于局部病灶发展或症状加重,2 例给予氩氦刀治疗,2 例给予局部放疗,1 例给予闭式胸腔引流,并胸膜腔内注射尿激酶和阿霉素解除胸膜粘连,1 例给予介入栓塞治疗。
17 例用药 2 个疗程后进行疗效评价。无 CR,PR 2 例 ( 11.76% ),SD 11 例 ( 64.70% ),PD 4 例( 23.54% ),ORR 为 11.76%,DCR 为 76.46%;其中 STS 患者的 DCR 为 80.00% ( 8 / 10 ),PBS 患者的DCR 为 71.43% ( 5 / 7 ),两者疗效差异无统计学意义( P=0.559 );TTB ≥ 200 cm3患者的 DCR 为 75.00%( 6 / 8 ),TTB<200 cm3患者的 DCR 为 77.78% ( 7 /9 ),肿瘤体积与疗效差异无统计学意义 ( P=0.665 )( 表 2 )。
在治疗过程中,患者出现以下病情变化时,采取积极干预措施:
1. 出现新病灶:当患者肺外出现新病灶时,若TTB 较原来未增加,继续服药 2 个疗程后复查;否则考虑耐药,应更换药物,必要时给予局部放疗。1 例 UPS 患者,原发为左股骨远端骨巨细胞瘤,术后经历 3 次复发 2 次手术,第 2 次复发时伴同侧腹股沟转移,病理诊断 UPS;第 3 次复发时行CRS ( 左侧半骨盆截肢 ),剩余髂窝病灶占原总肿瘤负荷 30%,术后 2 个月开始服用安罗替尼。用药前 4 周 MRI 示病灶 VA1=298.67 cm3;2 个疗程后 VA2=56.3 cm3,肿瘤缩小 81.15%,同时原病灶上方出现一个新病灶 ( VB1=129.64 cm3),TTB 减小 37.74%。未予特殊处理,继续服药 2 个疗程后复查,原病灶 VA3=20.26 cm3,缩小 64.01%,但新病灶增大 148.30% ( VB2=321.89 cm3),TTB 较上次增加 84.01%,考虑患者已出现耐药,更换服用阿帕替尼,同时对新病灶部位行局部放疗;1 个月后 CT 示肿瘤缩小 10.43%,显示治疗有效 ( 图 3 )。

表 1 患者基线资料Tab.1 Clinical characteristics of patients
2. 全身病灶药物反应不同:对于多发转移的患者,若仅 1~2 处病灶 PD,余各处病灶 (>2 处 ) 均为 SD、PR 或 CR,仍考虑治疗有效,必要时对进展病灶给予局部治疗,如氩氦刀、CRS、介入栓塞、局部放疗等。1 例 UPS 患者原发为右上臂 LMS,反复手术、复发后病理诊断 UPS,伴双肺多发转移。最后一次复发后行 CRS,切除所有肉眼可见肿瘤,术后使用培唑帕尼、阿帕替尼+PD-1+放疗等均进展。后更换使用安罗替尼 2 个疗程,右臂肿胀消失,胸壁转移灶为 CR,肺部一处病灶 PD,直径增大 133.13%,余病灶为 CR ( 图 4 );后由于胸腔积液停药,右臂肿胀明显,遂给予闭式胸腔引流对症治疗,对右上臂肿瘤、肺部 PD 病灶行介入栓塞,治疗后患者右臂肿胀迅速消退,每日胸腔引流量较前明显减少。
17 例非血液系统毒性包括食欲减退 ( 35.29% ),乏力 ( 23.53% ),高血压 ( 11.76% ),手足皮肤反应( 11.76% ),出血 ( 11.76% ),胸腔积液 ( 11.76% ),甲功减退 ( 5.88% ),腹泻 ( 5.88% ),气胸 ( 5.88% );血液系统毒性有贫血 ( 5.88% ) 等。3~4 级不良反应有手足皮肤反应 ( 5.88% ),高血压 ( 5.88% ),气胸( 5.88% ) ( 表 3 )。

表 2 TTB、组织类型与临床疗效的相关性分析Tab.2 The analysis of correlation between efficacy and TTB,histopathology

表 3 不良反应类型及发生率Tab.3 Varieties and prevalence of adverse events
讨 论
20 世纪 70 年代之前,手术是治疗 STS 的主要方法,但单纯手术局部复发率很高,也极易发生远处转移,且不可通过手术治愈,即发展为 APS;另有 10% 的患者在初诊时已有远处转移,以肺转移最为常见[7]。随着化疗药物和放疗技术的发展,手术、化疗、放疗已形成了恶性肉瘤的多学科治疗体系,用于改善患者预后、控制疾病进展;但对于 ASP 患者来说,目前的多学科治疗虽然可以减轻症状、提高生活质量,但对于总体生存期并无明显延长[8]。
分子靶向治疗 ( molecular targeted therapy,MTT )是指在肿瘤分子生物学基础上利用肿瘤组织或细胞所具有的特异性结构分子作为靶点,使用某些能与这些靶分子特异性结合的抗体、配体等,达到直接治疗或导向治疗的一大类治疗手段,具有很好的分子和细胞选择性,选择性杀伤肿瘤细胞,减少对正常组织的损伤[9]。MTT 在个体化治疗和提高患者生存质量等方面具有突出优势,为 ASP 患者提供了新的治疗手段。MTT 主要有小分子酪氨酸激酶抑制剂 ( tyrosine kinase inhibitor,TKI ) 和单克隆抗体( monoclonal antibody,McAb ) 两大类。
2005 年 FDA 快速批准第一个多靶点 TKI 药物索拉菲尼,用于治疗晚期肾细胞癌。相对于单靶点的药物,多靶点药物更具有优越性,可避免产生药物相互作用,且作用全面,不良反应减少,患者依从性更佳。目前的多靶点 TKI 药物还有伊马替尼、帕唑帕尼、舒尼替尼、阿帕替尼等,多项与之相关的临床试验正在进行当中。van der Graaf 等[10]报道的 PALETTE,是一项帕唑帕尼治疗晚期非脂肪性 STS 的多中心、随机、双盲、安慰剂对照 III 期临床试验,包括 20 余种亚型的肉瘤。结果显示:帕唑帕尼可明显延长晚期 STS 患者的 PFS ( 4.6 m vs.1.6 m,P<0.001 ),但对 OS 却无显著影响 ( 12.5 m vs. 10.7 m,P=0.25 )。但相较于其它药物,其在二线治疗中显出明显优势,美国 FDA 批准的帕唑帕尼,是目前惟一一个应用于二线治疗晚期肉瘤患者的 TKI 药物。
安罗替尼是由我国自主研发的一种多靶点 TKI 药物,主要靶点为血管内皮细胞生长因子 ( VEGFR2 ),并对 VEGFR3、VEGFR1、干细胞因子受体 c-Kit、血小板源性生长因子受体 PDGFRβ 等也有明显的抑制作用;可通过抑制 VEGFR2 介导的下游信号转导,从而抑制肿瘤新血管的生成;同时还可抑制c-Kit 和 PDGFRβ 下游信号通路,抑制肿瘤生长[11]。目前在国内被批准于治疗晚期 NSCLC。Chi 等[12]进行的安罗替尼治疗难治性 STS 的 II 期临床前研究,证明安罗替尼对多种亚型有广泛的抗肿瘤活性,尤其是 ASPS ( PFS,vs. 帕唑帕尼 vs. 舒尼替尼 vs. 西地尼布,21 m vs. 13.6 m vs. 17 m vs. 10.8 m )、LMS 等,对 PFS 和 OS 的延长均优于其它抗肿瘤药物;而且不良反应主要包括高血压、高脂血症、手足皮肤反应和乏力,大部分为 1~2 级,且多可耐受或控制。本研究中,靶向治疗对 STS 患者的疗效虽优于 PBS患者,但两者 DCR 差异无统计学意义 ( 80.00% vs.71.43%,P=0.559 )。不良反应发生率较高的为食欲减退 ( 35.29% )、乏力 ( 23.53% )、高血压 ( 11.76% )等,与 Chi 等的研究相似,多为 1~2 级,且耐受性较好。

图 5 Tomita 评分判断脊柱转移肿瘤患者预后 [ *重要脏器 ( 肺、肝、肾、脑 ) 无转移:0 分;**骨转移 ( 包括脊柱转移灶 ) 无转移:0 分 ]Fig.5 Tomita scoring system was applied to evaluate prognosis of spinal metastasis [ *No visceral metastasis( lung / liver / kidneys / brain ): 0 point; **Bone metastasis:including spinal lesions ]
由于 APS 患者均处于晚期、进展期,且肿瘤多不规则,难以用最长径变化来判断其肿瘤进展情况;而且 TKI 药物治疗后常常是肿瘤坏死并形成空洞,而在肿瘤体积上无明显变化,这时按照 RECIST1.1 标准,难以客观真实地评价靶向药物的疗效。因此,以 RECIST1.1 标准为基础,笔者利用 Mimics Medical 20.0 软件去除瘤内空洞部分,计算肿瘤体积,通过体积变化判断药物疗效。结合肿瘤体积计算公式TV=( π×a×b×c ) / 6 ( a,b,c 为肿瘤三维直径 ),将 RECIST1.1 标准转换为体积即 ( 1 ) 直径增加 20%时,体积为原来的 172.8%,增加 72.8%;( 2 ) 直径缩小 30% 时,体积为原来的 34.3%,减少 65.7%。对于体积较小的病灶 ( 肺部病灶和淋巴结等 ),CT 或 MRI 所示层面较少,计算体积误差大,仍推荐采用 RECIST1.1 标准评价疗效[13]。
抗肿瘤药物疗效评价的理想终点指标应该是OS 或 PFS,但是对于 APS 患者,肿瘤一直处于 PD状态,无法获得无进展状态或无进展期较短,因此主要治疗目标是使其生存时间超过生存预期 ( life expectancy )。有研究表明,伴肺转移的 OSS 患者的OS 约为 10.1 个月[14],而 STS 患者中,晚期患者的OS 约 12~18 个月,已发生转移的约 8~12 个月进展性[15];有脊柱转移的患者,可根据 Tomita 评分判断患者生存预期、治疗目标及手术方式[16]( 图 5 )。
虽然对于 APS 患者不建议进行手术,但在笔者治疗过程中,对有以下症状或风险的患者实施了CRS:( 1 ) 硬膜囊受压导致脊髓功能进行性减退;( 2 ) 存在或将发生负重骨不稳定;( 3 ) 经非手术治疗无效的严重顽固性疼痛;( 4 ) 肿瘤经放射治疗后仍进行性增大引起症状。在本研究中,6 例在服用安罗替尼前行 CRS,在不影响患者生命安全的情况下尽可能切除肿瘤,减轻患者肿瘤负荷,其中有 2 例剩余肿瘤负荷 ≥ 200 cm3;17 例中,TTB<200 cm3患者的 DCR 与 TTB ≥ 200 cm3的患者无统计学差异( 77.78% vs. 75.00%,P=0.665 ),即 TTB 与靶向治疗疗效并无显著相关性。因此在 MTT 前,CRS 是否适用于所有患者还有待研究。
靶向药物对 APS 患者的治疗及疗效评价还有待进一步的探索和完善。首先,随着免疫治疗的不断应用,尤其是 PD-1 单抗与靶向药物的联合,给临床提供了更丰富的选择方案[17]。而且,RECIST1.1标准对于靶向药物治疗的患者是不完善的,而本研究中利用体积评价疗效的方法还有待进一步检验和修正。其次,由于本研究样本量较少,因此安罗替尼对 STS 和 PBS 的疗效是否有差异,还有待进一步验证。而且,通过 CRS 减小总体肿瘤负荷,是否可以提高 APS 患者靶向治疗的疗效,还有待研究。
总之,安罗替尼对于 APS 患者有一定的疗效,且不良反应较轻,多可耐受或药物控制。目前临床试验已证明安罗替尼对 STS 有广泛的抗肿瘤作用,而对 PBS 的疗效还有待进一步的临床验证。

