气相色谱-串联质谱法测定蛋和蛋制品中氟虫腈及其代谢物残留量
柳 菡,龚玉霞,王绳芸,余可垚,李静静,沈伟健,丁 涛,伊雄海,邓晓军,徐敦明,赵增运,吴 斌,张 睿,韩 深
(1.江苏出入境检验检疫局,江苏 南京 210019;2.上海出入境检验检疫局,上海 200135;3.厦门出入境检验检疫局,福建 厦门 361026;4.北京出入境检验检疫局,北京 100026)
自欧洲“毒鸡蛋丑闻”[1]被公开以来,大量鸡蛋及鸡蛋类产品从欧洲各大超市下架。欧盟十五国、瑞士、韩国、香港和台湾地区也都发现了被杀虫剂氟虫腈污染的鸡蛋。氟虫腈[2]是一种苯基吡唑类杀虫剂,杀虫谱广,其作用机制为阻碍昆虫γ-氨基丁酸控制的氯化物代谢,对鱼、虾、蜜蜂、家蚕高毒,持效期长,对环境极其不友好。氟虫腈在中性和酸性溶液中稳定,在碱性溶液中缓慢水解,光照下缓慢降解,在水溶液中经光照可快速分解。氟虫腈有光解产物氟甲腈,氧化产物氟虫腈砜和还原产物氟虫腈硫醚3种主要的代谢产物[3]。
欧盟对蛋中氟虫腈(以氟虫腈和氟虫腈砜之和计)限量为0.005 mg/kg[4];日本对蛋中氟虫腈的限量要求为0.02 mg/kg[5];中华人民共和国农业部等三部委第1157号公告[6]规定,我国自2009年10月1日起禁用氟虫腈,卫生用、玉米等部分旱田种子包衣剂除外;GB 2763—2016[7]规定,粮谷、油料、蔬菜、水果、糖料和食用菌中氟虫腈(以氟虫腈、氟虫腈硫醚、氟虫腈砜、氟甲腈之和计)的限量为0.02~0.10 mg/kg。
我国现有的氟虫腈检测方法标准有SN/T 1982—2007[8]、SN/T 4039—2014[9]、GB 23200.8—2016[10]、GB 23200.9—2016[11]、GB 23200.7—2016[12]等。上述标准主要针对植物源性产品,目标物只针对氟虫腈,采用气相色谱-质谱法和液相色谱-串联质谱法测定,定量限为0.002~0.066 mg/kg。目前,文献报道的氟虫腈检测方法[13-20]多针对植物源性产品、血浆和尿液样品,采用乙腈或丙酮提取,分散固相萃取、固相萃取、固相微萃取或液-液萃取净化,气相色谱-质谱法、气相色谱-串联质谱法或液相色谱-串联质谱法测定。也有文献[21-22]报道了水产品中氟虫腈及其代谢物的检测方法,分别采用乙腈水溶液和二氯甲烷-丙酮混合溶液提取,经分散固相萃取净化和液-液萃取-复合固相萃取柱净化,气相色谱或气相色谱-质谱法测定。但液-液萃取和复合固相萃取柱净化的操作较为繁琐,使用的有机溶剂量较大;复杂动物源性样品中干扰较多,气相色谱法的定性能力较弱,难以满足分析要求。
目前,蛋及蛋制品中氟虫腈及其代谢物的检测方法有液相色谱-串联质谱法[23]、气相色谱-质谱(负化学源)法[24]和液相色谱-四极杆飞行时间质谱法[25]。时逸吟等[23]采用含0.1%甲酸的乙腈溶液提取鸡蛋、鸡肉等食品中的氟虫腈及其代谢物,经无水硫酸镁、氯化钠和柠檬酸钠盐析,分散固相萃取净化后,采用液相色谱-串联质谱法检测。沈伟健等[24]采用乙腈提取鸡蛋和蛋制品中的氟虫腈及其代谢物,经分散固相萃取净化后,气相色谱-负化学源质谱法检测。郭德华等[25]采用0.1%甲酸乙腈溶液提取鸡蛋、蛋糕等食品中氟虫腈及其代谢物,经固相萃取净化,液相色谱-四极杆飞行时间质谱法测定。但未见采用气相色谱-串联质谱法测定蛋和蛋制品中氟虫腈及其代谢物的报道。
本研究拟采用QuEChERS技术[26]从提取溶剂、盐的选择和用量、分散固相萃取剂的选择和用量,对氟虫腈回收率的影响进行考察,优化前处理方法,采用气相色谱-串联质谱法检测氟虫腈及其代谢物的残留量。
1 实验部分
1.1 仪器与试剂
7890B-7000C气相色谱-串联质谱仪:美国Agilent公司产品;KQ-250DE超声仪:中国昆山市超声仪器有限公司产品;XW-80A涡旋混匀器:中国上海医大仪器厂产品;LDZ5-2离心机:德国Sigma公司产品;Milli-Q去离子水发生器:美国Millipore公司产品;旋转蒸发仪:瑞士Buchi公司产品。
氟虫腈、氟甲腈、氟虫腈硫醚和氟虫腈砜标准物质:纯度均大于99%,德国Sigma公司产品;乙腈(色谱纯):德国Merck公司产品;乙腈、冰醋酸、氯化钠:均为分析纯,南京化学试剂有限公司产品;N-丙基乙二胺(PSA)、石墨化碳黑(GCB)、十八烷基硅烷(C18):赛分科技有限公司产品;实验用水为Milli-Q去离子水;鸡蛋、蛋粉、冰蛋和皮蛋样品:均购自超市。
1.2 溶液的配制
1.2.1标准储备液的配制 分别称取适量的标准物质,用乙腈溶解,配制成1.0 g/L的标准储备液,于-18 ℃避光保存。
1.2.2混合标准溶液的配制 分别移取适量的标准储备液,用乙腈配制成1.0 mg/L的混合标准溶液,于-18 ℃避光保存。
1.2.3基质标准工作溶液的配制 量取一定体积的混合标准溶液,根据需要用阴性样品提取净化后,将溶液稀释成适用浓度的基质标准工作溶液,现用现配。
1.3 前处理方法
1.3.1提取 准确称取适量的样品(10 g鲜蛋和冰蛋,5 g蛋粉和皮蛋,精确至0.01 g)至50 mL塑料离心管中,加适量的水(鲜蛋和冰蛋加5 mL水,蛋粉和皮蛋加10 mL水),涡旋30 s,充分混合均匀;加入25 mL 0.1%冰醋酸乙腈溶液,涡旋1 min;加入5 g氯化钠,剧烈振摇1 min;超声提取15 min,以8 000 r/min离心3 min,取上层清液至鸡心瓶中;向残渣中再加入15 mL 0.1%冰醋酸乙腈溶液,剧烈振摇1 min;超声提取15 min,以8 000 r/min离心3 min,取上层清液,合并2次上清液至鸡心瓶;于40 ℃水浴中,旋转蒸发至干。
1.3.2净化 向样品提取物中加入适量的乙腈(鲜蛋和冰蛋加2.0 mL,蛋粉和皮蛋加1.0 mL),涡旋1 min,将溶液转移至预先加入100 mg PSA、150 mg GCB、50 mg C18的试管中,涡旋1 min,过0.22 μm有机滤膜至进样小瓶,待GC-MS/MS分析。
1.4 实验条件
1.4.1色谱条件 色谱柱:HP-5MS 弹性石英毛细管柱(30 m×0.25 mm×0.25 μm);升温程序:初始温度70 ℃,以25 ℃/min升至300 ℃,保持2.8 min;载气(He)流速1.0 mL/min;进样量1.0 μL;脉冲不分流进样(脉冲压力1.72×105Pa),1.50 min后打开分流阀;进样口温度270 ℃。
1.4.2质谱条件 电子轰击(EI)离子源;电子能量70 eV;接口温度280 ℃;离子源温度230 ℃;四极杆温度150 ℃;碰撞气:高纯氮气(≥99.999%);数据采集模式:多反应监测模式(MRM),详细信息列于表1。
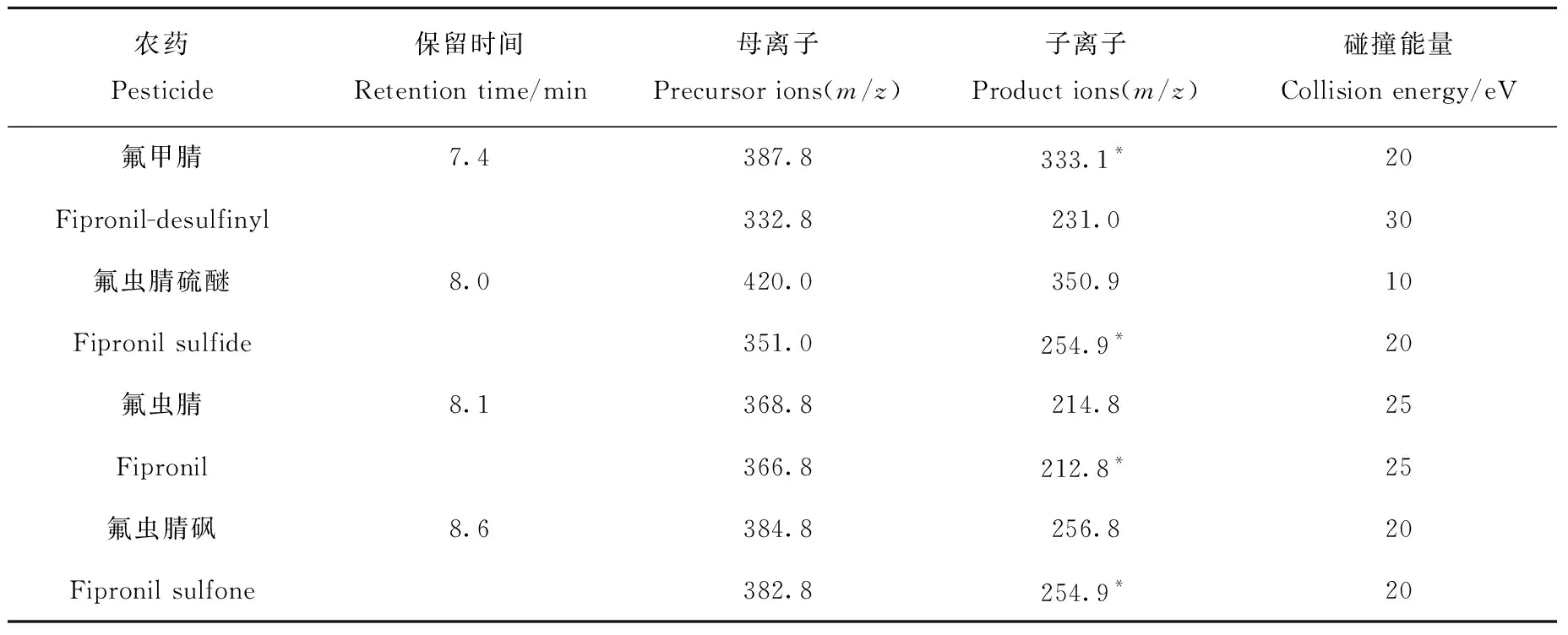
表1 氟虫腈及其代谢物的多反应监测信息Table 1 Multiple reaction monitoring (MRM) parameters of fipronil and its metabolites
注:*表示定量离子
2 结果与讨论
2.1 前处理条件的优化
本研究采用QuEChERS法从提取溶剂、提取方式、盐的选择和用量、分散固相萃取剂的选择和用量4个方面进行优化。由于氟甲腈、氟虫腈硫醚、氟虫腈、氟虫腈砜4种化合物中氟虫腈在GC-MS/MS上的响应最低,且4种化合物随条件变化的规律一致,故以氟虫腈为代表,通过比较不同条件下氟虫腈的回收率变化,优化前处理条件。
2.1.1提取溶剂的选择 提取溶剂应对氟虫腈及其代谢物有较好的溶解性,而对样品基体里的杂质有尽量低的提取能力,同时具有沉淀蛋白的作用。根据氟虫腈及其代谢物的溶解性、极性和稳定性,本研究分别考察了乙酸乙酯、丙酮、乙腈、0.1%冰醋酸乙腈溶液作为提取溶剂的提取效果。丙酮和乙腈与水互溶,为了改善沉淀蛋白的效果,促进待测物向有机溶剂中转移,需要在提取后加入适量的氯化钠,以除水并盐析。乙酸乙酯提取液比丙酮、乙腈、0.1%冰醋酸乙腈的提取液浑浊,可能是由于乙酸乙酯对油脂有一定的提取能力;丙酮提取液颜色比其他提取液深,可能是由于丙酮对色素的提取能力较强。GC-MS/MS分析结果表明,经4种溶剂提取后,氟虫腈样品峰面积均大于等浓度标准溶液峰面积,即存在一定的基质增强效应。因此,配制各溶剂条件下同等浓度基质标准溶液,以单点法校正各溶剂条件下的加标回收率,结果列于表2。实验最终选择0.1%冰醋酸乙腈作为提取溶剂。
2.1.2提取方式的选择 为了尽量完全提取蛋及蛋制品中的氟虫腈及其代谢物,需要使样品充分稀释或分散,使提取溶剂充分渗透,并混合均匀。常用的提取方式有振摇、涡旋、超声、振荡等。鲜蛋和冰蛋样品含有一定的水分,向10 g样品中加入5 mL水可以充分稀释和混匀,加入提取溶剂后涡旋即可充分渗透,确保后续超声提取的效果。蛋粉和皮蛋样品中含水量较少,向10 g样品中加入5 mL水,仍呈较浓稠的糊状,加入提取溶剂后,涡旋、超声或猛烈振摇均不能实现充分渗透。故将蛋粉和皮蛋样品的称样量减至5 g,加水量增至10 mL,样品得到充分稀释,形成混悬液,加入提取溶剂后,涡旋能够使提取溶剂充分渗透,后续的超声提取完全。对超声提取时间进行考察,结果表明超声10 min以上时,回收率无显著增加,但为了保证充分提取,选择超声提取15 min。
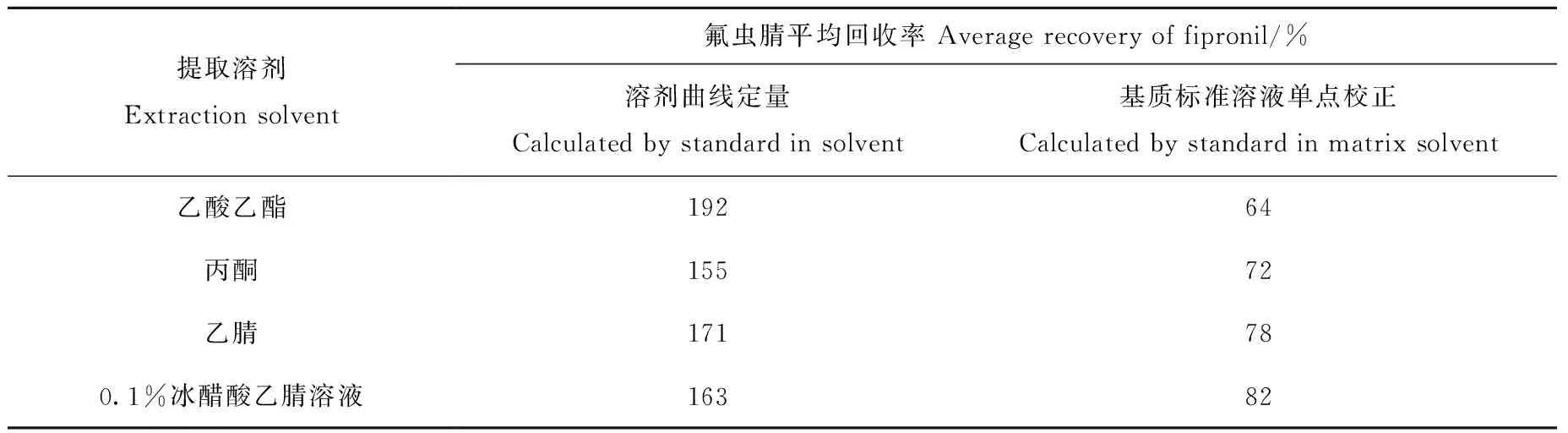
表2 不同提取溶剂对氟虫腈的提取效率(n=2)Table 2 Extraction efficiency of fipronil with different extraction solvents (n=2)
2.1.3分散固相萃取剂的选择和用量
QuEChERS法常使用分散固相萃取剂(如十八烷基硅烷(C18)、N-丙基乙二胺(PSA)和石墨化碳黑(GCB))以达到除杂净化的目的。C18可除去基质中脂肪等弱极性化合物;PSA可除去基质中有机酸等极性化合物;GCB可吸附色素等物质。本研究以此为三因素,选择50、100、150 mg 3个质量水平,以正交实验法进行优化,实验设计和结果列于表3。可以看出,各净化条件下均存在一定的基质增强效应, GCB是影响净化效果最重要的因素,随着GCB量的增加,回收率降低,即基质增强效应减弱,故选择GCB加入量150 mg;随着PSA量的增加,回收率降低,即基质增强效应减弱,当加入100 mg以上时,对回收率没有显著影响,故选择PSA加入量100 mg;C18量的增加对回收率没有显著影响,为在达到净化目的的前提下使用较少的净化剂,故C18加入量为50 mg。
2.1.4基质效应 按上述确定的净化条件配制基质标准溶液,同时配制未经净化的基质标准溶液,与溶剂标准溶液同时进行分析,峰面积结果列于表4。净化后基质标准溶液中氟虫腈峰面积是同等浓度溶剂标准溶液峰面积的140%,而未经净化的基质标准溶液中氟虫腈峰面积是同等浓度溶剂标准溶液的261%。可见,采用优化后的分散固相萃取条件净化样品,基质增强效应可大幅度降低,但是仍存在一定的基质增强,为了定量的准确性,采用基质校正曲线定量。
2.2 仪器条件的优化
在不同的碰撞能量下,采用GC-MS/MS法分析氟虫腈及其代谢物标准溶液,优化后的最佳母离子/子离子对和碰撞能量列于表1。阴性鲜鸡蛋基质标准溶液的GC-MS/MS谱图示于图1。
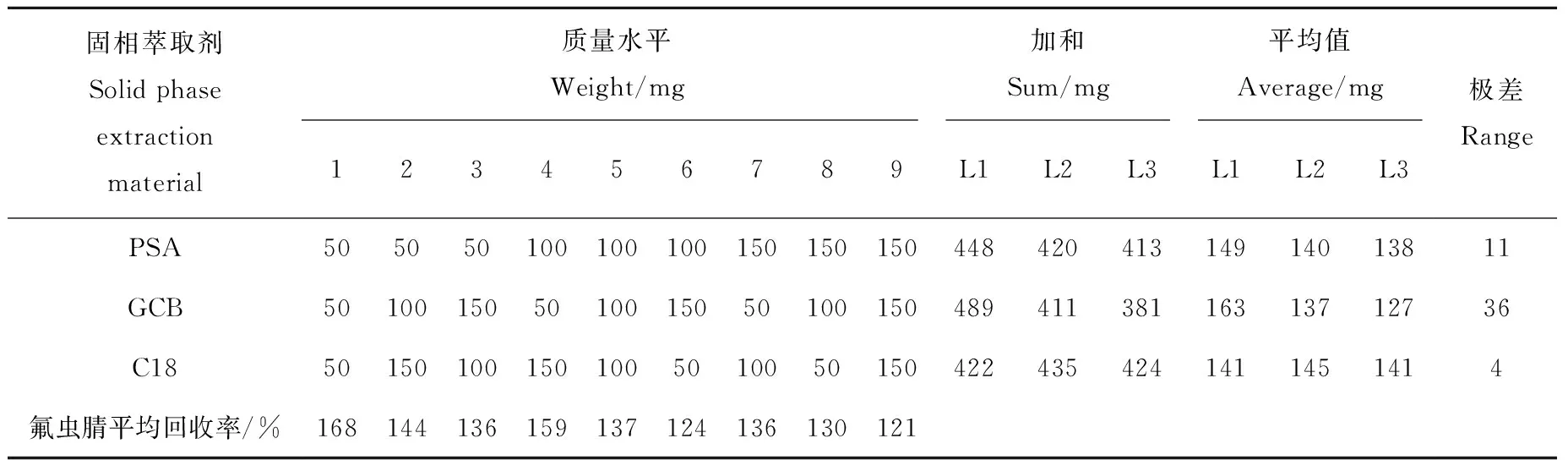
表3 正交实验的结果Table 3 Results of orthogonal experiment
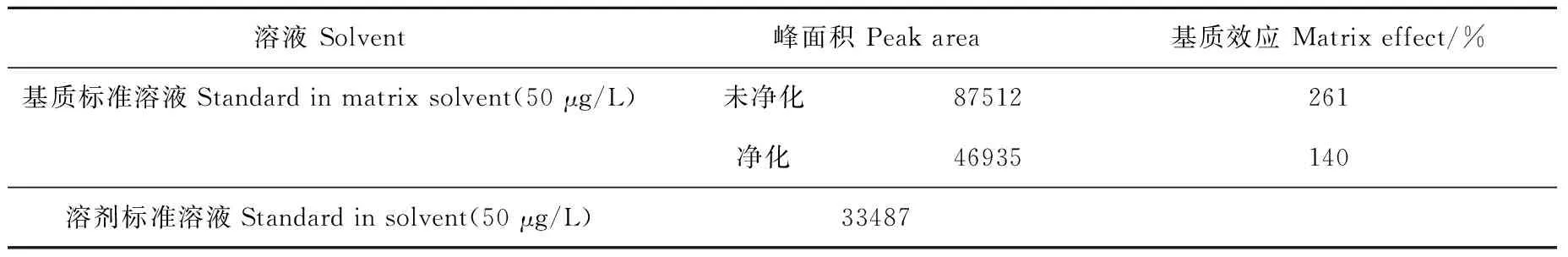
表4 样品净化前后的基质效应Table 4 Matrix effect of sample before and after purification
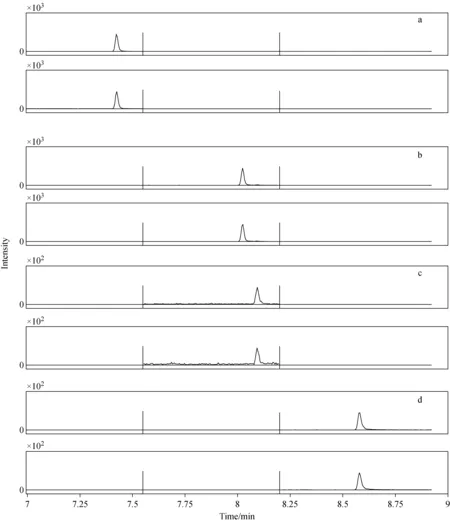
注:a.氟甲腈;b.氟虫腈硫醚;c.氟虫腈;d.氟虫腈砜图1 阴性鲜鸡蛋基质标准溶液(2.0 μg/L)的GC-MS/MS图Fig.1 GC-MS/MS spectrum of fipronil and its metabolites in negative chicken egg extraction solution (2.0 μg/L)
2.3 方法的线性范围、标准曲线和定量限
以标准品的峰面积(y)为纵坐标,质量浓度(x,μg/L)为横坐标,绘制标准曲线。在2~100 μg/L浓度范围内,氟虫腈及其代谢物具有良好的线性关系,线性相关系数R2≥0.99。以信噪比等于10确定方法的定量限为1.0 μg/kg。
2.4 方法的回收率和精密度
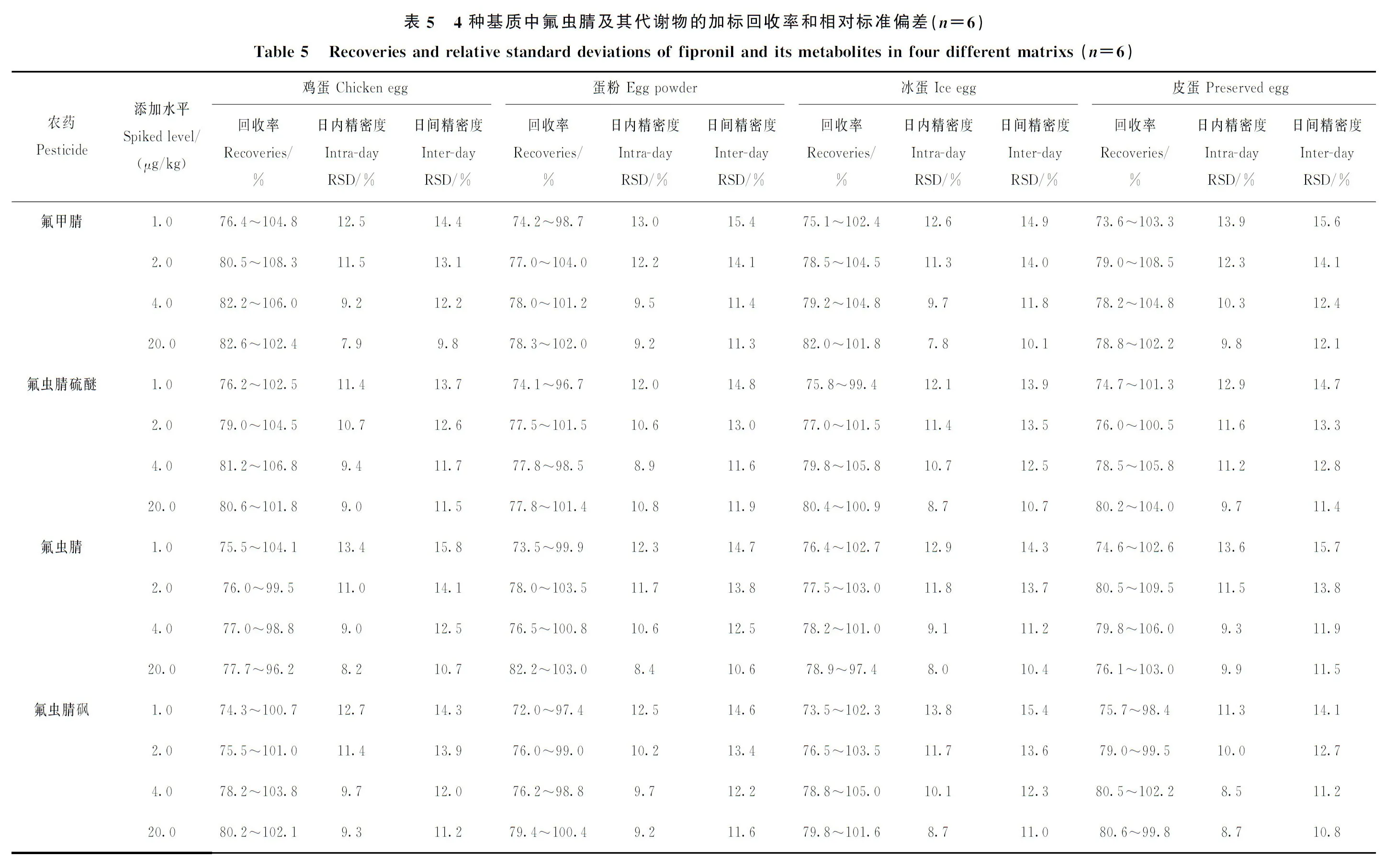
选择1.0、2.0、4.0、20.0 μg/kg四个加标水平对鲜鸡蛋、全蛋粉、冰蛋和皮蛋进行加标实验,回收率为72.0%~109.5%,精密度为7.8%~15.8%,具体数据列于表5。
2.5 实际样品检测
采用本研究建立的方法对市售的200批蛋和蛋制品进行检测,结果表明,氟虫腈及其代谢物均小于本方法的定量限。
3 结论
本研究采用改进的QuEChERS法提取和净化样品,建立了蛋和蛋制品中氟虫腈及其代谢物残留量的GC-MS/MS检测方法。该方法准确、灵敏、简便,回收率和精密度均能够满足蛋和蛋制品中氟虫腈及其3种代谢物的检测要求,可为蛋及蛋制品中氟虫腈及其代谢物残留量的测定提供方法参考。

