祛风生脉颗粒对大鼠缺血心肌微血管内皮细胞自噬及血管新生的影响
, ,雯晴,,
血管内皮细胞作为血管内的一层屏障,具有活跃的合成细胞因子和各种活性物质,参与机体多种生理功能调节的作用,内皮功能障碍已成为近年来冠心病心肌缺血的重点研究领域。有研究发现,自噬是细胞内长寿命蛋白和胞浆成分降解再循环利用的一种进化保守方式,作为细胞应对损伤的一种保护性反应,对维持细胞内环境稳定及正常生理功能有重要作用[1]。本课题组前期研究发现,微血管内皮细胞(CMECs)在缺血情况下有一定水平的自噬发生,细胞凋亡增加;应用自噬促进剂西罗莫司干预后增强缺血CMECs自噬,减少凋亡;自噬抑制剂3-MA抑制缺血CMECs自噬,进一步增加凋亡。自噬水平变化影响缺血CMECs的结构和功能,推测这种变化会进一步影响缺血心肌的血管生成,中医药能促进缺血心肌血管生成,但基于细胞自噬探讨中药调节血管新生的干预效应鲜见报道。本课题组在前期研究基础上,观察祛风生脉颗粒对大鼠缺血CMECs自噬及血管新生的影响,以明确其干预效应,现报道如下。
1 材料与方法
1.1 实验动物 选用SPF级6周龄雄性SD大鼠,体重(220~280)g,40只,由山东鲁抗医药股份有限公司提供。所有大鼠均采用笼养,生存在明暗各12 h饲养环境中。
1.2 主要仪器 低温高速离心机(美国Thermo Scientific公司),透射电镜(日本JEOL公司),CO2培养箱(美国Heraeus公司),心电图机(北京福田电子医疗仪器有限公司),呼吸机(美国BIRD公司),BIO-RAD电泳仪(美国BIO-RAD公司),Axiovert 40C倒置相差显微镜(德国Zeiss公司),BIO-RAD半干转膜仪(美国BIO-RAD公司),LAS-4000型化学发光及荧光影像分析仪(日本FUJIFILM公司)。
1.3 药品与试剂 祛风生脉颗粒(北京康仁堂药业有限公司),DMEM高糖培养基(美国Gibco公司),胎牛血清(浙江天杭生物科技有限公司),PBS平衡液(上海碧云天生物技术有限公司),0.25%胰蛋白酶(北京Solarbio公司),Western-blot所用试剂(北京Solarbio公司)。
1.4 实验方法
1.4.1 动物灌胃及血清制备 选取雄性SD大鼠20只,随机分为4组,每组5只。祛风生脉颗粒高剂量组(Q-G组):3 g/(kg·d)灌胃;祛风生脉颗粒中剂量组(Q-Z组):2 g/(kg·d)灌胃;祛风生脉颗粒低剂量组(Q-D组):1 g/(kg·d)灌胃;空白血清组(KX组):等体积蒸馏水灌胃。每只大鼠每日上午灌胃1 次,每次4 mL,连续5 d。于第5天末次灌胃3 h 后打开腹腔,在大鼠腹主动脉插管,无菌取血,置无菌不抗凝管中,室温下静置(3~4)h,1 500 r/min离心20 min,吸上清液,无菌分离血清,同组血清混合,过滤后置于无菌试管中,分别制备成Q-G血清、Q-Z血清、Q-D血清和KX血清,于-20 ℃保存。
1.4.2 大鼠急性心肌梗死模型建立 选取雄性SD大鼠16只,参照本课题组前期动物实验方法[2],采用结扎法制作大鼠急性心肌梗死模型。记录心电图出现Q波、ST段抬高、T波高耸或倒置,证实结扎成功。术后存活24 h即为造模成功。
1.4.3 培养大鼠缺血/正常CMECs 选取造模成功的急性心肌梗死模型大鼠16只及正常SD大鼠4只,参照本课题组前期动物实验[2],采用组织块法分别培养大鼠缺血/正常CMECs。组织块周围有大量细胞生长,去除组织块,继续培养,3 d换液1次,直到细胞生长至近融合时进行传代,实验均选取二代细胞进行。
1.4.4 分组及药物干预 将成功培养的大鼠缺血CMECs随机分为4组:Q-G组、Q-Z组、Q-D组、MX组,并将正常大鼠CMECs作为正常组(ZC组),共5组细胞。Q-G组、Q-Z组和Q-D组分别给予相应浓度含药血清共孵育,MX组与ZC组给予KX血清孵育。
1.5 观察指标
1.5.1 透射电镜观察自噬小体 取各组处于对数生长期的细胞,倒置相差显微镜下观察细胞长满培养瓶底的80%,消化、离心,小心吸取上清液,向细胞团块中缓缓加入1.5 mL 3%戊二醛固定液进行固定,4 ℃保存,后进行双固定、脱水、浸透、包埋、切片,调试电镜,观察自噬小体以及细胞超微结构变化。
1.5.2 Western-blot分析LC3-Ⅱ/Ⅰ比值及P62蛋白表达 与上述分组一样,分别取5组生长至对数生长期的细胞,弃培养液,PBS洗涤后加入细胞裂解液,提取总蛋白,BCA法测定蛋白浓度[3],根据总上样量和各组样本蛋白浓度计算各组样本所需样本量。将样品液和预染蛋白标记分别上样,电泳分离蛋白,参照半干转膜仪说明组装滤纸凝胶纤维素夹层,转印蛋白,于5%脱脂奶粉溶液中室温孵育1 h,以封闭膜上的非特异结合,封闭过的膜加入合适浓度一抗,抗原抗体结合,4 ℃孵育过夜,加入HRP标记的二抗以结合一抗,室温孵育1 h,加入显色剂,膜与化学发光底物孵育,应用LAS-4000型化学发光及荧光影像分析仪曝光显影,图片扫描。应用Gel-Pro软件分析数字化图像上每个特异条带的灰度值。各组样本目的蛋白的灰度值除以内参的灰度值以校正误差,所得数值为各组样本目的蛋白的相对含量。
1.5.3 划痕法观察细胞迁移 当细胞生长至近80%融合时,将各组细胞分别消化接种于24孔板,每组设6个复孔,待细胞贴壁后用灭菌的10 μL枪头在24孔板底部中间位置划出一个“十”字形划痕空白区域,置5%CO2、37 ℃培养箱中继续培养,分别于划痕后0 h、24 h在倒置相差显微镜下观察并于划痕处拍照,观察划痕愈合能力,计数细胞迁移数。
1.5.4 倒置显微镜观察管腔结构形成 当细胞生长至近80%融合时,将各组细胞分别消化接种于5个6孔板,每组6个复孔,接种后48 h于倒置相差显微镜下观察细胞管腔结构形成情况,以细胞连接呈C形即算一个管腔。每孔取3处管腔密集的视野,在放大(100×)的视野计数管腔数。每组细胞随机获取6个图像,取平均值,计算管腔形成数。
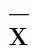
2 结 果
2.1 透射电镜观察各组细胞自噬小体及超微结构变化 电镜是自噬研究中不可或缺的重要手段,其他非形态学检测方法获得的结果,往往需要电镜进行验证,某些特定的自噬类型和细胞器等超微结构的辨别也往往需要借助电镜进行观察[4]。本实验在电镜下观察到ZC组细胞胞质均匀,细胞内空泡少,核染色质均匀分布,未见到自噬小体。与ZC组相比,MX组细胞质内见到大小不等的双层膜结构的自噬小体,线粒体形态肿胀变形,且有较多空泡,未观察到自噬溶酶体,提示自噬小体发生堆积,与溶酶体结合障碍,自噬流被抑制。各浓度梯度含药血清组自噬小体聚集趋于增多,同时还观察到数目较多的自噬溶酶体,自噬溶酶体中包含部分胞质成分以及尚未消化的细胞器。Q-G组自噬溶酶体数目最多,提示自噬活力增强,自噬流畅通。详见图1。

A为ZC组,B为MX组,C为Q-D组,D为Q-Z组,E为Q-G组。图中白色箭头所示为核仁,黑色实心箭头所示为自噬小体,黑色空心箭头所示为自噬溶酶体
2.2 各组细胞LC3-Ⅱ/Ⅰ比值及P62表达情况 Western blot 结果表明:与ZC组相比,MX组LC3-Ⅱ/Ⅰ比值及P62表达均升高(P<0.05);与MX组相比,Q-D组和Q-Z组LC3-Ⅱ/Ⅰ比值升高,P62表达降低(P<0.05);与MX组相比,Q-G组LC3-Ⅱ/Ⅰ比值明显升高(P<0.01),P62表达明显降低(P<0.01)。详见图2。

图2 各组细胞LC3-Ⅱ/Ⅰ比值及P62表达情况
2.3 各组细胞划痕愈合情况比较 倒置显微镜下(50×)观察各组细胞迁移情况。结果显示,划痕后0 h(见图3 A-E)5组细胞均可见明显划痕空白区;24 h后(见图3 F-J),ZC组(见图3 F)可见划痕两侧大量细胞迁移至空白区域,MX组(见图3 G)仅有少量细胞迁移至空白区域,与ZC组比较,细胞迁移数明显较少(P<0.05); Q-D组和Q-Z组(见图3 H、I)划痕空白区可见大量迁移的细胞,与MX组比较,细胞迁移数增多(P<0.05);Q-G组(见图3 J),划痕区域可见迁移的细胞铺满接近空白区域的50%,迁移细胞数较MX组明显增多(P<0.01)。
2.4 各组细胞管腔结构形成情况比较 倒置显微镜下(100×)观察各组细胞管腔样结构形成情况。结果显示,接种后48 h,ZC组(见图4 A)可见较多数目的C形及管腔样结构形成;与ZC组比较,MX组(见图4 B)仅可见少量C形结构,成管数减少(P<0.05);与MX组比较,Q-D组和Q-Z组(见图4 C、D)管腔样结构数目逐渐增多(P<0.05),与MX组比较,Q-G组(见图4 E)可见C形结构明显增多(P<0.01),并且能够见到较多的相对较完整的管腔结构。
3 讨 论
自噬是目前生物医学领域研究的热点之一,广泛参与各种生理和病理过程。既往对自噬的研究多以自噬体的多少评价自噬水平的强弱,新近发现自噬体的增加并不能从本质上反映自噬的水平,仅仅能够反映自噬的诱导,或者自噬体清除的抑制。因此,如何准确客观地评价自噬水平显得尤为重要。自噬是一个高度动态、多步骤的生物过程,大致可以分为4个部分:自噬膜、自噬体、自噬内涵体及自噬溶酶体,其中自噬体与内涵体结合形成自噬内涵体,自噬内涵体或自噬体与溶酶体结合形成自噬溶酶体[5-7]。现有的大部分文献都是通过检测自噬体的数量来评价自噬水平,基于上述流程发现通过电镜等手段检测到的自噬体的积累,既可以反映自噬的诱导,也可以反映自噬体的消耗减少[8-11],例如,溶酶体低效率的融合,影响到整个底物运输过程,会抑制自噬体向自噬溶酶体的成熟转化,当然自噬底物降解速率的减慢也会导致整个自噬流程的减弱[12-13],从而出现自噬体的蓄积。如何正确评价自噬水平就需要区分通常情况下自噬体短暂的蓄积是因为诱导导致的,还是自噬完成的效率低下导致的。既要静态检测自噬体,也需要动态监测自噬底物来证实底物到达了溶酶体,并且在合适的时间被降解。近年来有学者认为通过电镜等形态学手段辨别自噬体与自噬溶酶体形成情况,结合Western blot检测P62蛋白表达及LC3-Ⅱ/Ⅰ比值,能够较全面地反映整个自噬流的过程,客观体现自噬水平的强弱。一般情况下,P62蛋白水平的高低与自噬的活性成反比,P62 的增加提示自噬/溶酶体降解途径被抑制[14]。本研究结果显示,电镜观察发现MX组细胞存在自噬小体,表明缺血CMECs有一定水平的自噬,但未观察到自噬溶酶体,为了进一步明确缺血CMECs自噬水平,运用Western blot 检测了LC3-Ⅱ/Ⅰ比值及P62蛋白表达,发现MX组LC3-Ⅱ/Ⅰ比值及P62表达均升高,表明MX组自噬小体发生堆积,与溶酶体结合障碍,自噬流被抑制。加入不同浓度梯度的祛风生脉颗粒含药血清干预后,电镜形态学观察发现细胞内除自噬小体外,还存在较多自噬溶酶体,结合Western blot检测结果LC3-Ⅱ/Ⅰ比值升高,P62表达降低,表明各含药血清组干预后增强了缺血CMECs自噬水平,整个自噬流畅通。

A为ZC组,B为MX组,C为Q-D组,D为Q-Z组,E为Q-G组,F为ZC组,G为MX组,H为Q-D组,I为Q-Z组,J为Q-G组
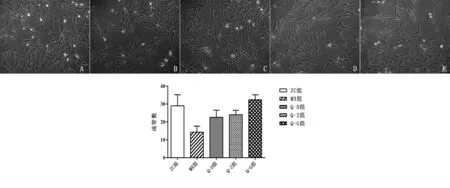
A为ZC组,B为MX组,C为Q-D组,D为Q-Z组,E为Q-G组
图4各组细胞管腔形成情况比较(100×)
本研究观察了缺血CMECs加入不同浓度梯度的祛风生脉颗粒含药血清干预后,各组细胞迁移及管腔结构形成的差异。发现缺血CMECs无论是迁移还是管腔形成均较正常CMECs减少,表明缺血CMECs血管新生的关键环节均受到抑制。祛风生脉颗粒干预后,细胞迁移数及管腔形成数均明显增加,而且在高剂量组可以见到更加完整的管腔样结构,血管生成更加成熟,提示祛风生脉颗粒促进血管新生的作用与药物剂量成正相关,分析其机制可能与增强缺血CMECs自噬流有关。
综上所述,血管内皮细胞是血管生成的靶细胞,缺血导致CMECs损伤在一定程度上影响了血管的新生以适应缺血的变化,过去的研究多集中于促血管生成方面。新近研究发现,自噬是细胞应对损伤的一种保护性反应,本研究以细胞自噬在血管内皮缺血损伤中的作用为切入点,以缺血CMECs为研究对象,明确了自噬在缺血CMECs血管新生中的作用,基于细胞自噬探讨了祛风生脉颗粒调节缺血心肌血管新生的干预效用,为中医药与细胞自噬研究提供了新的思路与方法。

