Wnt5a在炎症微环境下的牙周膜干细胞中的作用研究*
李影 刘娜 张维 顾斌
牙周炎是发生于牙周支持组织的慢性破坏性疾病。全国第三次流行病调查结果显示80%人口均患有牙周炎[1]。牙周炎的现有治疗手段主要是牙周基础治疗配合局部抗炎药物的使用,并不能够有效的治愈牙周炎。PDLSCs是从牙根分离出的多向分化能力的干细胞,可以修复牙周组织的破坏及损伤,但是在慢性炎症微环境下,PDLSCs的成骨分化能力及修复牙周组织能力减弱。牙周组织破坏的机制是怎样的呢?
金岩课题组发现TNFα通过激动Wnt通路来抑制PDLSCs的成骨能力,DKK-1抑制Wnt通路后可部分恢复PDLSCs的成骨能力。而骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMMSCs)通过激活Wnt3a来增加成骨能力[2]。本课题组前期研究表明,在干细胞增殖及成骨分化过程中经典Wnt/β-catenin信号通路发挥关键作用,过表达β-catenin可增强PDLSCs的增殖能力,抑制PDLSCs的成骨分化能力[3]。后又对炎症微环境下的PDLSCs成骨分化机制进行探究,结果显示在慢性炎症微环境中非经典Wnt信号通路参与PDLSCs的成骨分化,Wnt/Ca2+通路中CaMKII、NLK蛋白与干细胞成骨分化正相关[4]。徐雅丽等对门诊拔除的25颗慢性根尖周炎患牙研究表明,与对照组相比,慢性根尖周炎中根尖周病变组织检测出Wnt5a量相对较高。并且表达的高低与根尖周病变范围的大小有相关性。推测Wnt5a在慢性根尖周炎的发生、发展中起着一定作用[5]。那么在慢性牙周炎中,Wnt5a是否也起着一定的作用呢。本研究将探究在慢性炎症微环境下,Wnt5a在PDLSCs中的作用及其机制。
1.材料与方法
1.1 材料 α-MEM培养基,胎牛血清(FBS)(Gibco BRL);PBS、loading buffer、彩虹 180 广谱蛋白marker、甘氨酸电泳缓冲液、电泳转移缓冲液、5%BSA封闭液、ECL超敏发光液(Solarbio);0.25%胰蛋白酶-EDTA(Sigma,St Louis,MO,美国);EDTA;青链霉素(Gibco BRL);实时定量PCR仪(Applied Biosystems 7500,美国 Life Technologies公司);RNA抽提试剂盒及逆转录试剂盒(Takara,日本);4%组织细胞固定液(Solarbio);RIPA(Invitrogen);引物(华大基因);Wnt5a抗体,羊抗兔免疫荧光二抗(Abcam);丙烯酰胺、四甲基乙二胺(TEMED)、过硫酸铵(AP)、Bis-Tris、十二烷基硫酸钠盐(SDS)(Sigma)。
1.2 PDLSCs体外分离培养 从口腔颌面外科门诊获取患者的健康离体牙8颗,分离培养获得PDLSCs,培养及鉴定遵循本课题组前期实验步骤[6]。在超净工作台内将拔除后的牙齿经0.01mol/L PBS冲洗5~7次后,自牙冠至牙根方向单向刮取牙根中下1/3部分的牙周膜,修剪组织块为1mm3大小,Ⅰ型胶原酶消化15min后,离心管内的组织离心800r/min。弃上清后重悬并放置在6孔板中(含15%FBS、100μmol/L抗坏血酸、0.292mg/mL谷氨酰胺、100单位/mL青霉素/链霉素的α-MEM培养基)。在37℃、5%CO2饱和湿度条件下培养5~8d,直至有细胞从组织块边缘爬出。细胞生长达80%汇合时用胰酶/EDTA(0.25/0.1,pH=6.4)消化传代,标记为第一代。采用有限稀释法克隆化培养分离人正常组织来源的牙周膜干细胞,取第3~4代细胞进行实验。
1.3 正常及炎症因子组PDLSCs克隆形成 正常及炎症因子组PDLSCs消化计数,2000个细胞悬浮于普通培养液接种于直径10cm的培养皿,炎症因子组用含10ng/ml TNFα的普通培养液持续刺激,3~4d换液,共培养14d。PBS冲洗两遍后,4%组织细胞固定液固定30min,采用吉姆萨染色试剂盒进行染色30min,后洗去染色液,拍照。
1.4 qPCR检测正常及炎症因子组PDLSCs炎症因子基因表达水平 将PDLSCs消化计数,重悬至1×105个/ml,六孔板每孔加入500ul,补液至2.0ml。待细胞密度至80%,炎症因子组加入10ng/ml TNFα的培养液刺激24h,用Trizol分别提取各组RNA,测浓度后反转录为cDNA,采用Sybr Green试剂盒进行荧光定量PCR检测,目的基因及管家基因在不同的反应管中进行扩增,反应体系均为20μl。引物序列:GAPDH,上游引物:5′-TCTGACGACTCTGCTTCACG-3′,下游引物:5′-TTCAGGGCATGTGTGATGCT-3′;TNFα,上游引物:CACCACTTCGAAACCTGGGA,下游引物:TGTAGGCCCCAGTGAGTTCT;IL-1β,上游引物:ACCAAACCTCTTCGAGGCAC,下游引物:CGAGCTCAGGTACTTCTGCC。反应条件:95℃变性20min,95℃30s,60℃1min,40个循环。采用实时荧光定量PCR仪监测记录数据,结果根据标准曲线由软件自动计算后得出。验证该方法的重复性和扩增效率。本实验重复3次。
1.5 qPCR检测正常及炎症因子组PDLSCs成骨基因表达水平 将PDLSCs消化计数,重悬至1×105个/ml,六孔板每孔加入500ul,补液至2.0ml。待细胞密度达70%-80%左右时,换成骨诱导液,3天换液,共诱导7天,后Trizol提取各组RNA,具体操作步骤同前。引物序列:Runx2,上游引物:5′-CCCGTGGCCTTCAAGGT-3′,下游引物: 5′-CGTTACCCGCCATGACAGTA-3′;ALP,上游引物:5′-ATGTCAACCGAAACGCCTCAG-3′,下游引物:5′-ATGGCGGAGTCGAACATGGCA-3′。反应条件同前。
1.6 qPCR及Western Blot检测正常及炎症因子组成骨诱导前后PDLSCs Wnt5a基因及蛋白表达水平 采用qPCR检测Wnt5a mRNA表达,引物序列:上游引物:5′-TGTTGCTTTCCCGCTTTTCG-3′,下游引物:5′-CCTCTCGGCAGAGGATCAAC-3′。具体条件及步骤同前。将正常组及炎症因子组成骨诱导前后PDLSCs使用RIPA蛋白裂解液提取细胞总蛋白,调整至相同浓度,制备蛋白样品。采用Western Blot检测Wnt5a的蛋白表达水平:配置10%的分离胶、6%的浓缩胶,依据蛋白定量结果进行蛋白上样,电压为80V,电泳20min待溴酚蓝进入分离胶后调整电压至120V,电泳60min。随后将凝胶中的蛋白在转移电泳槽(200mA,2h)中转至聚偏氟乙烯(polyvinylidenefluorid,PVDF)膜。用5%BSA封闭液对PVDF膜封2h,PVDF膜封闭一抗Wnt5a(1∶1000)稀释,以β-肌动蛋白为内参,4℃过夜。次日取出封有一抗的PVDF膜,复温1h后TBST洗膜,每次5min,共3次。加入相应浓度的二抗,室温条件下封闭2h。TBST洗脱二抗,每次10min,共3次。漂洗膜后加入ECL超敏试剂盒显色,蛋白凝胶成像系统照相观察。
1.7 统计学处理 采用SPSS22.0统计软件进行数据分析,数据以均数±标准差表示。两组间比较采用独立样本t检验;进行多组间比较时,P值进行Bonferroni校正。P<0.05为差异有统计学意义。
2.结果
2.1 正常组及炎症因子组PDLSCs克隆形成率正常组及炎症因子组PDLSCs接种于大皿,培养14d后镜下观均有明显的克隆形成,克隆中心细胞密集(见图1)。染色后克隆集落为蓝色(见图1),正常组克隆形成率为13.91%,炎症因子组为14.89%,无明显统计学差异。

图1 正常组及炎症因子组PDLSCs接种14d后克隆形成图片
2.2 正常组及炎症因子组PDLSCs炎症因子表达水平 正常组及炎症因子组PDLSCs在六孔板接种7d后,提取RNA,并进行qPCR检测TNFα和IL-1β的mRNA表达水平。炎症因子组TNFα mRNA表达水平是正常组的1.67倍(*P<0.05),炎症因子组IL-1β mRNA表达水平是正常组的1.46倍(*P<0.05)。炎症微环境下,PDLSCs的炎症因子表达水平增加。
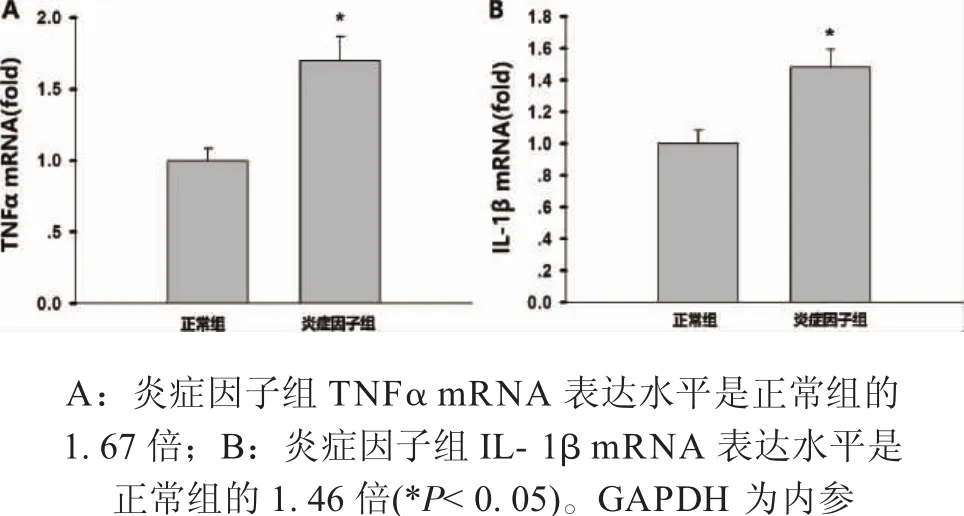
图2 正常组及炎症因子组PDLSCs炎症因子表达水平
2.3 正常组及炎症因子组PDLSCs成骨基因表达水平 正常及炎症因子组PDLSCs接种于六孔板,进行14d的成骨诱导后,进行ALP染色。正常组成骨能力较炎症因子组高,成骨诱导后两组镜下观(图3B),均可见成钙结节,正常组较炎症因子组结节数量多,说明炎症微环境下PDLSCs成骨能力较正常组降低。qPCR结果示,常规培养条件下,炎症因子组Runx2、ALP mRNA表达水平与正常组无显著性差异,成骨诱导后两组成骨基因表达水平均上升,正常组分别是炎症因子组的1.6倍(*P< 0.05)、1.447 倍(*P< 0.05)。(图 3C、D)说明在炎症微环境的作用下,PDLSCs成骨能力下降。
2.4 正常组及炎症因子组PDLSCs成骨诱导前后Wnt5a的表达水平 qPCR结果显示,常规培养条件下,炎症因子组Wnt5a mRNA表达水平是正常组1.88倍(*P<0.05),成骨诱导后正常组及炎症因子组Wnt5a mRNA表达水平分别为常规培养条件下的 1.27倍(*P< 0.05)、1.33倍(*P< 0.05);(图4A)Western Blot结果示,炎症因子组Wnt5a蛋白表达水平增加,成骨诱导后两组Wnt5a蛋白表达水平均增加,炎症因子组高于正常组。(图4B)Wnt5a蛋白表达量灰度分析结果示,正常组diff、炎症因子组undiff、炎症因子组diff分别为正常组undiff的1.2709倍、1.8246倍、2.2176倍。(图4C)炎症微环境下Wnt5a的表达水平增加,且成骨诱导后Wnt5a的表达水平也增加,说明Wnt5a可能在PDLSCs炎症发生发展及成骨破骨平衡过程中发挥重要的作用。
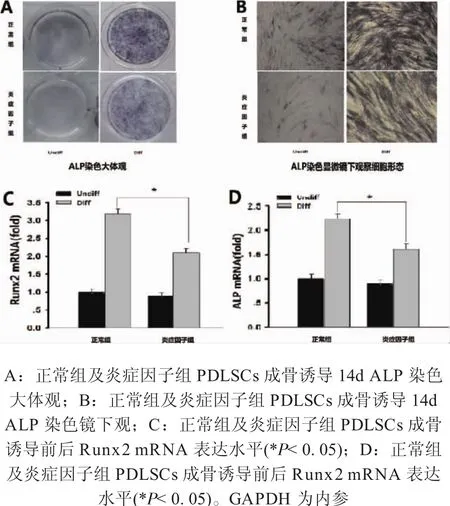
图3 正常组及炎症因子组PDLSCs ALP染色大体观、镜下观(×200)及成骨基因表达水平
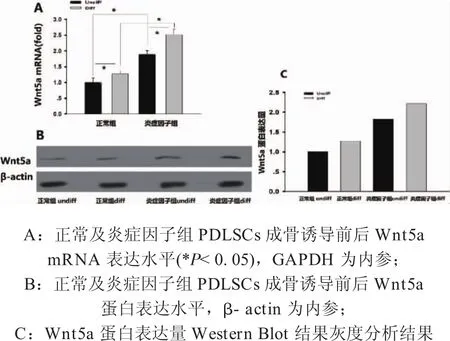
图4 正常及炎症因子组PDLSCs成骨诱导前后Wnt5a mRNA及蛋白表达水平
3.讨论
干细胞具有多向分化能力、低免疫原性等优点,在组织工程中具有广阔的应用前景。Kawaguchi H等研究发现在III级犬类实验缺陷中,自体骨髓间充质干细胞移植可以促进到20%的牙骨质和牙槽骨再生[7]。但临床应用中,骨髓间充质干细胞取材存在一定的困难。PDLSCs具有干细胞的共有特性,且取材方便,是组织工程研究的热点。有研究者采用PDLSCs复合纤维膜片技术用于牙再植,取得了较好的临床效果[8]。慢性炎症微环境下,PDLSCs增殖能力增强,但是成骨分化能力较弱,组织修复能力减弱[3]。Wnt通路分为经典通路Wnt通路和非经典Wnt/Ca2+通路,Wnt/β-catenin(β-连环蛋白)经典通路与TCF/LEF家族形成复合体,主要调控干细胞增殖[9]。而非经典Wnt/Ca2+通路与干细胞的成骨分化正相关。X Chen课题组研究表明在炎症微环境下NFkB通过与β-catenin的竞争来调节PDLSCs的成骨分化[10]。
我们的结果表明,炎症微环境下PDLSCs炎症因子TNFα、IL-1β的表达水平是增加的。大量研究发现,慢性炎症牙周组织中存在的大量的促炎性细胞因子(TNFα、IL-1β等),参与牙周组织免疫反应及破骨细胞分化,TNFα和IFNγ可通过Fas-FasL途径调控间充质干细胞介导的组织再生[11]。成骨诱导后两组成骨基因Runx2、ALP mRNA的表达水平均增加,但是炎症因子组较正常组较低,说明慢性炎症微环境下,由于炎症因子的存在干扰了牙周组织的成骨破骨平衡,从而导致牙槽骨的破坏与吸收。Wnt5a是巨噬细胞分泌的一种新型的炎性介质,通过自分泌或者旁分泌的方式参与炎症反应。在类风湿性关节炎的体内均检测到wnt5a呈高表达状态[12,13]。Blumenthal等发现 Wnt5a 基因在微生物或其组分刺激下表达持续上调,且Wnt5a的表达上调需要Toll-样受体(TLR)及核因子 -κβ(NF-κβ)的活化[14],表明 Wnt5a 及其受体FZD5共同参与了机体的抗炎症反应。sFRP5和Wnt5a在牙周健康和疾病中表达之间的新型互惠关系,使Wnt5a/sFRP5比例具有作为牙周炎生物标志物的可能性。
在牙周炎中Wnt5a扮演怎样的角色呢?有研究者对20例慢性牙周炎患者牙龈取材,进行qPCR及Western Blot检测,结果示慢性牙周炎患者的炎症性牙龈组织中Wnt5a的表达水平显著高于正常牙龈组织(P<0.05),附着丧失的程度与牙周炎患者牙龈组织中Wnt5a的表达呈高度正相关[15]。2008年Pereira C等研究表明Wnt5a/CaMKⅡ通路参与了炎症反应,并且提出Wnt5a可能调控了该通路[16]。
我们的qPCR结果示,常规培养条件下,炎症因子组Wnt5a mRNA表达水平是正常组1.88倍(*P<0.05),成骨诱导后正常组及炎症因子组Wnt5a mRNA表达水平分别为常规培养条件下的1.27倍(*P< 0.05)、1.33倍(*P< 0.05);Western Blot结果示,Wnt5a蛋白表达量Western Blot结果灰度分析结果,正常组diff、炎症因子组undiff、炎症因子组diff分别为正常组undiff的1.2709倍、1.8246倍、2.2176倍。炎症因子组Wnt5a蛋白表达水平增加,成骨诱导后两组Wnt5a蛋白表达水平均增加,炎症因子组高于正常组。而Wnt5a与破骨细胞的形成息息相关,为何在成骨诱导后表达增加?我们推测可能是因为在成骨诱导的条件下,成骨增加,相应的破骨也增加。炎症微环境下Wnt5a的表达水平增加,且成骨诱导后Wnt5a的表达水平也增加,说明Wnt5a可能在PDLSCs炎症发生发展及成骨分化过程中均发挥重要的作用。有学者研究结果表明,活化的NLK可以磷酸化TCF,阻止β-catenin-TCF复合体与DNA结合,并且Wnt5a和Rfz-2均可刺激Ca2+释放并活化CaMKII[17,18]。非经典Wnt-5a/Ca2+通路通过激活TAK1-NLK MAPK级联,拮抗典型Wnt/-catenin信号。Wnt5a作为一个重要的前炎症因子,能够在不同的细胞类型中产生炎症效应[19-20]。
Wnt5a在牙周炎发生发展过程中的作用及具体机制,我们将进行进一步探究。

