肉鸡屠宰加工生产链中弯曲菌污染状况及耐药性分析
, ,, , ,,
弯曲菌(Campylobacter)是一种重要的人兽共患病原菌,能够引起人细菌性腹泻、急性肠炎以及吉兰巴雷综合征,同时也能引起牛和绵羊流产。导致人致病的弯曲菌主要有空肠弯曲菌(Campylobacterjejuni,C.jejuni)和结肠弯曲菌(Campylobactercoli,C.coli)[1-2]。弯曲菌可通过食物链传播给人,禽肉是感染人的主要来源。
弯曲菌是畜禽动物肠道的常在菌。近年来,在畜禽养殖过程中,抗生素的广泛应用使弯曲菌产生了耐药性,随着时间的推移,耐药性不断增强,并且耐药谱不断扩增。耐药弯曲菌的出现有可能通过食物链转移到人体,从而对人类的健康和公共卫生造成威胁。为了控制细菌耐药性,我国农业部制定了《全国遏制动物源性细菌耐药行动计划(2017-2020)》,弯曲菌耐药监测也纳入行动计划,在全国范围内进一步加强动物源弯曲菌耐药性监测。鉴于此,本研究对江苏某大型肉鸡屠宰加工厂不同环节弯曲菌的分离、鉴定及其耐药性进行分析,为我国动物源性弯曲菌耐药性现状的了解和评估提供可靠的数据。
1 材料与方法
1.1 材 料
1.1.1标准菌株 空肠弯曲菌标准菌株(NCTC-11168)、结肠弯曲菌标准菌株(ATCC33559)和大肠埃希氏菌(ATCC25922)由本实验室保存。
1.1.2培养基 Cary-Blair运送培养基、CCDA培养基、MH培养基、BHI培养基均购自于英国OXOID公司;弯曲菌分离用抗生素三甲氧苄氨嘧啶、头孢哌酮、多粘菌素B、两性霉素B、利福平和放线菌酮等购自日本WAKO公司;脱纤维绵羊血购买于青岛海博生物技术有限公司;厌氧罐购自日本MGC公司;混合气(5% O2、10% CO2和85% N2)购于南京特种气体厂有限公司。
1.1.4药敏纸片 共选择6大类抗生素中的14种常规药敏纸片,包括青霉素类的氨苄西林(Ampicillin,AMP,10 μg)、阿莫西林(Amoxicillin,AML,10 μg);第三代头孢中的头孢噻肟(Cefotaxime,CTX,30 μg)和头孢曲松(Ceftriaxone,CRO,30 μg);氨基糖苷类的链霉素(Streptomycin, S,10 μg)、庆大霉素(Gentamicin,CN,10 μg)、阿米卡星(Amikacin,AK,30 μg)、妥布霉素(Tobramycin,TOB,10 μg)和卡那霉素(Kanamycin,K,30 μg);喹诺酮类的萘啶酸(Nalidixic acid,N,30 μg)、环丙沙星(Ciprofloxacin,CIP,5 μg)和氧氟沙星(Ofloxacin,LEV,5 μg);大环内酯类的红霉素(Erythromycin,E,15 μg)以及四环素类的四环素(Tetracycline,TE,30 μg);以上药敏纸片均购买于英国OXOID公司。
1.2 方 法
1.2.1样品采集 根据肉鸡屠宰流程随机进行采样,主要包括:屠宰前泄殖腔棉拭子、脱毛后的胴体、开膛后的胴体、消毒预冷后胴体、成品鸡、工作台面及工人手拭子样品。泄殖腔棉拭子采用无菌棉签擦拭法,棉拭子采集后存放于Cary-Blair运送培养基中;(胴)体、工作台面及工人的手使用含PBS的灭菌棉球均匀擦拭,将擦拭好的棉球置于采样袋内。所有样品均低温保存运回实验室进行检测。
1.2.2样品处理 样品处理方法参照文献[3]。其具体的步骤为:泄殖腔样品的处理,从运送培养基中取出棉拭,置于含1 mL灭菌 PBS的指形管中,充分浸透,胴体擦拭样品挤出PBS溶液;分别将浸液和挤出的PBS溶液经适当倍比稀释后取100 μL涂布CCDA平板;微需氧条件42 ℃培养36 h,同时设阴性和阳性对照。
1.2.3菌株分离纯化 细菌的分离鉴定参照文献[3]并略作修改。其步骤为:挑取CCDA平板上的可疑菌落接种于MH血平板42 ℃微需氧培养36 h,重复2~3次,直至得到单一纯培养菌落。挑取单菌落加入20 μL超纯水中混匀,煮沸15 min,取出立即置于冰上,8 000 r/min离心5 min,取1 μL上清进行PCR检测,引物序列见表1。鉴定阳性的菌落以密集划线的方式接种于MH血平板上培养36 h后,用适量的含有20%甘油的BHI培养基洗脱菌苔,置于-80 ℃冷冻保存。
1.2.4药敏试验 采用CLSI推荐的纸片扩散法(Kirby-Bauer,K-B)进行抗生素药物敏感性试验[4],选择6大类14种抗生素,14种药敏纸片名称及判断标准见表2。结果按照CLSI(2015)标准进行结果判断。
1.2.5耐药基因检测 对分离得到的菌株分别扩增I型整合子携带情况;检测分离得到的弯曲菌tet(O)基因携带情况以及氨基糖苷类耐药基因簇aadE-sat4-aphA-3的分布,所用引物序列如表1。PCR反应体系:ExTaqpremix 12.5 μL,上下游引物(10 μmol/L)各1 μL,模板DNA 1 μL,无菌去离子水9.5 μL。PCR反应条件为:95 ℃预变性1 min;95 ℃变性30 s,根据不同引物选择相应的退火温度,72 ℃延伸1 min,共30个循环;72 ℃延伸10 min。对耐氟喹诺酮类药物的弯曲菌进行gyrA相关区域扩增测序,PCR反应体系为:PrimeSTAR HS(Premix) 12.5 μL, 上下游引物(10 μmol/L)各1 μL,模板DNA 1 μL,无菌去离子水9.5 μL; PCR产物用1%琼脂糖凝胶电泳成像。选取PCR阳性样品送上海生工生物工程技术服务有限公司进行序列测定,测序结果在NCBI上进行BLAST分析。

表1 目的基因引物序列及片段长度Tab.1 Primer sequences of target gene and gene length
2 结 果
2.1肉鸡屠宰加工各环节中弯曲菌检出情况 共检测样品170份,检出弯曲菌124株,空肠弯曲菌16株,结肠弯曲菌108株,分离率为72.95%。肉鸡屠宰前其弯曲菌分离率为23.3%,鸡只经过电晕、放血、褪毛、掏出内脏等过程其污染率迅速上升,经过预冷消毒后,鸡胴体污染率有所下降,但到成品鸡其污染率又升高达到90%,具体结果见表2。
2.2弯曲菌分离株药敏试验结果 由表3药敏实验结果表明,弯曲菌分离株对链霉素、妥布霉素、卡那霉素、环丙沙星、氧氟沙星、萘啶酸、红霉素和四环素产生了很强的耐药性,耐药率100%;对氨基糖苷类的庆大霉素和阿米卡星较敏感;对青霉素的氨苄西林和阿莫西林也较敏感,其耐药率分别为11.36%和13.64%。弯曲菌耐药情况严重,多重耐药(耐3类及以上抗生素)率达100%,其优势耐药谱主要为CTX-CRO-cDA-K-NOR-S-AZM-CIP-TE-NA-E-LEV-ENR-TOB,占79.5%。活鸡泄殖腔、脱毛后胴体、开膛后胴体以及成品鸡各阶段的耐药谱型都比较单一,工人手和工作台面的耐药谱型相对比较复杂。从活鸡到成品鸡是同一批次同一来源,所以耐药谱型相对比较单一,而工人手和工作台面接触了不同批次的鸡,消毒不彻底就会相互污染,其耐药谱型相对比较多样。
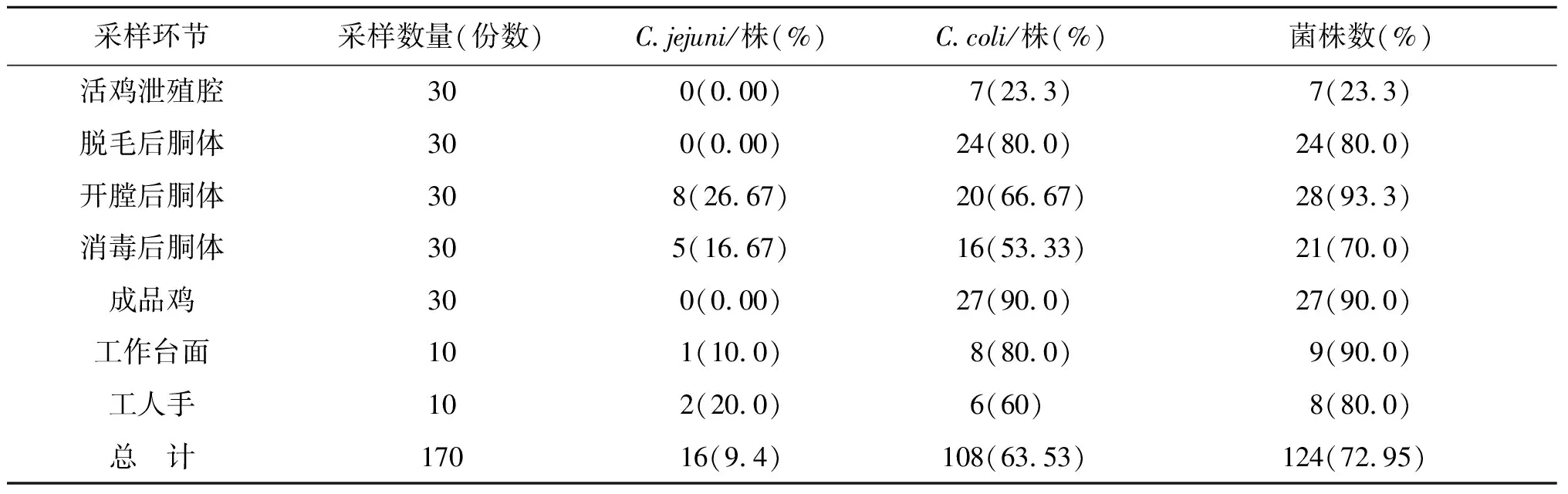
表2 肉鸡屠宰加工环节弯曲菌检出情况Tab.2 Isolation of Campylobacter strains from different section in slaughter and processing chain
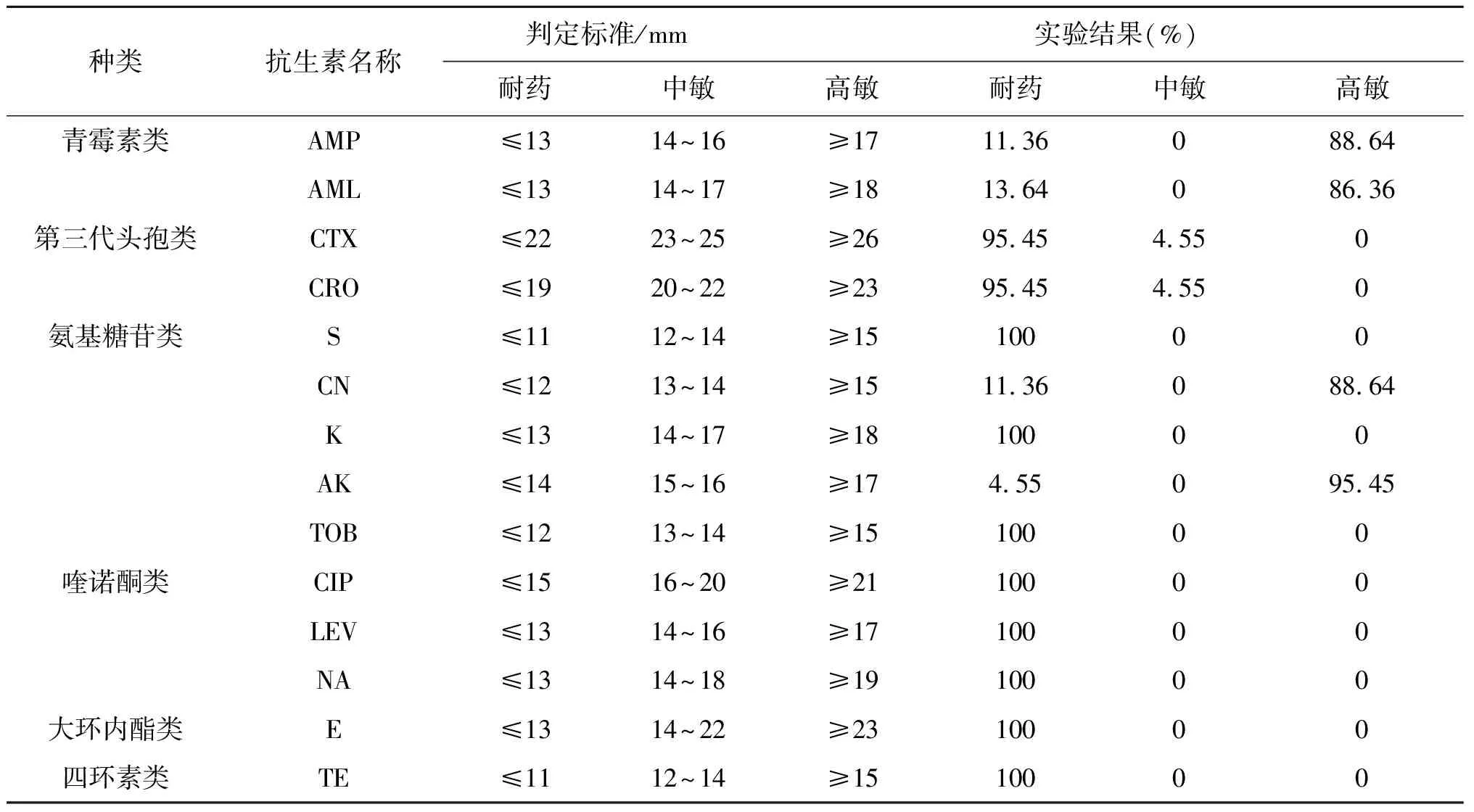
表3 弯曲菌分离株对抗生素的耐药性Tab.3 Results of antimicrobial resistance testing of Campylobacter isolates
2.3I类整合子的携带情况 对分离得到的124株弯曲菌进行I型整合子扩增,未扩增到目的条带,说明在分离得到的耐药菌中整合子介导耐药机制没有起主导作用。
2.4PCR检测弯曲菌分离株gyrA基因点突变结果 对124株弯曲菌gyrA基因耐药决定区进行序列分析发现,耐氟喹诺酮药物的菌株在第257位碱基均发生了C-T的突变,导致苏氨酸突变为异亮氨酸。
2.5四环素类耐药基因tet(O)基因检测结果 124株四环素表型耐药的弯曲菌分离株中,均检测出tet(O)基因,检出率为100%,PCR扩增结果见图1。对部分菌株PCR产物进行了测序确定为目的片段。
2.6aadE-sat4-aphA-3耐药基因簇检测结果 图2为弯曲菌的检测结果,aadE-sat4-aphA-3耐药基因簇PCR扩增片段为1 538 bp,对部分菌株PCR产物进行了测序,确定为目的片段。124株弯曲菌中aadE-sat4-aphA-3阳性菌株有112株,检出率为90.32%。
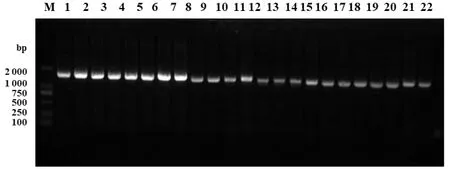
M:核酸分子量标准DL2000;泳道1-22:为弯曲杆菌分离株aadE-sat4-aphA-3耐药基因簇的PCR扩增结果图2 弯曲菌分离株aadE-sat4-aphA-3耐药基因簇PCR扩增结果Fig.2 PCR amplification of aadE-sat4-aphA-3 gene cluster in Campylobacter isolates
3 讨 论
由于弯曲菌能够在家禽肠道内大量定植,在屠宰的过程中如果肠道破裂很容易污染屠宰场地、设施和水从而污染禽肉产品[9-10]。对30多个国家调查表明,市场上出售的75%的活禽和80%的禽肉中含有弯曲菌,弯曲菌在鸡中已经广泛分布[11]。本研究从170份样品中共分离出124株弯曲菌,总分离率为72.95%。在屠宰前,肉鸡泄殖腔棉拭子分离率为23.3%,与张秀丽[12]报道活鸡泄殖腔的分离率相似,在屠宰过程中鸡胴体的平均检出率为83.33%,与焦扬等[13]报道的鸡胴体分离率88.97%接近。本试验结果表明肉鸡经过屠宰加工环节后,其胴体弯曲菌污染率高于屠宰前活鸡的检出率,表明肉鸡加工环节是弯曲菌发生交叉污染的主要原因,应加强家禽屠宰环节弯曲菌的监测与控制。
由于疾病治疗及抗生素类饲料添加剂的大量使用,使弯曲菌耐药性迅速传播,且其耐药性逐渐增强。食源性动物中弯曲菌的耐药性已经成为发达国家和发展中国家共有的主要公共卫生问题。国内外已有大量的研究论文报道弯曲菌的多重耐药现象[14-16]。Lim SK等[14]对从鸡的泄殖腔和胴体分离到的弯曲菌进行耐药性检测,结果表明:空肠弯曲菌和结肠弯曲菌对环丙沙星、萘啶酸都具有较高的耐药率。张艾煜等[17]对我国不同来源的弯曲菌进行了抗生素敏感性分析,结果显示我国菌株对喹诺酮类为接近95%的高耐药率。本研究分离的124株弯曲菌药敏试验结果显示:弯曲菌对链霉素、妥布霉素、卡那霉素、环丙沙星、氧氟沙星、萘啶酸、红霉素和四环素产生了很强的耐药性,耐药率100%;对庆大霉素、阿米卡星、氨苄西林和阿莫西林较敏感,结果显示本试验所分离弯曲菌的多重耐药情况相当普遍和严重。
整合子-基因盒(Integron gene cassette)系统可将耐药基因在同种甚至不同种菌株间水平转移,加速多重耐药菌株的产生,危害严重。本试验的124株多重耐药细菌中,未检出I型整合子,与Alessandra Piccirillo[18]的结果一致,远低于国内胡欣洁[19]报道的98.6%。喹诺酮类耐药决定区gyrA基因核苷酸C-257-T的点突变是导致弯曲菌对氟喹诺酮类药物产生耐药的主要原因之一[20],本研究对124株弯曲菌gyrA基因耐药决定区测序发现在257位碱基发生了C-T的突变,推测这是导致弯曲菌分离株对喹诺酮类耐药的主要原因。tet(O)基因编码的核糖体保护蛋白是弯曲菌对四环素耐药的主要机制之一[21]。124株弯曲菌tet(O)检出率为100%,与Qin(100%)等的结果相似[22]。氨基糖苷类耐药的基因簇—aadE-sat4-aphA-3能介导链霉素、卡那霉素和新霉素等耐药,但不能介导庆大霉素耐药,该基因簇的存在是耐药菌株在多重氨基糖苷类抗生素压力下的选择结果,因此,选择该基因监测对于耐药弯曲菌的监测具有重要意义。本研究对124株弯曲菌进行了aadE-sat4-aphA-3耐药基因簇的检测,其阳性率为90.32%,高于张艾煜的10.86%检出率[8],其原因可能是本研究鸡源分离株来源比较单一导致了比较高的检出率。
本研究分析了江苏省某肉鸡屠宰加工过程中不同环节弯曲菌的污染和耐药表型及耐药基因携带情况,结果显示,肉鸡屠宰加工过程中弯曲菌的污染较为严重,分离株耐药率较高且多重耐药现象严重。

