127株结核分枝杆菌基因分型及耐药相关研究
, ,,,,,
2017年发布的全球结核病报告显示,2016年新发现大约1 040万结核病例,印度、印度尼西亚、中国、菲律宾和巴基斯坦5个国家占56%[1]。利用结核分枝杆菌遗传标志物(具有遗传的稳定性和个体的多样性)对结核分枝杆菌临床分离株进行分型研究,证实菌株的基因多态性,以此了解结核病的流行病学特征、分析患者产生耐药的原因、推断病原演变情况等,对于防治结核病具有重要的意义[2-3]。基于PCR技术的MLVA方法,由于其特异性高、分辨率强、效果明显、操作简单方便和重复性好,美国疾病控制和预防中心推荐其为首选的结核杆菌基因分型方法[3]。因为在不同区域VNTR位点及位点组合有差异性,所以各个实验室都在尽力寻找适合当地的位点。本研究采用MLVA技术,选取15个VNTR位点对山西省的127株结核分枝杆菌进行基因分型及药敏试验,以初步了解山西长治及周边地区结核分枝杆菌分子流行病学特征及耐药性,为山西省预防和治疗结核病提供科学依据。
1 材料与方法
1.1菌株 127株结核分枝杆菌菌株分别分离自长治市、晋城市和临汾市的临床患者痰标本,其中长治106株,晋城20株,临汾1株。患者年龄16~90岁,平均44岁;男80例(63%),女47例(37%);农民75例(59.06%),学生14例(11.02%),其他38例(29.92%)。长治医学院附属和平医院微生物学实验室负责菌株的培养、鉴定和保存。菌株H37Rv作为参照标准(中国疾病预防控制中心提供)。
1.2主要仪器与试剂 MasterMix(Beijing TsingKe Biotech Co., Ltd)、DL l 000 DNA Marker(Takara)、GoldenView(Aidlab Biotechnologies Co., Ltd)、琼脂糖、PCR扩增仪、凝胶成像仪及BioNumerics 5.0 分析软件。
1.3基因分型 依据参考文献选取15个VNTR位点[2,4-7](表1)。
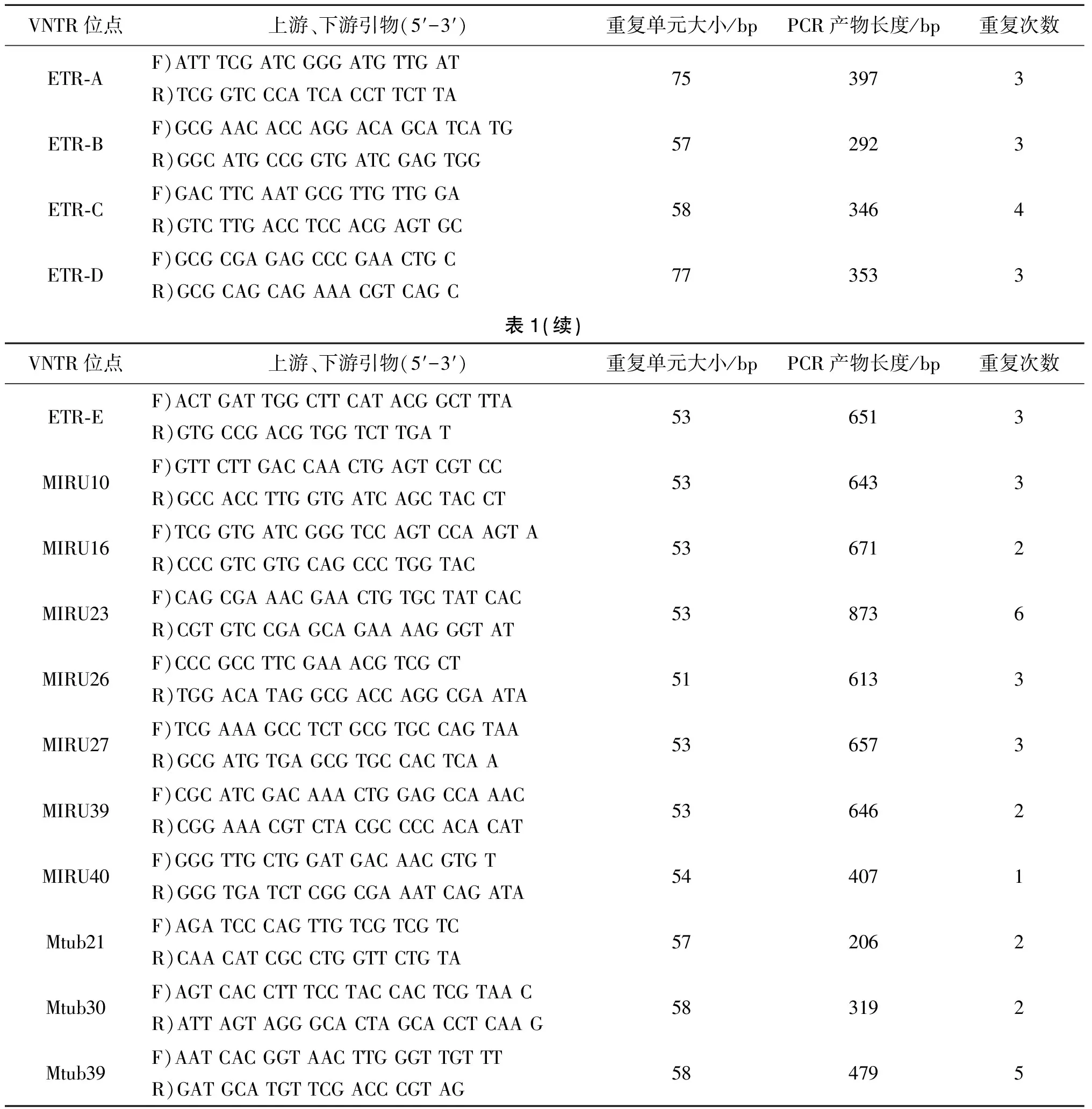
表1 15个位点的引物、H37Rv重复单元和扩增片段的长度及重复次数Tab.1 Primers of 15 locus and the size of repeat, the size of PCR product and the number of repeats of H37Rv strain
15个VNTR位点的引物依据参考文献合成。
DNA提取:收集适量经Lowenstein Jensen(LJ)培养基培养的菌体于400 μL蒸馏水悬菌,100 ℃金属浴灭活裂解30 min,14 000 r/min的速度离心10 min,-20 ℃保存上清液以备用。
PCR:混合物总体积为25 μL:DNA模板1 μL,上游引物1 μL,下游引物1 μL,2×TaqDNA酶13 μL,三蒸水9 μL。PCR反应条件:预变性94 ℃ 10 min,变性94 ℃ 1 min,退火56 ℃ 1 min,延伸72 ℃ 1 min,共35个循环,最后延伸72 ℃ 10 min。PCR产物在4 ℃保存。
琼脂糖凝胶电泳:取5 μL扩增产物在1%琼脂糖凝胶中电泳(含5 μL/100 mL Golden View),置于紫外凝胶成像仪下观察结果,与DNA marker进行比较,估测PCR扩增产物的相对分子质量。实验中以H37Rv作为阳性对照。
1.4药敏试验 对8种抗结核药物分别采用比例法进行药物敏感性试验。培养基中8种药物的终浓度分别为异烟肼(INH)0.2 μg/mL,利福平(RFP)40 μg/mL,乙胺丁醇(EMB)2 μg/mL,链霉素(SM)4.0 μg/mL,卡那霉素(KN)30 μg/mL,丙硫异烟胺(PTH)40 μg/mL,对氨基水杨酸(PAS)1.0 μg/mL,左氧氟沙星(LFX)4.0 μg/mL[5]。耐药标准:含药培养基与对照培养基的菌落数相比,小于l%为敏感,大于或者等于l%为耐药[5]。
1.5数据分析 每株菌株的PCR扩增条带均与H37Rv比较,确定每株菌株各个VNTR位点重复单元的重复次数,计算Hunter-Gaston指数(HGI)分析各位点的分辨能力。采用BioNumerics 5.0软件进行聚类分析,聚类方式用平均连锁聚类法(UPGMA),根据cluster-cutoff值差异进行基因分型。采用统计软件SPSS l7.0进行统计分析,运用χ2检验或Fisher确切概率法进行组间差异比较,P<0.05认为差异有统计学意义。
2 结 果
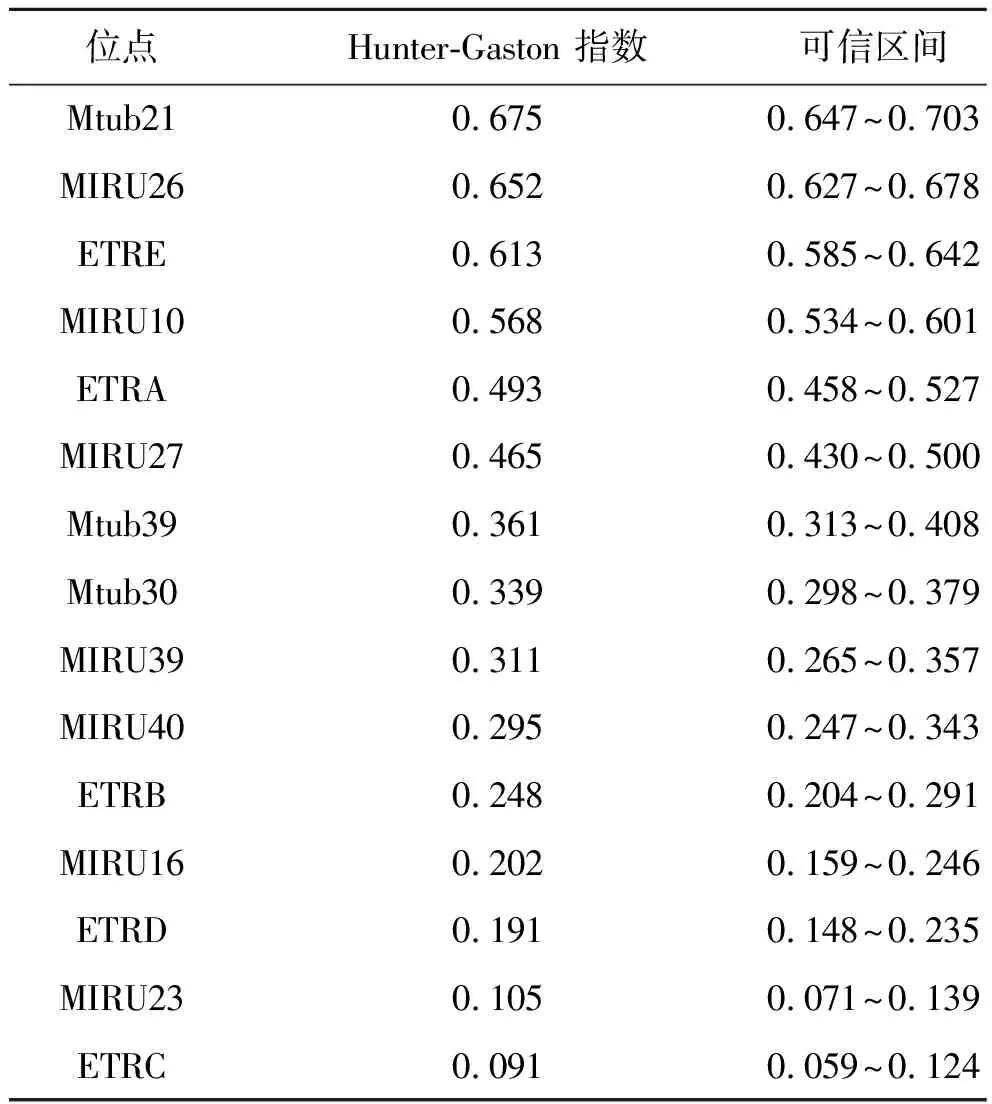
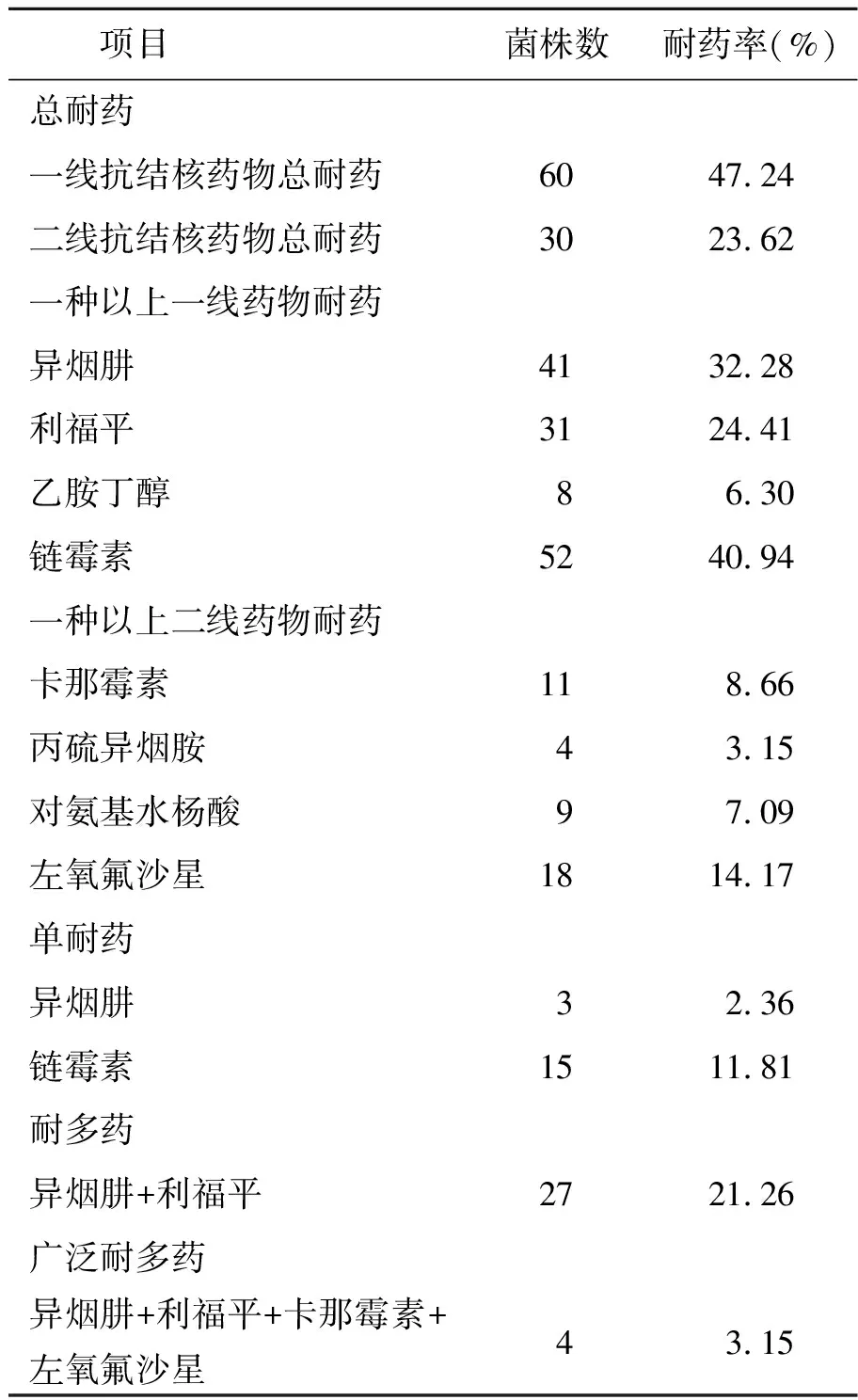
2.1基因多态性和聚类分析 运用MLVA方法对127株结核分枝杆菌进行基因分型,DNA指纹图谱显示不同菌株表现出明显的基因多态性。15个VNTR位点中,Mtub21、MIRU26 和ETRE位点多态性较高(HGI>0.6);MIRU10、 ETRA、MIRU27、Mtub39 、Mtub30和MIRU39位点呈中等程度的多态性(0.3 图1 127株菌株MLVA基因分型聚类分析Fig.1 Clustering analysis of 127 strains by MLVA 表2 15个VNTR位点的Hunter-Gaston指数Tab.2 Hunter-Gaston Index of 15 VNTR loci 注:1.Hunter-Gaston指数:分析VNTR位点重复单元多样性的指数(0.0≤HGI≤1.0);2.可信区间:多样性指数的95%可信区间。 2.2药敏试验 根据临床实验室标准化协会(CLSI)标准对127株结核分枝杆菌进行药物敏感性试验[8]。实验结果显示:127株菌株对一线和二线抗结核药物的总耐药率分别为47.24%和23.62%。一线抗结核药物的耐药率:链霉素(40.94%)最高,依次是异烟肼(32.28%)、利福平(24.41%),乙胺丁醇(6.30%)最低;二线抗结核药物的耐药率:左氧氟沙星(14.17%)最高,其次是卡那霉素(8.66%)、对氨基水杨酸(7.09%),丙硫异烟胺(3.15%)最低。链霉素的单耐药率最高(11.81%),其次是异烟肼(2.36%),未发现利福平和乙胺丁醇的单耐药菌株;耐多药率为21.26%(27/127),其中有5株(3.94%)菌株对四种药物同时耐药;广泛耐多药率为3.15%(表3)。 2.3基因型与耐药的关系 Ⅰ群菌株与其它菌株对一线和二线药物的总耐药率、一线和二线药物的耐药率、单耐药率、耐多药率、广泛耐多药率如下。Ⅰ群菌株与其它菌株的耐药率进行比较,两者间的差异无统计学意义(α=0.05)(表4)。 表3 127株菌株的耐药情况Tab.3 Drug resistance of 127 strains MLVA基因分型方法有很多优点,不仅特异性高、稳定性强,且操作简便、重复性好,检测结果还可以数字表示,不同实验室之间可相互进行比较。 本研究采用15个VNTR位点对山西省的127株结核分枝杆菌进行基因分型,结果显示Mtub21、MIRU26和ETRE对于分析山西省的结核分枝杆菌有较高的多态性;MIRU40、ETRB、ETRD、MIRU23、 ETRC的多态性较差。先前研究发现,在北京[9]QUB11b、Mtub21、MIRU39和MIRU16的多态性较高,青海省[4]菌株中多态性最好的是MIRU26,徐州[5]结核分枝杆菌的实验过程中发现MIRU26和Mtub21多态性较好,西藏地区[10]主要是MIRU31、Mtub21和ETRE多态性较高,四川地区[11]QUB11b和MIRU26的多态性较好,在韩国MIRU26和ETRE的区分力较高[12],提示不同地区VNTR位点的多态性不同,Mtub21、MIRU26和ETRE位点在实验菌株的分析方面发挥着重要作用。127株菌株分为11个基因群,以Ⅰ群菌株(80.31%)为主,说明这些菌株属于亲缘关系很近的同一个克隆系,可能为山西长治及周边地区的主要流行菌株,应加强对这类菌株的研究[13]。 表4 不同基因型菌株的耐药性比较Tab.4 Drug resistance comparing in different genotype among strains 注:1,Fisher确切概率法 耐药结核病的流行,尤其是耐多药患者增多,病程漫长,传染风险极高,是我国结核病疫情居高不下的重要原因[14]。2010年开展的全国结核病流行病学调查显示:一线、二线药物的总耐药率为36.8%和24.6%,耐多药率6.8%[15]。 本次研究结果:一线药物的总耐药率为47.27%,耐多药率为21.26%,显然高于2010年全国调查结果,表明长治及周边地区结核病耐药状况仍然比较严重。一线药物中链霉素的敏感性较低,乙胺丁醇的敏感性较高,二线药物中左氧氟沙星的敏感性较低。链霉素是广谱抗生素,必须与其它药物联合使用,但因其对神经和肾的副作用,很多患者不按标准方案用药或中途停药,部分医生用药不规范,是造成链霉素耐药的重要因素[16]。因左氧氟沙星利于痰菌转阴、影像学疗效改善和不良反应少,成为治疗耐多药肺结核的最佳辅助选择,但氟喹诺酮类药物对其它致病菌较强的杀菌作用而被普遍使用,增加了它的耐药率[16-17]。一线药物中链霉素和异烟肼的单耐药率较高,未发现利福平和乙胺丁醇的单耐药菌株,二线药物的敏感性高于一线药物。临床用药建议:充分发挥利福平和乙胺丁醇的作用,规范地联合用药,特别是对于一线药物高度耐药的菌株联合二线药物进行治疗,以避免耐药性的产生[18-19]。应加大耐药结核特别是耐多药结核的监控力度,继续加强菌株培养和药敏试验,根据实验结果制定合理的化疗方案或调整方案[20]。对患者进行随访追踪,监督指导,以提高用药的依从性。 Ⅰ群菌株(主要流行菌株)与其它菌株对一线、二线药物的总耐药率、一线和二线药物的耐药率、单耐药率、耐多药率及广泛耐多药率进行比较,两者间的差异无统计学意义,表明主要流行菌株与耐药性无明显相关性。 本实验标本量有限,在今后的研究中,我们需不断地加大样本量,并且结合其它的分型方法——Spoligotyping来共同分析基因型与耐药之间的关联性。
3 讨 论