巨噬细胞CT靶向定量对斑块易损性风险预测的研究*
李 江 秦 健 闫呈新 赵 雷 朱建忠
(泰山医学院附属医院 医学影像科,山东 泰安 271000)
巨噬细胞能够吞噬血管内皮下脂质成分,这是粥样硬化性斑块内泡沫细胞的重要来源[1]。此外巨噬细胞能够合成并释放多种炎性因子,进而扩大炎症级联反应,最终导致粥样硬化性斑块的破裂[2]。本研究旨在通过特异性靶向CT对比剂,对斑块内巨噬细胞进行分子影像学量化,进而探讨量化指标与斑块稳定性的相关关系及对斑块破裂风险的预测价值。
1 材料与方法
1.1 制备AuNPs、Au-rHDL复合物
通过两相法和均相法,提取氯金酸溶液中的金离子,制得稳定的纳米金粒子(gold nanoparticles,AuNPs);进一步合成以AuNPs为核心、以重组高密度脂蛋白(recombinant HDL,rHDL)为外壳的胶粒。即Au-rHDL。
1.2 粥样硬化动物模型的建立
选取雄性新西兰大白兔10只(3月龄,2.0~2.5 kg)。所有实验兔均适应性常规饲料喂养1周,抽取空腹12 h后静脉取血,测定TC、TG、HDL、LDL水平。所有实验兔均行高脂饲料联合免疫损伤的方法喂养,喂养过程中有2只实验兔不能耐受并予以突剔除。喂养满30周时,所有实验动物空腹12h后再次测定TC、TG、HDL、LDL水平。
1.3 图像采集及量化数据提取
选用Philips 256层螺旋CT进行扫描。扫描前先进行腹腔注射麻醉,行常规CT平扫;而后高压注射器经耳缘静脉向实验动物体内注入适量Au-rHDL和生理盐水(注射速率:1.0 ml/s),获取延迟24 h后CT图像。扫描参数:管电压75 kV,管电流90 mA,球管旋转时间0.5 s,矩阵512×512。对原始图像进行拉直多平面重组(straightened multiplanar reformatted,SMPR)。在重组后图像中利用基于感兴趣区(region of interest,ROI)选取工具,计算平扫序列的选定横断面血管面积(vessel area,VA)及相应层面延迟24 h后对比剂存留区域面积(contrast agent retention area,CARA),并计算两者比值(CARA/VA)。测量由两名高年资医师双盲法完成,取两次测量(间隔1个月)的平均值。
1.4 病理免疫组化分析
所有扫描完成后,处死实验动物(过量麻醉)并获取腹主动脉标本,经固定保存、包埋冰冻后,沿血管纵轴进行连续切片,获取厚度10 μm,间隔1 mm的横断面切片。经MAC-3免疫组化染色后,判断AuNPs聚集区是否与巨噬细胞分布一致。
1.5 统计学分析

2 结 果
2.1 实验动脉建模前后血脂指标对比
与建模前对比,动物模型血脂指标产生明显变化,且差异具有统计学意义(P<0.05),见表1。
2.2 病理免疫组化分析
腹主动脉粥样斑块内,巨噬细胞聚集区域与对比剂存留区域相一致。

表1 实验兔建模前后血脂指标对比
2.3 图像后处理量化指标的分析
以斑块CT值为斑块易损性判断依据[3]:CT值<50Hu的斑块定义为易损性斑块,且CT值越低、易损性越高;CT值≥50Hu的斑块定义为稳定性斑块。与稳定斑块组相比,易损斑块组CARA/VA值相对较大,且差异具有统计学意义(P<0.05),见表2、图1;且CARA/VA值与斑块CT值具有较高的相关关系(r=0.765,P<0.05)。ROC曲线研究发现,CARA/VA值曲线下面积(area under the curve,AUC)明显大于CT值,差异具有统计学意义(P<0.05)见表3、图2。

表2 组间CARA/VA值与CT值的比较
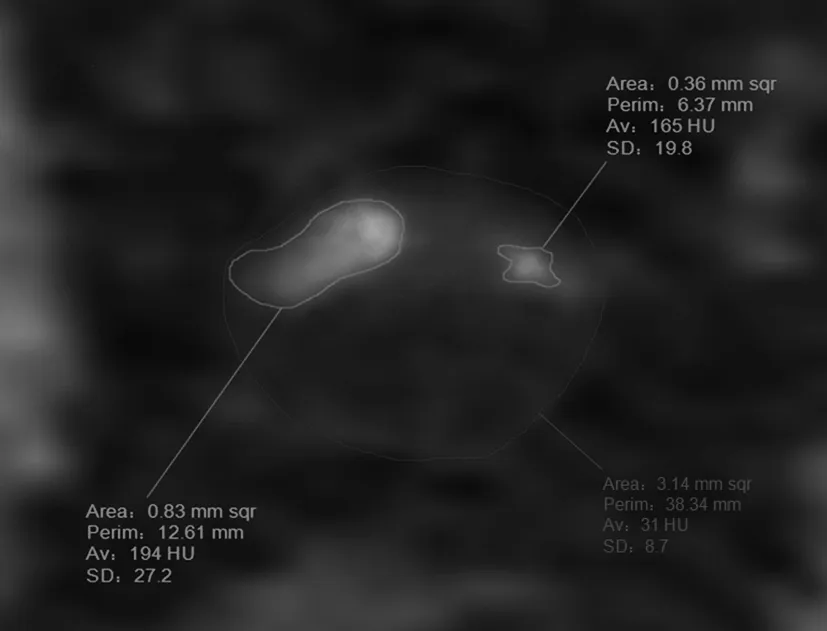
注:VA=3.14mm2,CARA=1.19mm2,CARA/VA=0.38。
图1 注入对比剂延迟24h后所得血管重组断面图像

表3 ROC曲线下面积分析
a:在非参数假设下
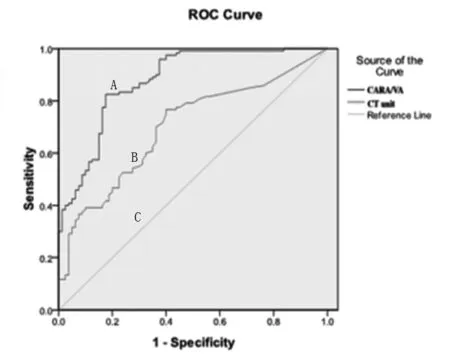
注:A线表示CARA/VA值,B线表示CT值。
图2 易损斑块组中CARA/VA值与CT值的ROC曲线图
3 讨 论
动脉粥样硬化(Atherosclerosis, AS)引发的心脑血管疾病,是长期以来威胁人类健康的多发性疾病[4]。不同患者之间 AS 病理结构和临床表现各有差异:①以斑块导致动脉管腔狭窄为主要病因。随着斑块的增大,动脉管腔狭窄导致远端供血不足及组织缺氧,从而产生临床症状(如稳定性心绞痛);②以易损斑块破裂导致急性血栓形成为主要病因。易损斑块破损常导致供血区组织急性缺血坏死(如急性冠脉综合征和脑梗塞)[5]。长期以来,临床使用Framinghanm 评分评估患者心血管事件危险度,但研究表明2/3急性冠脉综合征患者仅属于中度危险人群[6]。虽然高敏C-反应蛋白(hsC-RP)、脂蛋白相关的磷脂酶A2、核转录因子NF-κB、纤维蛋白原等血清学标志物可以预测人群心脑血管急性事件的危险性,但距离易损患者“个性化”预警尚存在差距。
尸检研究表明破裂的粥样硬化斑块中含有大量的巨噬细胞,结果提示巨噬细胞在斑块并发症中起到关键作用[7]。同时,大多数斑块薄纤维帽可通过自我修复而长期处于静止状态[8],而纤维帽内巨噬细胞的浸润可能是导致纤维帽破裂的关键因素[9]。因此,巨噬细胞在斑块发展过程中对斑块形态、体积、成份变化及转归有着重要作用。利用影像学技术对局部动脉粥样硬化斑块内巨噬细胞的早期发现、量化评估,对预防心脑血管疾病具有非常重要的临床意义。
本研究通过合成以AuNPs为核心、以rHDL为包裹的具有生物学活性及靶向性的特异性对比剂,利用CT成像技术及重组技术,实现了对粥样硬化性斑块内巨噬细胞影像学量化和空间定位。通过与病理免疫组化切片结果相对照,两者结果相一致。课题组进一步研究发现,由于不同层面斑块面积存在差异,单纯以CARA作为指标进行分析误差较大,因此本研究创新性提出CARA/VA值这一量化指标,其代表截面内巨噬细胞面积与管腔面积的比值。分组研究证实稳定斑块组的CARA/VA值明显低于易损斑块组,即表明斑块内巨噬细胞含量越大易损风险性越高。这与Ruddy等[10]的研究结果相一致。同时CARA/VA值与斑块的CT值具有较高的相关性(r=0.765,P<0.05),进一步研究发现CARA/VA值与斑块稳定性密切相关。且CARA/VA值判别斑块易损性的ROC曲线下面积(AUC=0.859)明显大于CT值(AUC=0.687),表明CARA/VA值在斑块破裂风险预测方面较CT值具有更为显著的敏感性及特异性。
大量证据表明,AS是一个以局部突出表现为主,以动脉粥样硬化斑块炎症为核心的全身系统性疾病[11]。早期局部微环境的变化、细胞成分的改变及比例的失调明显早于医学影像学的阳性发现。本研究通过特异性靶向对比剂,以活体内动脉粥样硬化斑块为模型,以巨噬细胞为分子成像目标,实现动脉粥样硬化斑块内巨噬细胞成份的量化、空间定位,成功建立了“结构—功能”影像学特征预测斑块病理结构的关联模型,为动脉粥样硬化斑块疾病早期预警提供理论基础。

