应用HRCT影像学表型综合评估慢性阻塞性肺疾病严重程度及其与LAA相关性*
胡雨禾,陈宜泰,李锐 ,王凯 ,徐文慧,许丽梅,杜越 ,陈新
(1.南方医科大学珠江医院 呼吸与危重症医学科,广东 广州 510282;2.南方医科大学公共卫生学院 生物统计学系,广东 广州 510515)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是一种以持续性呼吸道症状和气流受限为特点的慢性呼吸系统疾病[1]。研究表明,COPD患者存在异质性[2-3],单一的肺功能检查在评估COPD方面存在明显的局限性。在现有的疾病评估中,运用多种评估指标如肺功能、呼吸肌肉功能、症状表现和生活质量、运动能力、营养状态及焦虑抑郁同时对COPD进行综合评估往往可以弥补单一评估模式的不足,对疾病严重性做出更加准确的评价[1]。高分辨率CT(high-resolution computed tomography, HRCT)可以对小气道病变和管壁增厚情况做出直接评估,真实反映COPD患者肺组织病理解剖上的变化[4-5]。相关研究也表明利用HRCT形态学改变所划分的不同影像学表型,在影像学改变和临床症状等多个方面具有差异[6-7]。但影像学表型在COPD严重程度综合评估中的作用仍不明确。并且,作为HRCT主要指标之一的低密度衰减区域(low-attenuation area, LAA)评分与各项综合评估指标的相关性尚不清楚。因此,本研究根据HRCT对COPD患者进行影像学表型划分,采用多维评估体系和方法探索HRCT及LAA评分在COPD严重程度综合评估中的作用,为COPD防治提供有益的补充。
1 资料与方法
1.1 研究对象
本研究采取横断面调查的方法,选取2014年6月—2016年12月南方医科大学珠江医院就诊的稳定期COPD患者197例。其中,男性162,女性35例。纳入标准:年龄<40岁,基于肺功能确诊COPD的患者(即吸入支气管扩张剂后,FEV1/FVC<0.70,确定存在持续性的气流受限,可诊断为COPD,诊断标准与2017年GOLD诊断标准相符合),并处于临床稳定期。排除标准:患有支气管哮喘、晚期肺结核、恶性肿瘤、支气管扩张、严重心血管疾病,以及8周内有COPD急性加重的患者。本研究获南方医科大学珠江医院伦理委员会的批准,符合赫尔辛基申明,并向患者交代研究目的、意义及潜在益处和风险,患者均签署知情同意书。
1.2 研究方法
所有COPD患者相关资料采集均在纳入研究后3 d内完成,包括基础资料和HRCT扫描,以及作为综合评估指标的肺功能测试、呼吸肌肉功能、症状表现和生活质量、运动能力、营养状态及焦虑抑郁情况。所有相关数据均由丰富经验的呼吸科医师采集并根据2017年GOLD A-B-C-D评估模式和肺功能分级分别将患者分为A、B、C、D 4组和肺功能Ⅰ、Ⅱ、Ⅲ、Ⅳ级。
1.2.1 肺功能 肺功能测试采用意大利Cosmed Quark PFT系列肺功能仪器,满足ATS仪器质控标准[8],进行常规肺通气功能检查和支气管舒张试验。第一秒用力呼气容积(FEV1)、用力肺活量(FVC)、第一秒用力呼气容积占预计值的百分比(FEV1%pred)、第一秒用力呼气容积占用力肺活量的百分比(FEV1/FVC),在支气管舒张试验前后分别进行测量。
1.2.2 呼吸肌肉功能 呼吸肌肉功能主要通过最大吸气压(maximal inspiratory pressure, PImax)与最大呼气压(maximal expiratory pressure, PEmax)评价,采用数显压力表(台湾衡欣公司)重复进行测试,并根据美国胸科协会和欧洲呼吸学会关于呼吸肌肉测试的声明[9]进行质控,选取3次最大测量值进行分析。
1.2.3 症状表现和生活质量 利用COPD评估测试(COPD assessment test, CAT)和改良的英国医学研究委员会呼吸困难量表(modified medical research council scale, mMRC)评价症状严重性,生活质量评价采用圣乔治呼吸调查问卷(St George's respiratory questionnaire, SGRQ)进行评价。
1.2.4 运动能力 根据美国胸科协会指南[10],采用6 min步行试验距离(6 min walking distance, 6 MWD)评价运动能力。
1.2.5 营养状态 根据相关研究[11-12],通过体重指数(body mass index, BMI)、去脂体重指数(fat-free body mass index, FFMI)评价患者营养状况,采用南方医科大学珠江医院内分泌科身体成分分析仪器(韩国Biospace公司)进行测量。重复测量2次,取其平均值。BMI=体重 /身高2(kg/m2)。FFMI= 去脂体重 /身高2(kg/m2)。
1.2.6 焦虑抑郁情况 焦虑和抑郁情况主要通过医院焦虑抑郁量表(hospital anxiety and depression scale,HADS)来评估[13]。
1.2.7 HRCT分型 HRCT扫描采用Philips Brilliance 256层iCT进行。扫描参数:层厚1 mm,层间距1 mm,图像以1 mm层厚重建。根据相关研究结果[6,14-15],设定CT值<-950 HU为LAA,即肺气肿区。并根据KITAGUCHI等[6]学者的评分方法和分型方法,选取3个解剖层面进行评分,根据评分总和进行肺气肿分级。0级:总和分为0分;1级:总和分为1~6分;2级:总和分为7~12分;3级:总和分为13~18分;4级:总和分为19~24分。支气管壁增厚程度的评估利用多平面重组图像技术(curved multiplanar reconstruction, MPR)从不同旋转角度观察右肺上叶尖段支气管,测量其第5级分支气管壁径线与伴行肺动脉直径,计算两者比值,进行定量分析。评估增厚情况。0级:气管壁径线/伴行肺动脉直径<30%;Ⅰ级:30%≤气管壁径线/伴行肺动脉直径<50%;Ⅱ级:气管壁径线/伴行肺动脉直径≥50%。根据肺气肿程度及支气管管壁增厚情况将197例COPD患者分为3种影像学表型。A型:无肺气肿或存在轻微肺气肿,LAA≤1级,不考虑是否合并支气管管壁增厚;E型:LAA≥2级的肺气肿,不合并支气管管壁增厚;M型:同时存在LAA≥2级的肺气肿和≥1级的支气管管壁增厚。
1.3 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,比较采用单因素方差分析,两两比较采用t检验,计数资料以率(%)表示,比较采用χ2检验,两变量的相关检验采用Spearman相关分析或Pearson相关分析,多元线性回归用于评估预测LAA评分的影响因素,P<0.05为差异有统计学意义。
2 结果
2.1 基本临床特点
A型50例,LAA分级和LAA评分分别为(0.86±0.35) 和(2.52±1.73);E型 101例,LAA分 级 和LAA评分分别为(2.49±0.58)和(12.34±3.59);M型46例,LAA分级和LAA评分分别为(2.63±0.64)和(13.46±3.93)。分级和评分在3种分型间差异有统计学意义(P<0.05)。在本研究中,男性人数为162人,占82.2%,明显多于女性。E型患者的年龄高于A型患者(P<0.05)。E型与M型患者的吸烟指数高于A型患者(P<0.05)。M型患者的既往1年住院次数高于A型患者(P<0.05)。年龄、吸烟指数、既往1年住院次数在E型与M型患者中差异无统计学意义(P>0.05)。肺功能分级和GOLD分组在影像学表型中的分布见图1、2,在各分型中,肺功能分级为Ⅰ级和Ⅱ级患者在A型中所占比例最大,占86.0%,在E型和M型中所占比例较小,分别为36.6%和47.8%。按照GOLD分组A-B-C-D评估模式,A组患者在A型中所占比例最大,占68.0%,在E型和M型中所占比例较小,分别为19.8%和6.5%。肺功能分级和GOLD分组在各影像学表型中的分布差异有统计学意义(P<0.05)。见表 1。
2.2 各影像学表型在综合评估指标方面的特点
3种影像学表型在FFMI、HADS总分、HADS抑郁评分、HADS焦虑评分方面,差异无统计学意义(P>0.05)。A型患者的mMRC、BODE低于E型与M型患 者(P<0.05), 在 FEV1、FVC、FEV1%pred、FEV1/FVC%、6MWD、PImax、PEmax、BMI方面则高于其余两型(P<0.05),该指标在E型与M型患者中差异无统计学意义(P>0.05)。此外,M型患者CAT、SGRQ高于A型患者(P<0.05)。见表2。

图1 肺功能分级在影像学表型中的分布
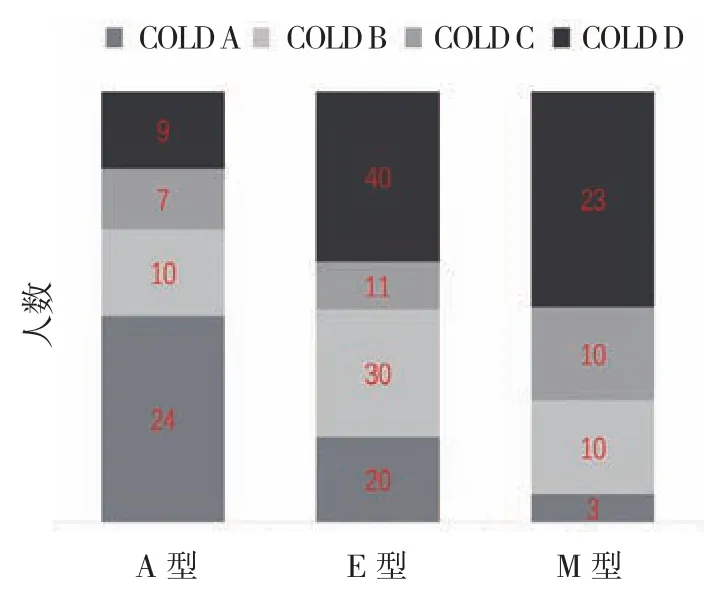
图2 GOLD分组在影像学表型中的分布

表1 3种影像学表型的基本临床特点
表2 3种影像学表型在综合评估指标方面的特点 (±s)

表2 3种影像学表型在综合评估指标方面的特点 (±s)
注:†与A型比较,P <0.05
表型 n FEV1/L FVC/L FEV1%pred FEV1/FVC% mMRC CAT SGRQ 6 MWD/m A 型 50 1.63±0.55 2.71±0.90 70.98±18.79 60.04±8.36 1.24±1.17 14.96±8.30 24.40±14.74 479.96±91.50 E型 101 1.12±0.48† 2.38±0.81† 46.68±18.11† 48.17±11.47† 2.18±1.20† 17.86±7.79 29.44±14.74 391.49±117.44†M型 46 1.08±0.39† 2.36±0.70† 48.96±18.18† 47.66±13.12† 2.22±1.09† 20.41±7.69† 31.53±12.14† 371.46±151.16†F值 22.010 3.150 31.230 21.560 12.320 5.740 3.350 11.970 P值 0.000 0.045 0.000 0.000 0.000 0.004 0.037 0.000表型 n PImax/cmH2O PEmax/cmH2O FFMI/(kg/m2) BMI/(kg/m2) BODE HADS HADS抑郁评分 HADS焦虑评分A 型 50 63.05±17.36 75.30±22.35 16.11±1.63 23.20±3.27 1.44±1.46 3.94±2.22 1.86±1.28 2.08±1.37 E型 101 51.49±16.31† 57.36±18.71† 15.42±2.18 21.37±3.79† 3.84±2.33† 4.14±2.60 1.95±1.33 2.19±1.55 M 型 46 52.69±16.61† 61.09±23.40† 15.71±1.76 21.01±3.05† 4.28±2.27† 4.04±2.36 1.93±1.40 2.11±1.25 F值 8.500 12.620 0.780 5.940 27.230 0.110 0.080 0.110 P值 0.000 0.000 0.460 0.003 0.000 0.894 0.924 0.896
2.3 LAA评分与各指标相关性分析及多元线性回归分析
在所有患者中,LAA评分与FFMI具有相关性(P=0.041), 同 时 与 FEV1、mMRC、CAT、SGRQ、6MWD、PImax、PEmax、BMI、BODE 也相关(P<0.05)(见表3)。多元线性回归发现,BODE、FEV1、BMI是预测LAA评分的影响因素(P<0.05)。见表4。

表3 LAA评分与各指标相关性分析
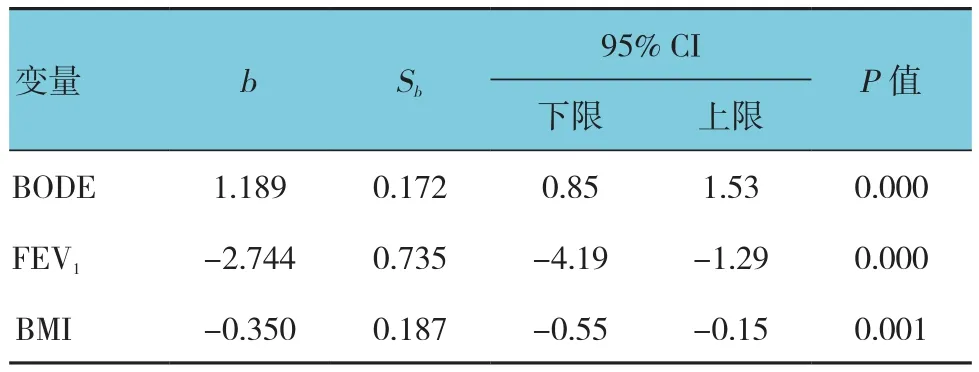
表4 多元线性回归预测LAA评分
3 讨论
本研究结果表明,根据HRCT形态学表现所划分的不同影像学表型在性别比例、吸烟指数、既往1年住院次数、LAA评分等临床特点上差异有统计学意义。A型患者在肺功能、运动能力、呼吸肌肉力量、营养状态等多个综合评估指标方面优于E型和M型患者。LAA评分与 FEV1、6 MWD、PImax、PEmax等多个指标具有相关性,BODE、FEV1、BMI可以作为预测LAA评分的独立因素。
在最新的临床指南中,FEV1作为诊断和评估COPD气流受限严重程度的主要指标之一,在疾病评价中依然被广泛使用。但在评估小气道病变方面,FEV1则缺乏相应的准确性[3],况且由于疾病本身存在异质性,简单的肺功能参数并不能完全反映和概括COPD的诸多临床特征。因此,单纯运用肺功能分级来定义COPD并不能准确阐明COPD的病理变化过程。而运用HRCT图像则可以发现许多与病理结果相关的改变,清晰地表现出肺实质的形态学变化,从而对与疾病结局相关的临床指标作出解释。在本研究中,A型患者的纳入人数较少,说明A型患者就诊比例可能较低,这与COPD常常未能早发现早治疗的真实情况相符合。E型和M型患者的平均年龄要高于A型患者,这可能是由于在肺实质病变和气道重塑过程中,由轻微的肺气肿改变到严重的肺气肿改变和气管壁增厚具有一定的时间累积效应。而在表型的性别构成中,A型患者中女性患者所占比例要远远高于其他两型。相关研究也表明[7,16],女性患者往往处于病变更轻的表型,男性则相反。而在包括性别在内的COPD危险因子的研究当中,吸烟是被研究最充分、也是最明确的危险因子之一。一项较新的研究结果表明[17],与吸烟者相比,从不吸烟的COPD患者具有较少的症状和系统炎症反应。在本研究结果中,E型和M型受试者中有更多的男性患者,并且吸烟指数远远高于A型患者,暗示性别因素和吸烟史可能是导致E型和M型患者肺气肿病变更严重的原因之一。
COPD是一种慢性炎症性疾病,除可引起肺功能受损和呼吸道症状外,还可产生一系列肺外表现,如运动能力下降、营养不良、骨质疏松、焦虑抑郁等等。从多方面进行综合评估往往可以对COPD严重性做出更加准确的评价。譬如CELLI等[18]学者利用综合4种指标的BODE指数预测COPD患者的远期预后,并且发现效果优于传统的FEV1。本团队先前的研究也表明[19]综合评估指标在评价COPD肺康复方面具有良好的效果。但现有的评估指标大多缺乏形态学证据支持,在实际操作中难以同时进行评估。
KITAGUCHI等[6]学者的研究表明相比于E型和M型患者,A型患者具有较少的吸烟史、更高的体重指数和弥散指数、较轻的过度充气以及吸入支气管舒张剂后更好的气流受限改善。同时,肺气肿的严重程度与低BMI、低FEV1/FVC、弥散功能下降具有明显相关性。而VAN等[20]学者通过CT低密度衰减区域的量化评估,将稳定期COPD患者分为4种影像学表型:正常型、气道病变为主型、肺气肿型、混合型。其中肺气肿型与混合型分别与本研究中的E型和M型有相似的解剖学基础,结果表明,与其他分型相比,混合型具有更严重的呼吸困难和更频繁的住院次数,因而需要更多的关注和临床干预。在本研究也得到一些类似的结果,A型患者在FEV1、FEV1%pred、FEV1/FVC、6 MWD、PImax、PEmax、BMI、BODE等指标方面优于E型和M型。有研究表明[21],营养状况与疾病严重程度具有一定相关性,但在本研究中,不同影像学表型的患者在FFMI无统计学差异。在症状与急性加重评估方面,A型患者也明显具有更少的症状和急性加重次数。E型和M型患者由于肺气肿病变较为严重,肺组织的过度充气会引发残气量的增加,从而导致呼吸肌肉功能的下降。而呼吸肌肉功能的下降与呼吸困难的发生相关[21-23]。以上结果均表明,相比于另外两型患者,A型患者可能具有更高的生活质量和更好的临床预后。
本研究也发现,作为HRCT主要指标之一的LAA评分与肺功能、临床症状、运动能力、营养状态、呼吸肌肉力量等多个临床指标具有相关性。LAA评分作为LAA的量化指标,代表肺气肿在肺实质中的严重程度。在SUZUKI等[24]学者的一项研究中,将多层螺旋CT扫描中CT值<-960 HU定义为低密度衰减容量(low attenuation volume, LAV),以LAV占肺容积的百分比(LAV%)作为评估肺气肿的严重程度,研究发现,COPD患者的LAV%与CAT呈正相关。BAI等[25]的横断面研究也得出了类似的结论,并且发现在既往一年中具有更多的急性加重次数的COPD患者LAV%水平也更高,而研究发现[26],具有更多症状的患者可能具有更差的预后。与以往研究相比,本研究表明LAA评分与综合评估指标显著相关,还发现BODE、FEV1、BMI可以作为LAA评分的预测因素,而在评价COPD预后中具有良好效果的BODE指数中已包含了FEV1和BMI,这可能预示着在COPD严重程度评估中肺功能和营养状态评估仍然不能忽视。以上结果都表明LAA评分在疾病的严重程度评估与综合评估方面具有一定的效力,但LAA评分是否可以用于预测患者临床结局,则有待于以后的研究来进一步证实。
本研究利用HRCT无痛、快速的特点,依据影像学特点进行表型划分,并采用众多与疾病密切相关的综合评估指标进行评价,证实了HRCT在疾病评估中的独特作用,为COPD的综合评估提供了影像学证据。虽然在现有的疾病评估模式中新的ABCD评估模式更为简便,但这种模式仅从症状和急性加重次数进行评估,受主观性影响较大,可能会导致病情评估出现偏差。虽然HRCT由于价格偏高、辐射量大等原因不宜作为常规普及推广,但在患者不能进行配合进行肺功能检查、常规影像学方法不能准确进行分型的情况下,利用HRCT进行评估往往可以得到较好的效果,对疾病严重程度评估提供有益的补充。
当然,本研究也存在一些不足之处。首先,本研究是通过HRCT扫描的不同影像学表型对COPD进行评价,缺乏长期动态观察以及对相应预后指数的评估,这是主要不足之处。同时,本研究中纳入的女性COPD患者较少,尤其是在E型和M型患者中,因而未来需进一步增加女性患者样本量来对女性患者的临床特点进行评估。此外,对患者进行影像学评估分型的过程中存在一定的主观性,这可能会使结果产生偏倚,这将在以后的研究中对此进行完善。
HRCT在COPD综合评估中具有一定的临床应用价值,根据HRCT所划分的不同影像学表型具有不同的临床特征,相比于E型和M型患者,A型患者可能具有更高的生活质量和更好的临床预后。HRCT影像学表型及LAA评分可以在一定程度对COPD严重程度进行评估,为疾病的综合评估提供有益的补充。

