子宫内膜癌组织microRNA-944的表达及临床意义
章丽,张志秀,于爱军,李明
(山东省德州市人民医院 1.妇产科,2.病理科,山东 德州 253014)
子宫内膜癌(endometrial carcinoma, EC)是女性生殖系统最常见的恶性肿瘤之一,其发病率呈逐年升高的趋势,且患者的预后较差[1]。EC早期患者,在接受根治手术治疗后,其5年总存活率可高达96%[2]。然而,EC在发生远处转移或者复发后,采用内分泌、放化疗的治疗效果并不理想,患者的存活率较低[3]。因此,临床上迫切需要寻找与EC肿瘤形成相关且有助于EC早期诊断、预后预测的分子靶标。微RNAs(microRNAs)为长度约22个核苷酸的非编码小RNA,在转录后水平通过降解mRNA和/或抑制翻译,负性调控靶基因的表达。MicroRNAs在很多重要的生物学进程中发挥重要作用,如细胞增殖、凋亡、病毒感染及肿瘤发生等[4]。研究证实,在宫颈癌的肿瘤形成和恶性进展过程中,存在多种microRNAs异常表达[5],然而仅少数microRNAs在宫颈癌中的功能被深入研究。本研究以EC患者的癌组织样本为研究对象,采用实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)检测EC癌组织和正常子宫内膜组织中microRNA-944(miR-944)的表达情况,并分析miR-944表达与EC患者临床病理特征和预后的关系,现报道如下。
1 资料与方法
1.1 临床资料
选取2013年6月—2015年6月山东省德州市人民医院80例EC患者的癌组织手术标本。纳入标准:①具有完整的病历资料;②术后病理诊断为EC;③术前均未接受放化疗;④无内分泌、免疫和代谢性疾病;⑤术前6个月内未服用激素类药物。排除标准:①合并其他恶性肿瘤;②全身感染性疾病;③肝肾疾病。本研究中,<55岁患者43例,≥55岁患者37例;绝经前患者47例,绝经后患者33例;子宫内膜样腺癌患者51例,非子宫内膜样腺癌患者29例;组织分级:G1患者16例,G2患者26例,G3患者38例;肌层浸润深度≤1/2患者39例,肌层浸润深度>1/2患者41例;有淋巴结转移患者54例,无淋巴结转移患者26例;有远处转移患者49例,无远处转移患者31例;国际妇产联盟(FIGO)分期:Ⅰ、Ⅱ期患者43例,Ⅲ、Ⅳ期患者37例。另收集同期30例子宫肌瘤等良性病变行子宫切除术患者的正常子宫内膜组织作为对照组。所有子宫内膜组织样本离体后,立即保存于液氮中。本研究获该院医学伦理委员会批准,所有患者知情并签署知情同意书。
1.2 试剂与方法
1.2.1 试剂与仪器 Trizol试剂购自美国Invitrogen公司,RNA提取试剂盒购自美国Axygen公司,MicroRNAs逆转录试剂盒购自上海吉玛制药技术有限公司,cDNA逆转录试剂盒购自美国Thermo Scientific公司,SYBR Green购自德国Roche公司,real-time PCR引物购自上海生工生物工程股份有限公司。Nanodrop分光光度计购自美国Thermo公司,qRT-PCR扩增仪购自德国Roche公司。
1.2.2 qRT-PCR检测miR-944表达 从液氮中取出组织样本,迅速置于10 ml离心管中,加入Trizol试剂,以匀浆器高速间断匀浆,匀浆过程中,离心管置于冰上。Trizol法提取EC癌组织及正常子宫内膜组织中总RNA,操作步骤参照RNA提取试剂盒的说明书。Nanodrop分光光度计检测总RNA浓度及纯度(OD260/OD280比值在1.8~2.0),cDNA逆转录试剂盒进行逆转录,cDNA产物置于-20℃冷冻保存备用。引物序列如下:miR-944正向5'-CGCGAGCAGGAAATTATTGTA-3',miR-944反 向5'-TATGCTTGTTCTCGTCTCTGTGTC-3';内参 U6正向 5'-CTCGCTTCGGCAGCACA-3',U6反向 5'-AACGC TTCACGAATTTGCGT-3'。定量PCR扩增仪检测miR-944相对表达水平。qRT-PCR扩增体系为10 μl,反应条件:95oC预变性10 s,95oC变性15 s,60oC退火20 s,70oC 延伸 20 s,共 35 个循环。采用 2-ΔΔCt法表示miR-944相对表达量。每个组织样品进行3次重复试验后,进行统计分析。
1.3 随访
随访方式为电话或者门诊。随访时间为患者术后1~48个月,随访终点事件为患者死亡或者到达随访截止时间(2017年6月)。
1.4 统计学方法
数据分析采用SPSS 13.0统计软件,计量资料以均数±标准差(±s)表示,多组的比较采用方差分析,两组的比较采用成组t检验。计数资料以率(%)表示,比较采用χ2检验,建立Kaplan-Meier生存模型,组间比较采用Log-rank检验,采用受试者操作特征(receiver operation characteristic, ROC)曲线。P<0.05为差异有统计学意义。
2 结果
2.1 不同子宫内膜组织中miR-944表达情况
EC癌组织中miR-944相对表达量与正常子宫内膜组织比较,差异有统计学意义(t=15.405,P=0.000),EC癌组织(3.29±1.21)高于正常子宫内膜组织(1.02±0.32)。
2.2 EC癌组织中临床病理特征与miR-944表达的关系
EC癌组织中,miR-944表达与患者的年龄、绝经状态、病理分型及组织分级无关(P>0.05);而与肿瘤肌层浸润深度、有无淋巴结转移、有无远处转移及FIGO分期相关(P<0.05)。在肌层浸润深度>1/2组的癌组织中,miR-944表达水平高于肌层浸润深度≤1/2组(P<0.05);有淋巴结转移组的癌组织中,miR-944表达水平高于无淋巴结转移组(P<0.05);有远处转移的癌组织中,miR-944表达水平高于无远处转移组(P<0.05);在Ⅰ、Ⅱ期组的癌组织中,miR-944表达水平低于Ⅲ、Ⅳ期组(P<0.05)。见附表。
2.3 EC癌组织中miR-944表达与患者生存率之间的关系
以平均值为界限,将EC患者分为miR-944低表达组(34例)与miR-944高表达组(46例),绘制Kaplan-Meier生存曲线。结果显示,miR-944高表达组患者的5年总生存率与低表达组患者比较,差异有统计学意义(χ2=8.534,P=0.003),高表达组为54.35%(25/46),低于miR-944低表达组患者的85.29%(29/34)。miR-944高表达组的患者平均生存时间为(50.09±2.03)个月,而miR-944低表达组患者的平均生存时间为(56.03±1.83)个月,Log-rank检验结果显示,miR-944高表达组患者的生存时间较miR-944低表达患者降低(χ2=7.784,P=0.006)。见图1。
2.4 miR-944表达对患者预测/诊断价值分析
以正常对照组和子宫内膜癌组为样本,进行miR-944表达水平的ROC分析,分析miR-944表达水平对患者是否具有一定的辅助诊断/判断价值。约登指数=(敏感性+特异性-1),约登指数最大时对应的miR-944相对表达量,即为鉴别诊断阈值,本研究中的鉴别诊断阈值为1.8,在此阈值点,敏感性为74.3%,特异性为70.8%,ROC曲线的曲线下面积(AUC)为0.784,1-特异性为29.2%,约登指数为0.451。ROC曲线见图2。
附表 EC癌组织中临床病理特征与miR-944表达的关系(±s)
临床病理特征 n miR-944 t/F值 P值年龄<55岁 43 3.36±1.22 0.522 0.603≥55岁 37 3.22±1.17绝经状态绝经前 47 3.29±1.24 0.034 0.973绝经后 33 3.30±1.36病理分型子宫内膜样腺癌 51 3.42±1.45 1.074 0.286非子宫内膜样腺癌 29 3.07±1.31组织分级G1 16 3.25±1.17 0.641 0.529 G2 26 3.09±1.34 G3 38 3.45±1.24肌层浸润深度≤1/2 39 2.51±1.37 4.567 0.000>1/2 41 4.04±1.61淋巴结转移有54 3.48±1.24 2.100 0.039无26 2.83±1.41远处转移有49 3.53±1.46 2.192 0.031无31 2.82±1.33 FIGO分期Ⅰ、Ⅱ期 43 3.02±1.35-3.069 0.001Ⅲ、Ⅳ期 37 3.71±1.49
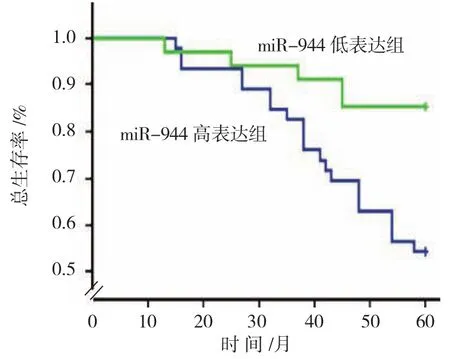
图1 EC癌组织中miR-944表达与患者生存率之间的关系

图2 ROC曲线
3 讨论
EC发病率位居女性恶性肿瘤的第6位,据统计,2012年全球EC新发病例数约32万[6]。EC是一种高度异质性的恶性肿瘤,且多种危险因素可诱发EC,如高血压、绝经状态、不孕症及家族史等[7]。近年来,对EC诊断和治疗方面取得了巨大进展,然而EC晚期患者的预后并不乐观,其5年总生存率仅10%~29%[8]。在人类肿瘤发生和恶性进展中,存在多种microRNAs的功能异常和表达异常。MicroRNAs可同时具有促癌基因和抑癌基因功能[9],取决于其下游靶基因的功能,如miR-340在骨肉瘤癌细胞通过靶向沉默ROCK1基因表达,抑制肿瘤细胞增殖和侵袭,具有抑癌基因功能[10],而在胃癌细胞中,miR-340则能够促进肿瘤细胞生长、抑制细胞凋亡,发挥促癌基因的功能[11]。多种microRNAs在EC细胞增殖和凋亡过程中发挥促癌基因或者抑癌基因的功能,如miR-199A-3P[12]、miR-101[13]等。越来越多的证据表明,miR-944参与多种恶性肿瘤的发生和恶性进展过程,本研究关注miR-944在EC癌组织中表达情况及其临床意义。
首先,qRT-PCR结果显示,与正常子宫内膜组织相比,miR-944在EC癌组织中表达水平上调,提示在EC肿瘤形成过程中,miR-944可能发挥促癌基因的功能,同时也有研究证实,miR-944在非小细胞肺癌(nonsmall-cell lung cancer, NSCLC)中靶向下调抑癌基因SOCS4表达,进而促进肿瘤形成,发挥促癌基因功能[14],然而,miR-944在胃癌[15]、食道癌[16]及结肠癌[17]等肿瘤细胞中发挥抑癌基因功能,可能与肿瘤所属组织器官差异或者miR-944下游靶基因不同有关。
分析EC癌组织中miR-944表达与EC患者临床病理特征之间的关系,结果显示,miR-944在肌层浸润深度>1/2、存在淋巴转移、远处转移和Ⅲ、Ⅳ期的癌组织中的表达水平较高,提示在miR-944可能促进了EC癌细胞对周围组织浸润、淋巴转移和远处转移,且miR-944具有作为EC早期诊断(Ⅰ、Ⅱ期)指标的潜能。miR-944可能是通过靶向调节与肿瘤浸润、侵袭及转移相关的基因表达,进而发挥作用,如XIE等[18]研究证实,miR-944靶向下调抑癌基因S100PBP表达,进而促进宫颈癌细胞侵袭迁移,本研究并未对miR-944促进肿瘤转移的内在机制进行探究,将在以后的研究中进行探索。
此外,本研究对miR-944表达与EC患者预后的关系进行分析,结果显示,miR-944高表达的EC患者,其术后5年总生存率和平均生存时间均低于miR-944低表达患者,提示miR-944高表达可能预示着较低的生存率和较短的生存时间,与EC患者不良预后密切相关,miR-944具有作为EC患者不良预后预测的生物靶分子的潜能。HE等[19]在乳腺癌中的研究结果也得到类似的结论,miR-944通过靶向调节BNIP3基因表达,产生获得性耐药,miR-944可作为乳腺癌患者不良预后的预测靶标。
最后,miR-944表达水平的ROC分析,结果提示:当miR-944表达水平在1.8(ROC分析所得阈值)以上时,患者EC的阳性率提高。提示其可作为判断EC的辅助证据,ROC曲线下面积AUC值较高(0.784),敏感性和特异性也较好。董动丽等[20]的研究结果表明,血清HE4和CA125诊断EC的敏感性分别为54.67%和28.00%,特异性分别为98.57%和91.43%,与之相比,本研究中miR-944诊断EC的敏感性较高,而特异性偏低。当然,由于本研究的实验样本量较少,可能会导致结果出现一定的偏倚,在后续的研究中应扩大样本量,以得到更加可靠、准确的结论。
综上所述,本研究结果证实,miR-944在EC癌组织中呈高表达状态,且miR-944高表达预示着患者可能发生肌层浸润、淋巴结转移及远处转移,并且与患者较低的术后5年总生存率和较短平均生存时间相关,提示miR-944参与并促进了EC肿瘤形成和恶性进展,miR-944可作为EC早期诊断和预后预测的潜在靶点。

