SCN9A基因多态性与肺癌疼痛发生及阿片镇痛剂量的相关性*
周 娜 吴成凤 汪 丹 陈立平 潘志强 申 文
(1徐州医科大学,江苏省麻醉与疼痛应用技术重点实验室,徐州221004; 2徐州医科大学附属医院疼痛科,徐州221002)
疼痛是恶性肿瘤病人最常见的临床表现之一。目前,约65%以上癌症病人存在中重度疼痛,其中约22%存在着剧烈甚至难以忍受的疼痛[1]。临床上有关癌痛治疗的手段多种多样,但大多不能获得满意的镇痛疗效。研究发现疼痛感知、疼痛敏感性和慢性疼痛易感性在个体间存在很大差异,这种差异由基因和环境因素共同决定[2],在基因组学上可表现为单个碱基的突变所引起的DNA序列多态性,即单核苷酸多态性 (single nucleotide polymorphism,SNP)。随着基因靶向治疗的不断兴起,人们正在积极寻找影响癌痛发生的相关基因位点,以便通过特异性干预疼痛基因位点SNP来治疗癌痛的方案成为可能。SCN9A (sodium channel protein type 9 subunit alpha) 是编码电压门控钠离子通道α-亚单位蛋白家族中的第Ⅸ型 (Nav1.7) 的基因,表达于初级感觉神经元和交感神经节神经元中。而电压门控钠离子通道 (voltage-gated sodium channels, VGSCs)的内向电流是神经元动作电位产生和电流传导的必需环节,参与痛觉信号的产生和传导[3]。研究发现SCN9A基因突变会改变钠离子通道的结构,影响其正常功能的发挥,导致多种与痛觉异常相关的疾病发生[4~6]。Kurzawski等人也发现 SCN9A-rs6746030的SNP与椎间盘突出症病人的疼痛强度有关[7],但关于rs6746030的SNP与癌痛发生的相关研究较少。为此,本研究对SCN9A-rs6746030的SNP与肺癌病人疼痛发生的相关性进行探讨,同时分析其对癌痛病人阿片药物用量的影响,从而为揭示癌症病人的疼痛差异及其疼痛基因靶向治疗的研究提供参考。
方 法
1.一般资料
选择2016年11月至2017年5月于徐州医科大学附属医院住院且病理学和/或细胞学确诊为肺癌的病人246例,其中肺癌伴疼痛者128例(疼痛组:男86例、女42例,年龄32~83岁);肺癌不伴疼痛者118例(无痛组:男73例、女45例,年龄 36~82岁)。选取同期该院的健康体检者106例作为对照组(男54例、女52例,年龄27~75岁),所有研究对象均为汉族自然人群,且无血缘关系。三组间的年龄和性别差异无统计学意义。本研究已通过徐州医科大学附属医院伦理委员会批准(伦理号:XYFY2015-KL002-01)。
排除标准:①曾患有或现有严重精神疾病者,或神志不清者;②合并其他疾病引起的慢性疼痛病人;③严重肝、肾功能损害者;④不能进行疼痛评估者。
2.方法
(1)评估:疼痛程度评估采用数字评价量表(numerical rating scale, NRS)法: 0分为无痛、1~3分为轻度疼痛、4~6分为中度疼痛、7~10分为重度疼痛。初次疼痛评分在住院期间未使用镇痛药物之前进行,评估结束后对癌痛病人按照欧洲癌痛阿片类药物镇痛指南用药[8]。对中重度癌痛病人,根据其个体用药差异情况选择不同的镇痛药物,如:吗啡、羟考酮、曲马多及芬太尼透皮贴等。以动态NRS≤3分为癌痛控制满意标准。对阿片类药物用量的统计采用每日等效口服吗啡剂量 (morphine equivalent daily dose, MEDD),即将随访期内所用阿片类药物总量换算成吗啡等效剂量总量(mg) /总使用时间 (d),其换算公式为曲马多(口服)200 mg/d = 羟考酮(口服)30 mg/d = 芬太尼(贴剂)6 mg/d = 吗啡(静脉/皮下)20 mg/d = 吗啡(口服)60 mg/d。
(2)基因型测定:抽取研究对象外周静脉血样2 ml,DNA提取采用树脂型TM基因组DNA提取试剂盒(上海赛百盛)。PCR引物设计由上海生工公司设计,引物序列:正向引物5'-GTGGTCCTTTGGACAACAGC-3',反向引物5'-TGGTTGA GGGAGTATCACAGAA-3'。PCR反应体系同普通PCR扩增,反应条件为95℃预变性4 min,然后进行35个循环(95℃变性30 s、60℃退火30 s、72℃延伸30 s),72℃终末延伸10 min,扩增产物长为477 bp。将PCR产物用限制性核酸内切酶CviQI进行酶切,酶切反应体系为 PCR产物10 μl,10 ×buffer 5 μl,酶 1 μl,ddH2O 34 μl,总体积为 50 μl,此反应体系置于25℃的水浴箱中酶切2 h,酶切后片段长度分别为144 bp和333 bp。反应终止后用2%琼脂糖凝胶进行电泳,电压120 V,时间45 min,紫外线凝胶成像分析系统进行基因分型(见图1)。随机抽取不同基因型DNA标本的PCR产物寄送上海生工公司进行测序(见图2),以验证PCRRFLP方法基因型鉴定的准确性。

图1 rs6746030位点基因型凝胶电泳图谱Fig.1 Rs6746030 genotype gel electrophoresis

图2 rs6746030位点基因型测序图Fig.2 Genotype sequencing diagram of rs6746030
3.统计学分析
采用SPSS 21.0 软件进行数据分析。计数资料采用X2检验,分析癌痛发生相关影响因素采用logistic回归模型,结果以比值比(odds ratio, OR)和95%可信区间(95% CI)来表示,基因型间阿片类药物用量的比较采用Mann-Whitney检验,所有P值为双侧检验,以P< 0.05为差异有统计学意义。
结 果
1.Rs6746030位点的基因型及等位基因频率分布
三组rs6746030位点基因型和等位基因的频率分布均符合经Hardy-Weinberg遗传平衡(见表1),表明本研究的三组抽样群体均为平衡群体,具有可比性。对无痛组和对照组基因型频率及等位基因频率分别进行X2检验,差异均无统计学意义。

表1 rs6746030位点基因型及等位基因频率分布[n (%)]Table 1 Distributions of genotype and allele frequency of rs3746030 [n (%)]
2.SCN9A基因rs6746030多态性与肺癌疼痛之间的相关性
将全体肺癌病人作为整体进行分析,把本研究中可能干扰肺癌病人疼痛发生的所有混杂因素包括性别、年龄、病理分型(腺癌、鳞癌、小细胞癌和其他)、TNM分期(III-II期与III-IV期)及基因型(GG与GA+AA)等对肺癌疼痛发生的影响分别进行单因素分析,结果显示肺癌疼痛的发生与TNM分期和基因型有显著相关性(P< 0.05,P< 0.001),而性别、年龄、病理分型均无差异(见表2)。
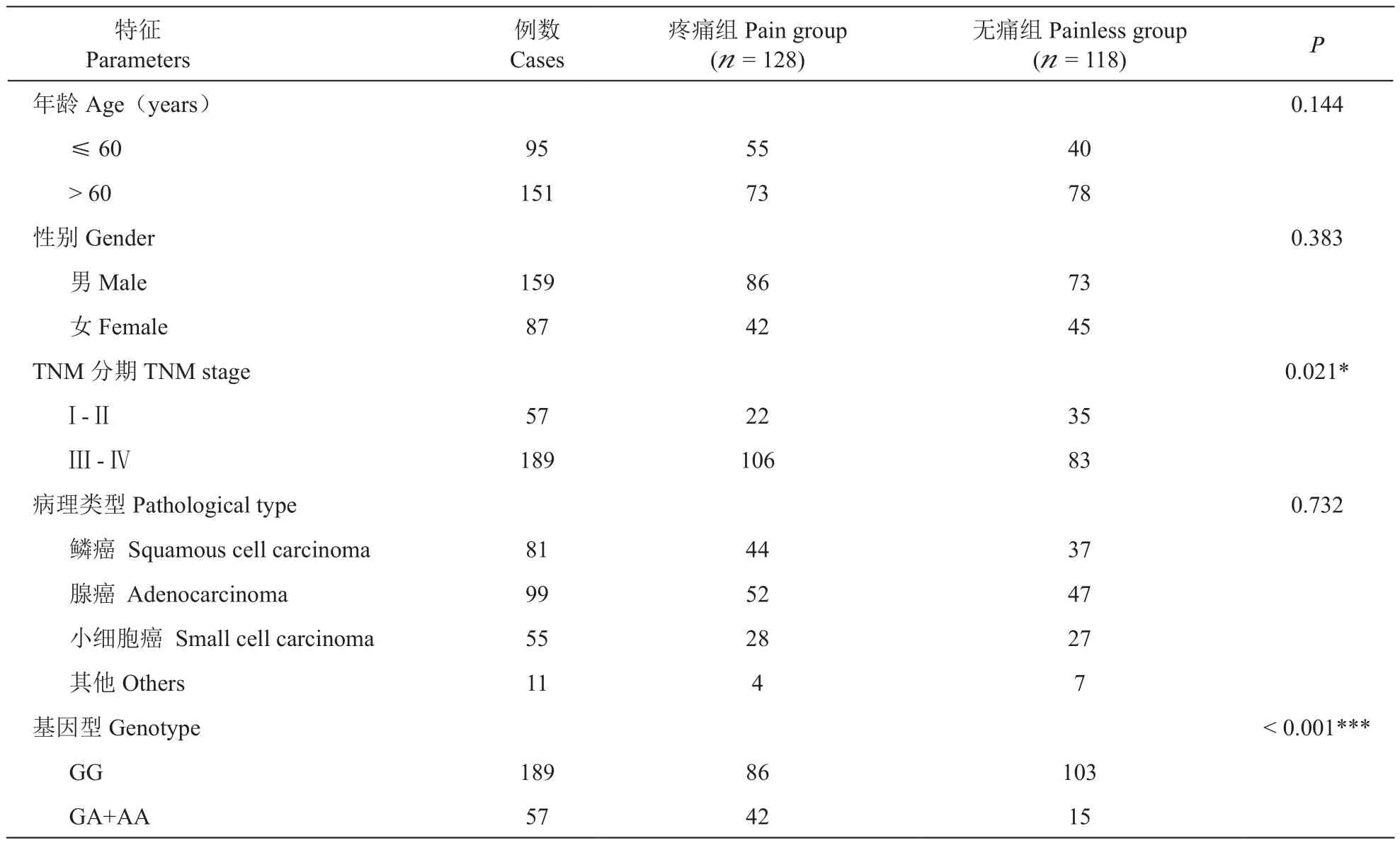
表2 影响肺癌疼痛发生的临床病理特征单因素分析Table 2 Univariate analysis of clinicopathologic parameters of pain susceptibility in patients with lung cancer
再将TNM分期与基因型纳入多因素logistic回归分析,对肺癌疼痛组与无痛组进行比较发现,基因型GA/AA是肺癌疼痛发生的独立危险因素(P<0.001,OR= 3.695, 95%CI = 1.883-7.253),TNM分期中III-IV期(P= 0.009,OR= 2.339, 95%CI =1.235-4.431)肺癌疼痛发生风险显著增高(见表3)。

表3 肺癌疼痛发生影响因素的多因素logistic回归分析Table 3 Multivariate logistic regression analysis of the factors of pain susceptibility
对疼痛组III-IV期的病例按照疼痛程度(轻度、中度和重度)进行分组来比较基因型分布与肺癌疼痛程度之间的差异,结果发现基因型分布与肺癌疼痛程度差异无统计学意义(见表4)。

表4 不同疼痛程度rs6746030位点基因型分布[n (%)]Table 4 Distributions of rs6746030 genotype in patients with different pain levels [n (%)]
3.SCN9A基因rs6746030多态性与阿片用药量之间的关系
选取疼痛组Ⅲ-Ⅳ期且使用阿片类镇痛药物的病例共79例,所有阿片类药物用量换算采用MEDD。采用Mann-Whitney检验,发现中度疼痛组和重度疼痛组不同基因型病人24 h阿片类药物用量均无统计学差异(见表5)。

表5 中、重度疼痛病人不同基因型间阿片类药物用量比较Table 5 Comparisons of opioid doses among different genotypes of moderate and severe pain patients
讨 论
随着分子生物学技术的迅速发展,从基因水平对疼痛的研究日趋热门化。越来越多与疼痛相关的基因被发现并证实,包括参与痛觉传递及调制相关的重要离子通道基因、神经递质系统基因及与疼痛治疗相关的药物代谢基因等[9~11]。VGSCs是细胞兴奋性的基础,在生物体内广泛的分布。VGSCs的表达异常可能与炎性痛、神经病理性痛和癌痛等多种慢性痛的发病机制相关[12,13]。SCN9A基因负责编码电压门控钠通道Nav1.7的α亚基,其位于2号染色体长臂上24区,其核苷酸序列由一个开放的读码框架组成,该读码序列包含有113.5kb碱基,共26个外显子,编码1 977个氨基酸(约225kD)[14]。目前发现的Nav1.7的突变点约有29个,多数与疼痛性疾病密切相关[4~6,14]。SCN9A-rs6746030 位于 18 号外显子区,其上的碱基G突变为A时,将导致Nav1.7第1 150处的氨基酸由精氨酸变为色氨酸(R1150W)。Reimann等人发现SCN9A-rs6746030基因多态性与神经病理性痛病人的疼痛严重程度相关,带有A等位基因的个体,其C类神经纤维兴奋性提高而痛阈降低[15]。此外,在对人和小鼠的研究中发现Nav1.7不仅参与电活动的传导,而且是阿片样物质活性的调节剂,但是对其具体发生机制尚不清楚[16]。因此本研究对SCN9A-rs6746030基因多态性与肺癌疼痛发生的相关性及其对阿片类药物用量的影响进行了探讨。
研究发现,中国汉族人群SCN9A-rs6746030位点基因型频率GG/GA为0.906/0.094,等位基因频率G/A为0.953/0.047,与PubMed (ss91428158)上公布的亚洲人群基因型频率GG/GA为0.854/0.146,等位基因频率G/A为0.927/0.073,两者间分布无明显差异。此外,研究还发现无痛组与对照组间基因型及等位基因的频率分布差异均无统计学意义,因此暂不认为SCN9A-rs6746030的基因多态性与肺癌的易感性相关,以此进一步分析其与肺癌疼痛的发生是否相关。
有研究表明癌痛发生可能与年龄、性别、疾病阶段和合并症等因素相关[17]。本研究对肺癌疼痛的发生可能存在的混杂因素如性别、年龄、病理类型、TNM分期及基因型等进行了单因素和多因素logistic回归分析,结果发现基因型GA/AA可能是肺癌疼痛发生的独立危险因素之一。Greenbaum等人发现rs6746030位点的突变可能会增加帕金森病人的疼痛风险[18]。近年来也有研究发现SCN9A基因多态性与间质性膀胱炎/膀胱疼痛综合征、骨关节炎和术后疼痛的发生等[12,13,19]相关,与本研究结果相一致。通过电生理学方法,Reimann等研究者观察到这种功能性突变显著增加了钠通道对电和化学刺激的敏感性[15],而且影响疼痛信号背根神经节神经元的发射[20],但SCN9A基因多态性对疼痛感知、疼痛敏感性及疼痛易感性的详细作用机制仍有待进一步研究。此外,本研究通过logistic回归分析发现TNM分期也是影响肺癌疼痛发生一个独立危险因素,此结果与国外的研究相一致[17,21]。
目前Amgen,Pfizer和Convergence Pharmaceuticals等药物公司正在研究Nav1.7抑制剂来抑制或减轻疼痛,但由于这种抑制剂可能会干扰离子通道的其他亚型,从而对心脏的电生理活动产生致命性的冲击及中枢神经系统的毒副作用,使其药物研发进程缓慢[22]。Cox等人在Nature上报道了SCN9A基因突变引起罕见的先天性无痛症,且突变个体先天失去痛觉,但机体的其它功能完全正常[6]。因此从基因水平上研究钠离子的镇痛作用意义重大。Minett等人研究发现Nav1.7无效突变体在先天性无痛症相关的镇痛作用中增强了阿片样物质的信号传导[16]。而本研究分析了Ⅲ和Ⅳ期肺癌疼痛病人rs6746030位点多态性对阿片类药物用量的影响,结果未发现有差异,但由于本研究入组的样本量有限及存在性别、年龄、体重等干扰因素,导致此结果的准确性还有待进一步研究证实。
综上所述,SCN9A基因多态性可能成为影响癌痛发生的因素之一,但在SCN9A基因多态性与阿片类药物镇痛剂量的研究中未发现相关性,上述结果还需大样本、多中心的广泛深入研究加以验证。由于癌症病人疼痛的发生存在个体差异,未来的研究应针对阿片类镇痛药的不同类别的反应性是否也是由基因决定的,以便对癌痛病人制定个体化医疗方案。

