神经病理性疼痛大鼠母爱行为对子鼠炎性痛及下丘脑催产素表达的影响*
卢 枫 杨 勇 鄢建勤 钟 涛 邹望远 郭曲练
(中南大学湘雅医院麻醉科,长沙 410078)
慢性神经病理性疼痛不仅损害人的生理机能,而且影响人的心理情绪。各种研究表明,慢性疼痛经常引起与情绪相关的异常行为,如焦虑、抑郁[1]。而孕期较重的应激会使子代出现适应不良的行为改变[2]。另外母亲对子代的影响除了与孕期生理状况相关外,还与出生后对子代的照顾行为有密切联系[3]。出生后良好的母爱行为会对子代的行为产生有益的影响,而出生后受到虐待和忽视的子代成年后易出现焦虑等精神障碍和多病等躯体疾患[4]。我们的前期研究也表明,患有慢性神经病理性疼痛的母鼠因母爱行为的改变,其子代会产生焦虑抑郁等负面情绪[5]。
既往研究发现孕期母亲的应激造成子代神经发育和行为改变与母亲下丘脑-垂体-肾上腺皮质(HPA)轴的活化有关[6]。而且母鼠的母爱行为与下丘脑视上核的催产素(oxytocin, OT)表达相关,各种原因造成的母爱行为减退大多直接或间接与OT表达下降有关[7]。
因此,本文推测患有神经病理性疼痛的母鼠可能会对内分泌系统造成严重的影响,不仅影响胎鼠的发育,还会影响母爱关怀行为[8],从而使子代在疼痛感知和情绪反应方面均出现障碍。但是,迄今为止鲜有神经病理性疼痛在代间影响的报道。因此本研究将神经病理性疼痛大鼠进行分组配对交换喂养,观察其子鼠青年期的基础痛阈、炎性痛和应激状况与正常子鼠之间是否存在差异,从而探讨神经病理性疼痛的代间影响。
方 法
1.实验动物
健康成年SD大鼠,体重200~250 g,由中南大学动物学部提供且通过动物伦理学部审批(审批号201707898)。在清洁环境中饲养,每大笼装同性别大鼠3只,受孕成功后单笼饲养。饲养温度控制在20~23℃,提供12 hD/12 hL光照,自由摄食饮水,无强光和噪音刺激。实验过程中采取一切措施尽量减少动物的痛苦和恐惧。
2.仪器设备和试剂
7370热痛仪来自意大利UGO公司;2390电子VonFrey测痛仪来自美国IITC公司;多功能酶标仪来自美国thermo-fisher公司;甲醛试剂购自庆北碚化学试剂厂;大鼠CRH ELISA试剂盒和COR ELISA试剂盒购自美国RB公司。
3.实验分组
健康成年SD大鼠48只,体重200~250 g,雌雄各半。雌雄大鼠采用随机数字表法各随机取12只,参照Bennett文献[9]介绍的方法,采用坐骨神经慢性缩窄性损伤 (CCI) 法制备神经病理性疼痛模型。于模型制备后10 d,大鼠进行配对。将大鼠随机分为四组:CCI雄性(C1组,n= 12)、CCI雌性(C2组,n= 12)、假手术雄性(S1组,n= 12)、假手术雌性(S2组,n= 12)。以左坐骨神经结扎为基础,建立神经病理性疼痛的CCI模型。假手术组仅暴露出左后肢坐骨神经,但不结扎。四组大鼠在模型制作后10 d按照C1C2组和S1S2组配对,每只母鼠确定受孕后单笼饲养,在其分娩后即刻将C2组和S2组所生的F1代采用随机数字表法各分为2小组,即共分为:FC2组和FC2’组、FS2组和FS2’。其中FS2’组与FC2’组F1代子鼠在出生后即互换喂养,FC2组和FS2组仍由原母鼠喂养。所有F1代子鼠由选定的母亲喂养至21 d后断奶,单独饲养至30 d时进行实验[10]。
4.亲代大鼠母爱行为检测
本研究采用双盲法检测母鼠分娩后的回收与舔仔行为比较各组母鼠的母爱行为差异。事先计算好怀孕大鼠的预产期,在估计的预产期日内将孕鼠置于透明玻璃观察笼中,用监控系统全程监视大鼠分娩过程,待大鼠分娩结束后,操作者戴薄膜手套将母鼠与仔鼠分开,1 h后将四只仔鼠放在透明玻璃观察笼的四个角落,然后将母鼠放入,摄录机记录1 h,观察并记录母鼠自放入后至开始回收仔鼠的时间(回收潜伏期),以及从回收开始至将全部四只仔鼠收集结束的时间(回收总时间);观察并记录母鼠自放入笼中至开始舔舐第一只幼仔的时间(舔仔潜伏期),以及整个舔仔过程的总时间(舔仔总时间),取每只大鼠的相应时间平均值进行比较。
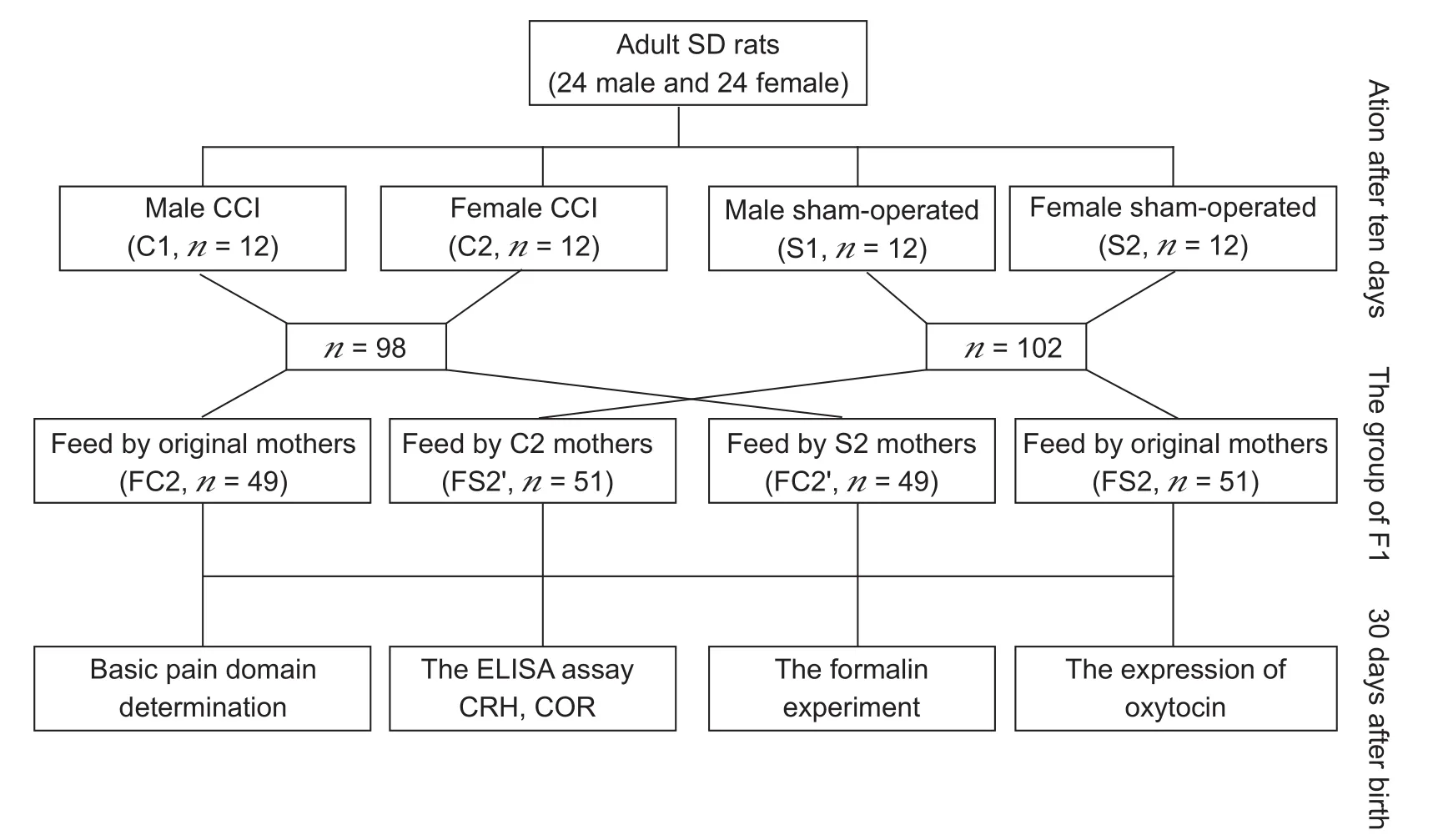
图1 实验方案的组织设计Fig.1 The organization design of the experimental scheme
5.机械痛阈(paw withdrawal mechanical threshold,PWMT) 和热痛阈(paw withdrawal thermal latency,PWTL)
采用2390型电子Von Frey机械痛阈测定仪(UGO公司,意大利)测定子鼠机械痛阈。将子鼠放入带有金属网眼的支撑垫上,周围覆盖20 cm×20 cm的透明玻璃罩,适应环境10 min后,将探针直接垂直匀速作用于左后足掌面正中皮肤,并逐渐加压,记录诱发子鼠缩足反应时的压力(g)。每只大鼠足掌反复测量5次,每次间隔5 min,取平均值为机械痛阈。
采用7370型红外热痛阈测定仪(IITC公司,美国)测定子鼠热痛阈。将子鼠放入厚约3 mm的透热玻璃板上,顶端开口20 cm×20 cm的透明玻璃罩封闭,待适应10 min后进行测定。红外光源正对左后足底,记录诱发子鼠缩足反应的时间(s)。每只大鼠足掌反复测量5次,每次间隔5 min,取平均值为热痛阈。
6.福尔马林炎性痛
按照Dubuisson等[11]方法进行福尔马林炎性痛模型制作,所有F1代子鼠均在左后足底注射30 μl 的3%甲醛,依据Davidson等的方法在注射后1 h内对两相反应进行评分,每5 min 一次。计算大鼠痛级均 数 (pain intensity rating, PIR):PIR = (T1+2×T2+3×T3) /5×60,其中T1、T2、T3分别代表出现1级、2级和3级反应的总时间。
7.血清CRH,COR测定
所有子鼠在行为学实验结束后均腹腔注射水合氯醛900 mg/kg,深麻醉下打开胸腔,蚊氏钳轻轻夹起心脏,用2.5 ml无菌注射器从右心耳处刺入,缓慢抽取2.0 ml 血液,注入促凝管中,室温静置30 min。3 000转/min离心20 min,然后小心吸出上清,转移至EP管内备用。严格按照CRH、COR ELISA试剂盒(RB公司,美国)的说明书进行操作,检测血清中CRH、COR。
8.免疫组织化学检测视上核催产素表达
冰冻切片取子鼠下丘脑视上核区脑片,将过氧化氢处理后的脑片在PBS中震荡清洗,10 min × 3次;5%小牛血清,室温孵育2 h;兔抗鼠OT(1:2 000)单克隆抗体,4℃冰箱内过夜;PBS溶液,10 min × 3次;羊抗兔二抗(1:50),室温孵育2 h;PBS溶液内进行漂洗,5 min×3次;连续贴片,在无尘通风的干燥环境内放置6 h,使其充分晾干;50%、75%,90%,95%、100%脱水,每次3 min;二甲苯瓶透明,封片;显微成像系统中选择视上核的位置进行拍片。统计每只大鼠6张脑片中视上核阳性细胞的总数,取均值代表每只大鼠脑片的细胞数,最后取每组大鼠阳性细胞数的均数进行比较。
9.统计学分析
所有计量资料均以均数±标准差(±SD)表示,用统计软件SPSS 16.0进行数据分析,其中组间比较采用单因素方差分析(ANOVA),两组间的比较采用LSD和SNK-q检验,以P< 0.05为差异有统计学意义。
结 果
1.亲代母鼠母爱行为比较
与假手术组母鼠喂养的FS2组或FC2’组相比,神经病理性疼痛组母鼠喂养的FC2组或FS2’组回收潜伏期、回收总时间和舔仔潜伏期时间延长,舔仔总时间缩短(P< 0.05或0.01)。FC2组与FS2’组、FS2组与FC2’组母鼠回收潜伏期、回收总时间、舔仔潜伏期和舔仔总时间比较差异无统计学意义(P> 0.05,见表1)。
表1 四组亲代母鼠回收仔时间和舔仔时间比较(±SD)Table 1 Comparison of the time of gather and lick behaviors among all the mother rats (±SD)

表1 四组亲代母鼠回收仔时间和舔仔时间比较(±SD)Table 1 Comparison of the time of gather and lick behaviors among all the mother rats (±SD)
*P < 0.05,**P < 0.01,与 FS2 相比,compared with FS2;#P < 0.05,##P < 0.01,与 FC2’组相比,compared with FC2’.
舔仔总时间(s)The total time in licking(s)FC2 246.2±42.3*# 412.8±46.4*# 332.5±26.4*# 311.5±30.7**##FS2’ 233.9±36.4*# 453.5±38.9*# 300.8±22.7**# 296.3±33.4**##FS2 153.7±29.5 322.5±30.6 69.4±10.8 638.5±32.2 FC2’ 144.8±38.6 308.6±33.5 86.7±12.5 608.9±37.6组别Group回收潜伏期(s)Gathering incubation period(s)回收总时间(s)The total time in gathering(s)舔仔潜伏期(s)Licking incubation period(s)
2.子代基础痛阈
四组F1代子鼠机械痛阈和热痛阈结果相似,无论是在自己生母的喂养下还是交换母鼠喂养下,四组子鼠的基础痛阈均相似,结果无统计学差异(见表2)。
表2 四组子鼠机械痛阈和热痛阈比较(±SD)Table 2 comparison of mechanical and thermal pain threshold among four groups of F1 rats (±SD)

表2 四组子鼠机械痛阈和热痛阈比较(±SD)Table 2 comparison of mechanical and thermal pain threshold among four groups of F1 rats (±SD)
组别Group热痛阈 (s)Thermal pain threshold (s)FC2 20.9±4.0 11.8±2.0 FS2’ 20.1±6.0 11.2±2.0 FS2 20.0±5.0 11.1±2.5 FC2’ 21.2±4.0 12.0±2.2机械痛阈 (g)Mechanical pain threshold (g)
3.子代福尔马林实验
所有F1代子鼠左后足注射福尔马林后均出现典型的Ⅰ相、静息期和Ⅱ相反应,在Ⅰ相时所有子代大鼠痛级均数(PIR)两两之间比较无统计学差异,而在Ⅱ相时养母为神经病理性疼痛的FC2、FS2’组子鼠PIR明显高于养母为假手术组大鼠的FS2、FC2’组(P< 0.05 或P< 0.01);而相同养母的子鼠之间PIR无差异(见表3)。
表3 四组F1代子鼠左后足注射福尔马林后PIR评分(±SD)Table 3 Four groups of F1 rats were injected with the PIR after the left hind foot injection of formalin (±SD)

表3 四组F1代子鼠左后足注射福尔马林后PIR评分(±SD)Table 3 Four groups of F1 rats were injected with the PIR after the left hind foot injection of formalin (±SD)
*P < 0.05,**P < 0.01 与 FS2 组比较,compared with FS2;#P < 0.05,与 FC2’组比较,compaered with FC2’.
Ⅱ相II phase reaction FC2 2.11±0.17 28.73±0.45**#FS2’ 2.15±0.24 26.56±0.38*#FS2 1.95±0.31 20.96±0.3 FC2’ 2.03±0.26 21.65±0.22组别Group I相反应I phase reaction
4.子代血清应激激素CRH和COR含量检测
四组子鼠血清中应激激素CRH和COR含量差异明显,养母为神经病理性疼痛的FC2、FS2’两组子鼠激素含量明显高于养母为假手术组的FS2、FC2’组子鼠(P< 0.05)。而相同养母的子鼠之间激素含量无差异(见表4)。
表4 四组F1代大鼠由各自母亲喂养30 d后血清中CRH、COR的比较(±SD)Table 4 The comparison of CRH and COR in the blood of the four groups of F1 rats who were raised by their mothers (±SD)

表4 四组F1代大鼠由各自母亲喂养30 d后血清中CRH、COR的比较(±SD)Table 4 The comparison of CRH and COR in the blood of the four groups of F1 rats who were raised by their mothers (±SD)
*P < 0.05,与相同指标的FS2组比较,compared with group FS2;#P < 0.05,与相同指标的FC2’组比较,compared with group FC2’.
组别Group CRH (pg/ml) COR (ng/ml)FC2 36.42±3.79*# 107.53±5.21*#FS2’ 37.53±4.31*# 104.38±4.69*#FS2 26.05±3.81 85.22±4.17 FC2’ 28.43±2.96 87.66±3.98
5.子代下丘脑视上核OT的表达
四组子鼠下丘脑视上核OT的表达也有明显差异,神经病理性疼痛母鼠喂养的子代其视上核OT表达明显低于假手术组母鼠喂养的子代,即FC2和FS2’组表达量低于FC2’和FS2组(P< 0.05,见图2,仅显示右侧视上核,左侧结果相似)。
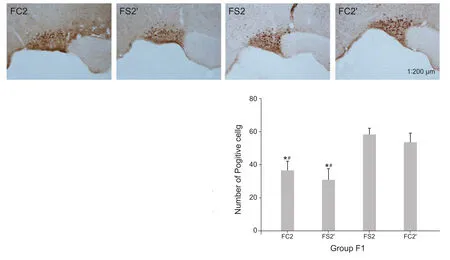
图2 四组F1代子鼠右侧下丘脑视上核OT表达(×200)四组F1代子鼠在各自母鼠或交换喂养30 d后,右侧下丘脑视上核OT的表达,其中棕色为OT阳性细胞(左侧结果相似)。柱状图为各组阳性细胞数比较。*P < 0.05,与 FS2 组相比;#P < 0.05,与 FC2’组相比Fig.2 The right hypothalamic nucleus oxytocin expressed in four group of F1 rats (×200)After four groups of F1 rats are feed by their mother or crossed feed in 30 d, the expression of OT in right hypothalamus supraoptic nucleus, the brown is OT positive cells (the left side results are similar).The graph shows the number of positive cells in each group.
讨 论
以往的研究表明:机体通常对于危及生命的不利刺激通过大脑的处理作为应激对待,根据威胁的特点调节机体在行为和生理上做出反应,产生战斗、逃跑、绝望和对伤害进行调节的改变。同时会调节自主神经系统、神经内分泌系统和免疫系统的的活动状态,从而使机体对伤害或使大脑对应激源发生适应性反应。慢性疼痛会造成一种病理性应激,使上述三个系统之间发生复杂而广泛的相互作用,从而持续扰乱免疫系统,激活神经内分泌系统,导致大量应激激素的释放和细胞因子谱发生明显改变[12,13]。
机体对应激反应首先与下丘脑-垂体-肾上腺(HPA)轴的激活相关[14]。该轴激活时下丘脑释放促肾上腺皮质激素释放激素(CRH)并使肾上腺释放皮质醇(COR)。本研究发现,虽然母鼠发生神经病理性疼痛喂养的子鼠其基础痛阈无明显差异,但其循环系统中HPA轴的产物CRH和COR浓度明显高于母鼠为假手术组喂养的子鼠。有研究表明孕期处于应激状态的母鼠其子代循环中糖皮质激素的水平较高,糖皮质激素可以从乳汁中分泌,而当子鼠由神经病性疼痛母鼠喂养时,其接受应激状态母鼠的高糖皮质激素乳汁可能致其体内糖皮质激素水平上升,而糖皮质激素受体则发生下调[15]。这表明神经病理性疼痛母鼠喂养的子鼠其HPA轴处于持续激活状态,即这些子鼠一直处于慢性应激状态。这种应激状态可能严重影响了子鼠的神经内分泌免疫系统,这种影响在正常情况下可能并不改变子鼠对生理性疼痛的感知,但在伤害性刺激发生后可能促使这三个相互关联的系统调节失衡。这也从甲醛炎性痛实验结果中可以看出,I相痛级均数(PIR)各组无统计学差异,而在II相迟发伤害性疼痛反应评分中,神经病理性疼痛母鼠喂养的子鼠PIR明显高于正常母鼠喂养的子鼠,表明神经病理性疼痛母鼠喂养的子鼠中枢敏化增强,对外界新发疼痛的感知也强于正常母鼠喂养的子鼠,从而可能使得本不会持续化的急性疼痛转变为慢性疼痛。
既往研究发现,动物的母爱行为与其下丘脑视前区催产素及催产素受体(OTR)表达相关[16]。而有研究表明脑内相关核团的OT 参与了痛行为调制的复杂过程,引起痛行为反应的阈值增加[17]。本研究也发现,在经过神经病理性疼痛母鼠喂养的子鼠,无论其生母是否发生神经病理性疼痛,这些子鼠青年期视前区催产素的表达均明显低于正常母鼠喂养的子鼠。因此,亲代神经病理性疼痛对子代情感及疼痛感知的影响可能独立于孕期的遗传因素,而与母爱行为本身有关;子代痛行为的改变与其视上核催产素的表达下调相关。
本研究发现,在经过神经病理性疼痛母鼠喂养的子鼠,无论其母亲是否发生神经病理性疼痛,这些子鼠青年期视前区OT的表达均明显低于正常母鼠喂养的子鼠,但其具体调控机制尚不清楚,有待进一步研究。综上所述,神经病理性疼痛大鼠的母爱行为虽然对子鼠基础痛域无明显影响,但会增强子鼠对新发生疼痛的感知,这些行为改变可能与子鼠HPA轴应激激素的升高及下丘脑催产素表达的下调有关。

