枫杨叶提取物抑制金黄色葡萄球菌的机制研究
邢梦雨 夏道宗 田崇梅 张晓熙 郭璐 赵鑫钰
浙江中医药大学 杭州 310053
枫杨(Pterocarya stenoptera,P.stenoptera)为胡桃科枫杨属植物,味辛、温,有小毒,具有消肿止痛、解热杀虫的功效,其叶与树皮在民间常用作传统外用中药,主治湿疹、过敏性皮炎以及各类真菌性皮肤病和细菌性脓疮[1]。研究证实,枫杨的各部位对多种细菌如大肠杆菌、金黄色葡萄球菌、链格孢菌、卡拉双球菌等均有抑制作用[2-4]。其中,金黄色葡萄球菌(Staphylococcus aureus,S.aureus) 是一种广泛存在于自然界中的高致病性常见菌,能够引起食物中毒、脑膜炎、心内膜炎和术后伤口感染等多种感染性疾病[5-6]。目前关于枫杨对金黄色葡萄球菌的抑菌机制的相关研究较少,本研究拟以枫杨叶为对象,采用纸片扩散法筛选枫杨叶不同溶剂提取物的抑菌效果,并系统研究抑菌规律及相关作用机制,以期为开发新型安全高效的植物源性抗菌剂以及对枫杨叶的深入利用与加工提供参考。
1 材料和方法
1.1 菌株 金黄色葡萄球菌菌株(ATCC 25923)由浙江中医药大学基础医学院提供,实验所用为第3代,活化于LB培养基。LB培养基由胰蛋白胨10g、酵母提取物5g、氯化钠5g、无菌双蒸水1 000mL配制,调整 pH 为 7.2~7.4。
1.2 药品和试剂 枫杨叶采摘于钱塘江畔,经浙江中医药大学陈孔荣副教授鉴定为胡桃科枫杨属植物枫杨的树叶。酵母浸膏购于广东环凯微生物科技有限公司(批号:3206071);胰蛋白胨、琼脂粉均购于青岛高科园海博生物技术有限公司(批号:20180220、20180503);DL5000DNA Marker 购 于TaKaRa公司(批号:A1901A);二甲基亚砜(dimethyl sulfoxide,DMSO) 购于 BioFroxx公司 (批号:EZ1609C224);氨苄青霉素钠与盐酸四环素购于上海生工公司(批号:E425KA8318、E410KA8176);LIVE/DEAD BacLight Bacter ial Viability Kit购于Thermo Fisher公司(批号:1937182);细菌基因组DNA提取试剂盒购于北京百泰克生物公司(批号:DP2001);溶菌酶购于 Sigma公司(批号:SLBW4358)。
1.3 主要仪器 BSA224S-CW分析天平购自赛多利斯科学仪器有限公司产品;Synergy H1多功能微孔板检测仪购于美国Bio Tek公司;5427R高速离心机购于德国Eppendorf公司;SU-8010N型场发射扫描电子显微镜为日本HITACHI公司产品;Ti-S型倒置荧光显微镜购于日本Nikon公司;GenoSens 1850凝胶成像仪购于上海勤翔公司。
1.4 方法
1.4.1 枫杨叶提取物的制备 干燥枫杨叶粉碎过40目筛,称取一定质量,按1:10比例加入水或90%乙醇,室温浸泡20min后,60℃热回流法提取2次,抽滤,合并滤液,旋转蒸发至适量,冷冻干燥制成冻干粉,置干燥器内保藏待用。
1.4.2 菌液的制备 为确保使用相同浓度的菌液,在评估抗菌活性之前,于600nm处测定吸光度,OD600=0.5相应的菌种浓度为1.0×108CFU·mL-1。将菌种重悬于LB培养基中,使用前稀释至待用浓度。
1.4.3 抑菌活性筛选 采用纸片扩散法筛选枫杨叶不同溶剂提取物的抑菌活性[7]。称取不同溶剂提取的冻干粉50mg,分别加入含有体积分数5%DMSO的0.85%氯化钠溶液0.5mL,超声溶解后以0.22μm的无菌滤膜滤过,加入100个直径6mm的无菌滤纸片,平铺于无菌平板内,37℃烘干备用,每个纸片含提取物500μg。以含量为20μg/片的盐酸四环素与氨苄青霉素钠纸片作为阳性对照,无菌双蒸水作为空白对照。吸取1.0×108CFU·mL-1的菌液100μL涂布于平板上,以涂布棒涂布均匀,制成含菌平板。将含药纸片贴于含菌平板表面,37℃培养箱内孵育24h,使用游标卡尺测量抑菌圈直径。
1.4.4 最小抑菌浓度(minimum inhibitory concentration,MIC)与最小杀菌浓度(minimum bactericidal concentration,MBC)的测定 参照Othman等[8]方法并稍作修改。使用96孔板,将枫杨叶醇提取物以LB培养基对半稀释,并将100μL提取物溶液与100μL菌液混合,使提取物终浓度为 31.25~1 000mg·L-1,金黄色葡萄球菌终浓度为1.0×105CFU·mL-1,以盐酸四环素与氨苄青霉素钠1.56~50mg·L-1作为阳性对照。DMSO体积分数最高为5%,已证明对微生物生长无影响。将96孔板密封于37℃培养箱中培养24h,无可见细菌生长的孔(OD增量<0.1)对应的最低提取物浓度即为MIC。将每孔等分试样涂布在LB固体培养基上,在37℃培养箱中培养24h,确定存活细菌数量。存活细菌数量至少减少3个数量级,相应的最低提取物浓度即为MBC。
1.4.5 抑菌曲线的绘制 采用生长曲线法测定枫杨叶醇提取物对细菌生长的影响[9]。将对数生长期的金黄色葡萄球菌按照1.0×106CFU·mL-1的浓度接种于含有125mg·L-1(1×MIC)、250mg·L-1(2×MIC)和500mg·L-1(4×MIC)的枫杨叶醇提物及空白培养基中振荡培养。每隔2h取菌悬液测定其600nm波长处的吸光度,绘制生长曲线。
1.4.6 扫描电子显微镜观察菌体形态 以终浓度250mg·L-1(2×MIC)的枫杨叶醇提取物和0.85%氯化钠溶液分别于37℃处理金黄色葡萄球菌菌液24h,根据倪方方等[10]的方法制作扫描电镜标本。将0.85%氯化钠溶液处理的菌体设为空白对照组,以pH=7.2的PBS洗涤并收集空白对照组和枫杨叶醇提取物处理后的菌体,2.5%戊二醛4℃固定过夜。将固定的菌体以PBS洗3次,1%锇酸固定20min。依次经50%、75%、90%、100%乙醇和 50%、75%、90%、100%叔丁醇梯度脱水,真空干燥后喷金包覆。使用场发射扫描电子显微镜在1.5kV的加速电压下检测。
1.4.7 荧光显微镜分析细胞膜损伤 使用荧光显微镜观察枫杨叶醇提取物对金黄色葡萄球菌细胞膜的损伤作用[11]。以0.85%氯化钠溶液溶解枫杨叶醇提取物,调整终浓度为125mg·L-1(1×MIC)和500mg·L-1(4×MIC)。取对数生长期的金黄色葡萄球菌,接种终浓度为1.0×108CFU·mL-1,各组分别于37℃孵育0.5、24h,根据试剂说明书进行SYTO9和碘化丙啶(propidium iodide,PI)荧光染色,室温避光孵育15min后,吸取5μL样品固定于载玻片上,使用U-RFL-T汞灯作为激发源,并通过SYTO9(450~480nm)和PI(510~550nm)两个单独发射滤光器收集荧光信号,200倍荧光显微镜下观察,每组观察3张涂片,计算视野中绿色荧光与红色荧光的强度比RatioG/R。
1.4.8 琼脂糖凝胶电泳检测DNA损伤 金黄色葡萄球菌基因组DNA损伤检测参考Yadav等[12]的方法并稍作改动。以125mg·L-1(1×MIC)、250mg·L-1(2×MIC)和500mg·L-1(4×MIC)枫杨叶醇提取物处理金黄色葡萄球菌6h后,根据试剂盒说明书提取金黄色葡萄球菌基因组DNA,0.8%琼脂糖凝胶100V恒压电泳30min,紫外灯下观察并拍照记录。
1.5 统计学分析 应用SPSS 17.0统计软件进行统计学分析。计量资料以±s表示,多组间比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
2 结果
2.1 各组抑菌活性比较 纸片扩散实验结果提示,枫杨叶醇提取物对金黄色葡萄球菌有抑制作用,而水提取物基本无抑菌作用。进一步结果显示,枫杨叶醇提取物 MIC 为 125mg·L-1,MBC 为 1 600mg·L-1;盐酸四环素与氨苄青霉素钠的MIC均<2mg·L-1,MBC分别为 2~4mg·L-1和 12.5mg·L-1。见表 1。由于枫杨叶醇提取物对金黄色葡萄球菌的抑制效果优于水提取物,故后续研究选用醇提取物。
2.2 枫杨叶醇提取物对金黄色葡萄球菌生长的影响 空白对照组金黄色葡萄球菌培养2h后进入对数生长期,随着时间的推移,细菌数量显著增加;与空白对照组比较,各枫杨叶醇提取物处理组细菌进入对数生长期的时间延迟,培养至2h时各组OD600值均低于空白对照组,差异均有统计学意义(P<0.01)。培养至4h开始,2×MIC处理组OD600值均低于1×MIC处理组,4×MIC处理组均低于2×MIC和1×MIC处理组,差异均有统计学意义(P<0.01)。培养12h后,不同浓度枫杨叶醇提取物处理组菌量较空白对照组明显减少(P<0.01),且均进入稳定期;而空白对照组菌量在24h时仍呈增长趋势。说明枫杨叶醇提取物可以明显抑制金黄色葡萄球菌的增殖,而且抑制作用存在量效关系。见图1。
表1 各组抑菌圈与MIC、MBC比较(±s)Tab.1 Comparison of bacteriostatic diameter and MIC,MBC in each group(±s)
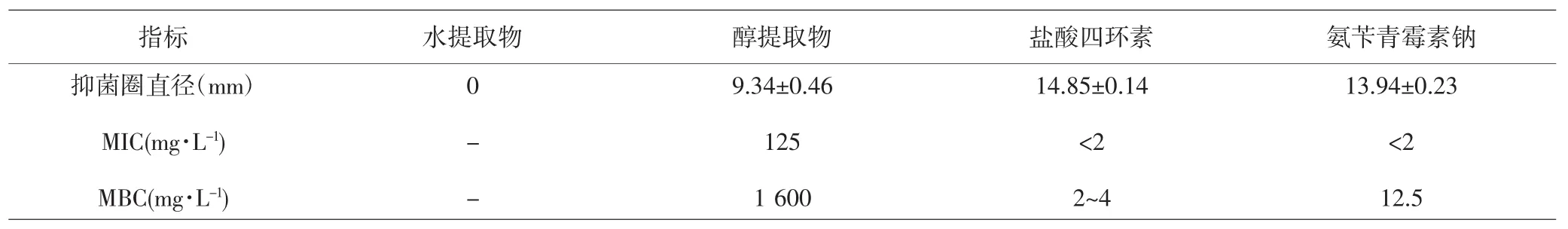
表1 各组抑菌圈与MIC、MBC比较(±s)Tab.1 Comparison of bacteriostatic diameter and MIC,MBC in each group(±s)
注:每个样本重复3次;(-)表示没有检测Note:Each treatment repeated three times;(-)represented no tested
指标 水提取物 醇提取物 盐酸四环素 氨苄青霉素钠抑菌圈直径(mm)MIC(mg·L-1)MBC(mg·L-1)13.94±0.23<2 12.5 0 - -9.34±0.46 125 1 600 14.85±0.14<2 2~4
2.3 各组金黄色葡萄球菌菌体显微形态的观察 扫描电镜观察显示,空白对照组金黄色葡萄球菌菌体饱满,形态完整。而枫杨叶醇提取物处理24h后,大部分菌体变形、塌陷,甚至发生表面溶解,形态完整性遭到了明显破坏。由此说明,枫杨叶醇提取物对金黄色葡萄球菌菌体结构具有较强的破坏作用。见图2。

图1 枫杨叶醇提取物对金黄色葡萄球菌增殖的影响Fig.1 Effect of P.stenoptera leaves alcohol extract on the growth of S.aureus
2.4 枫杨叶醇提取物对金黄色葡萄球菌细胞膜完整性的影响 SYTO9能够穿透完整的细胞膜,与核酸结合并呈现强烈的绿色荧光,而PI进入膜受损的细胞,呈现红色荧光,SYTO9和PI共存时则会出现黄色荧光,提示细胞膜破坏程度较轻[13]。空白对照组0.5h时可见大面积绿色荧光,说明空白对照组金黄色葡萄球菌细胞膜未发生明显损伤。处理24h后,红色荧光略有增加,但绿色荧光仍明显强于红色,与0.5h空白对照组比较,RatioG/R差异无统计学意义(P>0.05),说明随着处理时间的增加,空白对照组中仅有少部分细菌死亡。

图2 金黄色葡萄球菌场发射扫描电镜照片(22 000×)Fig.2 Field emission scanning electron microscope of S.aureus(22 000×)
1×MIC枫杨叶醇提取物处理0.5h后,与同时期空白对照组比较,红色荧光增加,绿色荧光仍强于红色,说明菌体细胞膜未出现明显损伤,RatioG/R差异无统计学意义(P>0.05)。处理24h后则出现黄色荧光,与24h空白对照组比较,RatioG/R差异具有统计学意义(P<0.01),说明菌体细胞膜发生损伤。4×MIC 枫杨叶醇提取物处理0.5h,黄色荧光颜色加深同时出现更多的红色荧光,与0.5h空白对照组比较,RatioG/R差异有统计学意义(P<0.01),说明更多的菌体细胞膜发生损伤。处理24h后,菌体细胞几乎完全死亡,与24h空白对照组比较,RatioG/R差异具有统计学意义(P<0.01),说明发生广泛的细胞膜损伤。见表2、图3。
2.5 枫杨叶醇提取物对金黄色葡萄球菌基因组DNA的影响 与空白对照组比较,2×MIC、4×MIC枫杨叶醇提取物作用后,金黄色葡萄球菌基因组DNA电泳条带变暗,可能由于枫杨叶醇提取物与DNA结合,从而竞争性抑制了核酸染料与DNA的结合,使DNA的电泳条带变暗;而电泳迁移增加,说明基因组DNA片段化明显,对基因组DNA造成的损伤也更严重。见图4。
表2 各组SYTO9与PI染色荧光强度比较(±s)Tab.2 Comparson of fluorescence intensity ratio of SYTO9 and PI staining in each group(±s)
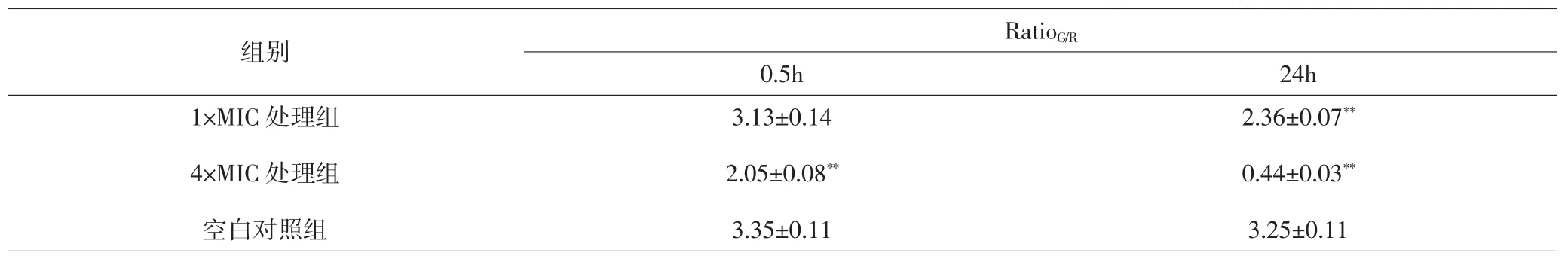
表2 各组SYTO9与PI染色荧光强度比较(±s)Tab.2 Comparson of fluorescence intensity ratio of SYTO9 and PI staining in each group(±s)
注:与同时期空白对照组比较,**P<0.01Note:Compared with blank control group of the same period,**P<0.01
组别1×MIC处理组4×MIC处理组空白对照组RatioG/R 0.5h 24h 3.13±0.14 2.05±0.08**3.35±0.11 2.36±0.07**0.44±0.03**3.25±0.11

图3 各组金黄色葡萄球菌荧光显微照片(200×)Fig.3 Epifluorescence micrograph of S.aureus in each group(200×)
3 讨论
金黄色葡萄球菌是一种高致病性革兰阳性球菌,能够引起全身及局部化脓性感染,是肺炎、心包炎、肠炎、金黄色葡萄球菌败血症等感染性疾病的重要病原体[14]。研究已证实枫杨的各部位均具有广谱抗菌作用,且枫杨叶来源方便、价格低廉,因此深入研究开发相关的植物源性抗菌剂具有较高的社会效益和经济效益。近年来,枫杨抗微生物活性研究屡见报道,但大多集中于抑菌效果研究,而对相关作用机制的研究相对较少。本研究以金黄色葡萄球菌为对象,探讨了枫杨叶不同溶剂提取物的抗菌活性以及相关的作用机制。

图4 枫杨叶醇提取物对金黄色葡萄球菌基因组DNA的影响Fig.4 Effect of P.stenoptera leaves alcohol extract on genomic DNA of S.aureus
文献报道,枫杨属植物含有醌类、萜类、甾体、黄酮类等成分[15],其中萘醌类是发挥抑菌作用的主要成分[16]。萘醌类含有苯环,分子量较大,大多具有非极性官能团,在乙醇中溶解度更好,这是醇提取物具有较高抑菌活性的基础。本实验也证实,枫杨叶醇提取物较水提取物能更好地抑制金黄色葡萄球菌的增殖,这与潘为高等[2]的实验结果一致。枫杨叶醇提取物抑菌活性更高,故后续选用醇提取物继续研究,结果表明,枫杨叶醇提取物 MIC 为 125mg·L-1,MBC>1 600mg·L-1。阳性对照药盐酸四环素与氨苄青霉素的MIC均小于2mg·L-1,盐酸四环素 MBC 为 2~4mg·L-1,氨苄青霉素MBC为12.5mg·L-1,提示枫杨叶醇提取物同四环素、氨苄青霉素均能有效抑制金黄色葡萄球菌的增殖,而且其效果具有剂量和时间依赖性。
细菌主要由细胞膜、细胞质和核糖体等组成,其中细胞膜是细菌与外界进行物质能量交换的重要媒介[17]。药物的抑菌作用主要通过破坏细菌细胞壁及细胞膜的完整性、抑制蛋白和核酸合成等方面来实现[18]。青霉素结合蛋白是位于细菌胞质膜上的蛋白质,大分子量的青霉素结合蛋白具有转肽酶及转糖基酶活性,参与细菌细胞壁的合成;小分子量则具有羧肽酶活性,与细菌分裂有关。β-内酰胺类抗生素如氨苄青霉素主要作用于菌体内的青霉素结合蛋白,抑制细菌细胞壁合成,使菌体失去渗透屏障而膨胀、裂解[19]。四环素类能增加细菌细胞膜通透性,与细菌胞内核糖体30S亚基形成可逆结合体,抑制蛋白质合成,还可通过结合线粒体70S亚基,抑制线粒体蛋白质的合成,从而起到抗菌效果[20-21]。由于抗生素长期广泛用于治疗人及动物的细菌感染,导致不断出现耐药菌株。植物源性抗菌剂异于传统抗菌剂的抗菌机制,已成为近年来的研究热点。扫描电镜观察发现,枫杨叶醇提取物处理24h后,大部分菌体变形,塌陷,甚至发生表面溶解等现象,形态完整性遭到了破坏。荧光染色结果表明枫杨叶醇提取物对金黄色葡萄球菌的抑制效应可能是通过破坏菌体细胞膜的完整性而实现的,这与本实验中扫描电镜观察结果一致。
DNA是生物体储存、复制和传递遗传信息的物质基础,在遗传信息传递、物质合成、生长发育等生物过程中起关键性作用。抗菌药物若与菌体DNA作用,会干扰菌体遗传指令的传递,影响与新陈代谢相关的物质合成,从而起到抑菌作用[22]。基因组DNA片段化是细菌衰亡的标志,若发生DNA裂解,说明细菌细胞发生凋亡。许多中药成分通过裂解细菌DNA实现抗菌活性。Anandhi等[23]发现,卷果云实甙和黄酮类化合物处理24h后,大肠杆菌、金黄色葡萄球菌和肺炎克雷伯菌均表现出明显的DNA裂解;Ahsan等[24]和Ya-dav等[25]研究发现,乌墨叶和种子提取物能损伤枯草芽孢杆菌基因组DNA,从而表现出较强的抗菌活性。还有研究发现,壳聚糖通过裂解菌体DNA从而抑制金黄色葡萄球菌的增殖[26]。本实验中琼脂糖凝胶电泳结果显示,枫杨叶醇提取物与金黄色葡萄球菌DNA结合,损伤甚至裂解DNA,从而达到抑菌效果。
综上所述,枫杨叶醇提取物能显著抑制金黄色葡萄球菌的增殖,其 MIC 为 125mg·L-1,MBC>1 600mg·L-1。抑菌机制研究结果表明,枫杨叶醇提取物能破坏金黄色葡萄球菌菌体形态,使之发生变形、塌陷,甚至表面溶解;增加细胞膜通透性,造成细菌生理功能紊乱;同时损伤甚至裂解细菌DNA,从而发挥抑菌作用。然而枫杨叶醇提取物对细菌作用是否还有其他机制参与如抑制蛋白合成、破坏细胞壁等还需要进一步研究。

