香附四物汤中阿魏酸和芍药苷的大鼠肠吸收动力学研究
毕肖林, 朱海燕, 刘陶世, 马世堂
(1.南京中医药大学,江苏 南京 210023;2.安徽科技学院,安徽 凤阳 233100)
中药多以口服途径给药,中药复方是中医临床用药的重要形式和手段。通过研究药物在体内的吸收动力学过程,明确其在体内的作用途径和机制,有助于阐明中药的科学内涵,从而指导临床合理用药。
单向灌流法,即对某一肠段进行灌流,根据肠段进出口处灌流液中药物的浓度差来考察药物在该肠段的吸收情况。大鼠在体肠灌流是目前运用最广泛的研究肠吸收的方法,因其试验条件与药物在口服给药后接触到的肠道环境近似[1-2],能较实际地反映药物的肠道吸收情况。
香附四物汤出自清代梁廉夫《不知医必要》卷四,由当归、川芎、白芍、熟地、木香、香附、延胡索等七味药组成,是治疗妇科气滞血瘀证原发性痛经的代表性方剂[3]。本试验通过建立大鼠的在体肠吸收模型,对香附四物汤中的活性成分阿魏酸及芍药苷在体内的吸收规律进行考察,有助于我们了解香附四物汤这类复方制剂在胃肠道内的吸收特性,为中药剂型的开发提供科学依据。
1 材料与方法
1.1 试验仪器
高效液相色谱仪(美国Waters有限公司)、蠕动泵(BT00-300M,保定兰格恒流泵有限公司)、旋转蒸发器(RE-52AA,上海亚荣生化仪器厂)、微量高速冷冻离心机(Thermo Micro 21R,美国Thermo科技有限公司)、T6新世纪紫外可见分光光度计(北京普析通用仪器有限公司)、十万分之一天平(New Classic MS,METTLER TOLEDO公司)、超纯水机(Direct-Q5 UV系统,美国Millipore有限公司)。
1.2 试验材料
阿魏酸对照品(中国食品药品检定研究院,含量99.6%,批号:110773-201313)、芍药苷对照品(中国食品药品检定研究院,含量96.4%,批号:110736-201438);酚红(天津市化学试剂研究院);当归、熟地黄、川芎、炒白芍、延胡索、醋香附、木香(安徽省万生中药饮片有限公司);甲醇、乙腈为色谱纯,其他试剂均为分析纯。
1.3 试验动物
雄性SD大鼠,体重(250±30) g,由上海杰思捷实验动物有限公司提供,合格证号:SCXK(沪)2013-0006。
1.4 试验方法
1.4.1 香附四物汤水煎液的制备 称取香附四物汤组方药材,按照当归∶熟地∶川芎∶白芍∶延胡索∶香附∶木香=3∶4∶1.5∶1.5∶1.5∶1.5∶1配比,经粉碎至粒径可过40目筛,纯水煎煮提取2次,第1次加10倍量纯水煎煮2 h,第2次加8倍量纯水煎煮2 h,合并2次煎出液,浓缩至1 g/mL,作为香附四物汤水煎剂供试样品[4]。
1.4.2 溶液的配制
1.4.2.1 对照品溶液的配制 分别精密称定阿魏酸、芍药苷对照品10.12、10.50 mg,加甲醇超声溶解,定容于10 mL容量瓶中,分别得质量浓度为1.012、1.026 mg/mL的对照品母液;分别吸取各对照品母液,加适量甲醇稀释至10 mL,得质量浓度为0.101 2、0.525 mg/mL的混合对照品溶液,4 ℃放置备用。
1.4.2.2 Krebs-Ringer肠营养液配制 称氯化钠7.8 g,葡萄糖1.4 g,碳酸氢钠1.37 g,氯化钾0.35 g,磷酸二氢钠0.32 g,氯化镁0.02 g,溶解于适量纯水中,并加纯水稀释至1 000 mL,超声混匀[5]。
1.4.2.3 酚红液的配制 称取酚红20 mg溶于1 000 mL的Krebs-Ringer肠营养液中,混匀即得[6]。
1.4.2.4 肠灌流液的配制 吸取一定的香附四物汤水提液与定量的酚红液混合,密闭,并搅拌10 min,制得低、中、高3个不同浓度的香附四物汤肠灌流液。
1.4.2.5 空白肠灌流液 取K-R灌流液适量,按“1.4.5”节试验方法灌流,收集流出液,即得空白肠灌流液[7]。
1.4.3 色谱条件 色谱柱:C18色谱柱(250 mm×4.6 mm);流动相:乙腈-0.1%磷酸(25∶75);柱温:25 ℃;流速:0.8 mL/min;检测波长:双波长320、230 nm;进样量20 μL。
1.4.4 方法学考察
1.4.4.1 标准曲线的绘制 精密吸取混合对照品母液0.10、0.25、0.50、1.00、1.50、2.00 mL,用K-R液稀释并定容至10 mL容量瓶中,得系列对照品混合溶液,在“1.4.3”节色谱条件下测定。以对照品峰面积平均值A对浓度C(μg/mL)进行线性回归,绘制标准曲线。
1.4.4.2 精密度试验 分别配制低、中、高3个质量浓度的阿魏酸及芍药苷对照品溶液,按“1.4.3”节下色谱条件进样,1 d内重复进样5次,连续进样5 d,并记录峰面积,计算日内精密度及日间精密度。
1.4.4.3 回收率试验 取低、中、高3个质量浓度对照品混合溶液,按“1.4.3”节色谱条件测定5 次,将所得的峰面积带入回归方程计算质量浓度,以所得质量浓度与实际质量浓度的比值作为方法回收率。
1.4.4.4 专属性考察 分别对阿魏酸及芍药苷混合对照品溶液、空白肠灌流液、空白肠灌流液+混合对照品溶液以及在体单向肠灌流样品按“1.4.3”节下色谱条件进样,记录色谱图。
1.4.4.5 酚红标准曲线的绘制 用适量K-R缓冲液分别配制含酚红10、20、30、40、50 μg/mL的标准溶液,分别吸取0.5 mL,加入0.2 mol/L的NaOH溶液4.5 mL,摇匀,在558 nm下测定并记录其吸光度,绘制酚红标准曲线。
1.4.5 大鼠在体单向肠灌流试验 取雄性SD大鼠,试验前禁食18 h(自由饮水),麻醉采用10%水合氯醛(0.3 mL/100 g)腹腔注射,麻醉后将大鼠放在加热灯下,以保持其正常体温。试验时在大鼠腹腔剪开一个大约4 cm左右的口子,将要测量的四个肠段仔细找出来,并分别进行插管,每段两根,导管插好后用尼龙扎带扎紧。四个肠段分别为:十二指肠段为从胃幽门下方1 cm处开始量取约10 cm;空肠段为从胃幽门下方15 cm处开始量取约10 cm;回肠段为从盲肠上方20 cm处开始量取约10 cm;结肠段为从距盲肠1 cm处开始向上量取约10 cm。插完管后将大鼠小肠部分小心放回腹腔,尽量避免卷曲和扭结,切口用等渗生理盐水浸润的纱布覆盖,并每隔10min用37 ℃左右的等渗生理盐水喷洒在腹部,以保持小肠部分湿润。手术时须小心谨慎,要注意进口管和出口管保持同一高度,以免重力影响下溢流。试验时取含低、中、高不同浓度药液的肠灌流液(预热至37 ℃)300 mL,先以1.0 mL/min 的流速灌流10 min,再将蠕动泵灌流速度调为0.2 mL/min并保持,预平衡30 min后,于30~45、45~60、60~75、75~90 min时间段收集肠灌流液样品。试验结束后处死大鼠,剪下被考察的肠段,测量其长度(L)和内径(r),计算药物吸收速率常数(Ka)和有效渗透系数(Peff)。
1.4.6 肠灌流液中酚红的测定 将收集到的肠灌流液样品离心,各吸取0.5 mL,分别加入0.2 mol/L的NaOH溶液4.5 mL,以0.2 mol/L NaOH溶液作为空白,测定558 nm下的吸光度,根据酚红标准曲线计算酚红浓度。
1.4.7 肠灌流液中药物浓度的测定 将收集到的灌流液样品离心,取上清液,按“1.4.3”节下色谱条件进行分析,计算相应浓度。
1.4.8 阿魏酸、芍药苷在不同pH值K-R液中的稳定性考察 配制含中浓度阿魏酸和芍药苷的香附四物汤K-R液,采用稀HCl和稀NaOH溶液调节K-R缓冲液pH值分别为5.51、6.30、7.55、8.98,置于密闭容器中,于37 ℃水浴中放置,分别于0、3 h取样,测定阿魏酸和芍药苷的含量[8]。
1.4.9 数据分析 在体肠吸收试验中,肠腔内可能有被肠道吸收或者肠管分泌的水分,结果造成灌流液体积发生改变,本试验采用酚红法对灌流液体积进行校正。大鼠在体单向肠灌流试验中所测得的出口处的阿魏酸及芍药苷的浓度用公式(1)校正[9]:
(1)
阿魏酸及芍药苷的有效渗透系数(Peff)用公式(2)计算,吸收速率参数(Ka)用公式(3)计算:
(2)
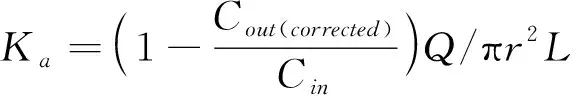
(3)
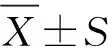
2 结果与分析
2.1 方法学考察
2.1.1 阿魏酸、芍药苷标准曲线的建立 阿魏酸的回归方程:A=184 421.185 4C-81 112,R2=0.999 7(n=6),表明阿魏酸在1.012~20.24 μg/mL之间线性关系良好;芍药苷的回归方程:A=55 700C-69 526,R2=0.999 7 (n=6),表明芍药苷在5.25~105 μg/mL之间线性关系良好。
2.1.2 精密度试验 阿魏酸的日内精密度分别为1.22%、0.36%、0.45%,日间精密度为1.78%、0.47%、0.27%;芍药苷的日内精密度分别为1.62%、0.84%、0.42%,日间精密度为1.68%、0.98%、0.66%,表明精密度良好。
2.1.3 回收率试验 阿魏酸的回收率分别为98.4%、99.2%、99.4%,RSD分别为2.86%、1.23%、1.89%;芍药苷的回收率分别为98.1%、98.5%、99.1%,RSD分别为2.01%、1.78%、2.93%。
2.1.4 专属性考察 由图1可知,在此条件下空白肠灌流液对阿魏酸、芍药苷的测定无干扰,目标成分的测定也不受样品中的其他成分的干扰。
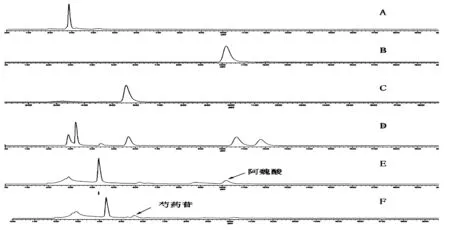
A:空白肠灌流液,B:阿魏酸对照品,C:芍药苷对照品,D:空白肠灌流液+阿魏酸、芍药苷混合对照品液,E:阿魏酸肠灌流样品,F:芍药苷肠灌流样品
2.2 酚红标准曲线的建立
酚红的标准曲线方程:A=0.186 49C+0.015 78,R2=0.999 6 (n=5),表明酚红质量浓度在10~50 μg/mL之间线性关系较好。
2.3 阿魏酸、芍药苷在不同pH值K-R液中的稳定性考察
由表1可知,阿魏酸和芍药苷在pH值不同的K-R液中的稳定性良好,因考虑到肠道环境,故选取pH值7.5左右的K-R缓冲液进行试验。
表1 阿魏酸和芍药苷在不同pH值K-R液中的稳定性考察
2.4 在体单向肠灌流试验结果
由表2可知,在所研究的质量浓度范围之内,随着阿魏酸和芍药苷质量浓度的增加,其在大鼠小肠内的吸收情况无明显变化。低浓度的肠灌流液与高浓度的肠灌流液相比较,阿魏酸和芍药苷在大鼠各个肠段的Peff均无显著性差异(P>0.05),这表明阿魏酸和芍药苷在大鼠小肠内的吸收方式主要是被动转运,且没有自身浓度抑制作用。
在同一质量浓度下比较其在十二指肠、空肠、回肠、结肠的Peff、Ka值,发现阿魏酸和芍药苷在十二指肠、空肠、回肠、结肠的Peff值、Ka值之间均无显著性差异(P>0.05),表明阿魏酸和芍药苷在整个肠道内均有一定的吸收,且无特定的吸收部位(表2)。
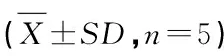
表2 不同质量浓度香附四物汤在大鼠不同肠段中吸收参数
3 结论与讨论
药物在体肠吸收情况国内目前多采用在体肠循环技术进行研究。但是由于肠道能吸收水分,导致供试液体积改变,所以有必要对其进行校正[10]。试验中通过在灌流液中加入不被肠吸收的物质-酚红来标示灌流液体积的变化,使结果更为准确。
肠灌流的流速在一定程度上反应了肠道蠕动的情况,研究表明,随着肠灌流速度的增加,肠道的吸收速率常数会显著增加[11-12],且长时间、高流速的在体肠循环试验会导致大鼠肠黏膜损伤,通透性增加,给实验结果带来较大误差[13]。有文献报道[14],健康人体内肠道的蠕动速度约为2 mL/min,而大鼠肠道的直径约为人体肠道的1/10,因而选择大鼠肠灌流流速为0.2 mL/min。所以,本试验中建立的在体单向肠灌流模型以较低灌流速(0.2 mL/min)、较短的灌流时间(≤2 h)进行灌流,不仅可以较小程度地损伤大鼠肠黏膜,而且更接近实际的人体空腹状态的情况。
在体肠循环实验中,药物对管壁的非特异性吸附也会产生试验误差,故试验时需要对管路和肠管预平衡一段时间,使对管壁的吸附达到饱和,也使机体适应灌流过程[6]。本试验以0.2 mL/min的较低流速灌流30 min使灌流液达到稳态后,开始收集肠灌流液样品,从而保证试验数据的可靠性,减少试验误差。
当某化合物在大鼠肠道内的平均Peff值小于0.03×10-4cm/s或大于0.2×10-4cm/s时,可以预测该化合物在人体内分别为吸收差或易吸收[15]。由试验结果可知,香附四物汤中的活性成分阿魏酸及芍药苷在体内较易吸收,且无特定吸收部位。此外,不同浓度的阿魏酸或芍药苷在大鼠小肠内的Peff值均无明显差异,表明阿魏酸及芍药苷在小肠中的吸收无自身浓度抑制作用,推测其转运机制可能是被动转运。

