OPN-siRNA对胶原诱导性关节炎小鼠的治疗作用①
王 慧 杨国安 骆康凯 窦晶莉 王永福
(包头医学院第一附属医院风湿免疫科,包头医学院风湿免疫研究所,包头014010)
类风湿关节炎(Rheumatoid arthritis,RA)是一种慢性全身性自身免疫性疾病。以侵犯关节为主,引起关节滑膜炎、软骨和骨的破坏,最后导致关节畸形、功能障碍,甚至残疾,严重影响患者的生活质量。另外此病可出现系统受累,最终危及生命。骨桥蛋白(Osteopontin,OPN)也称为分泌磷蛋白1(SPP1)或早期T淋巴细胞活化因子1(Tta1),是一种糖基化的磷酸蛋白,在多种组织和细胞合成,并分泌到体液。最初OPN被鉴定为骨基质蛋白,随后被确定为多种细胞分泌的一种细胞因子,如骨细胞、软骨细胞、滑膜细胞、巨噬细胞、淋巴细胞、上皮细胞及血管平滑肌细胞等。研究表明,OPN在RA滑膜衬里层、衬里下层、软骨表面及侵蚀的滑膜中过表达[1]。RA患者关节局部产生的OPN也是升高的[2]。免疫组化法发现了高水平的OPN,尤以RA滑膜衬里细胞为著。RA患者滑膜CD4+T细胞OPN mRNA表达水平显著升高,与滑液中OPN浓度升高相关[3]。OPN过表达仅限于RA滑膜,与滑膜T细胞选择性OPN受体共表达相关,包括整合素αV、β1 及 CD443。关节炎复发期血清OPN水平显著升高,而在进展期血清中持续出现更高水平OPN[4]。因此,OPN在RA发病过程中可能起着至关重要的作用。
siRNA是一种特定基因沉默技术,广泛用于肿瘤、自身免疫性疾病和肝炎等疾病的治疗[5-7],而且小鼠体内研究发现,口服siRNA制剂对小鼠不会造成任何的不良反应[8]。因此,本研究采用siRNA技术沉默CIA小鼠中OPN基因的表达,探讨OPN基因的siRNA对CIA小鼠的治疗作用。
1 材料与方法
1.1试剂与仪器 载体pGFP-V-RS 购自美国Origene公司,AxyPrep质粒DNA大量抽提试剂盒购自美国Axygen公司,TRIzol购自日本TaKaRa公司,M-MLV逆转录酶和脂质体LipofectamineTM2000购自美国Invotrigen公司。
1.2方法
1.2.1siRNA的设计 本实验针对OPN基因的cDNA序列设计2段siRNA。第1段序列为:5′-CCAAGTCTGGAAACACACA-3′,第2段序列为:5′-GTTCCAAAGCCAGCCTGGA′-3。将上述序列的模板插入质粒载体pGFP-V-RS中,构建其真核表达载体。
1.2.2CIA模型小鼠的建立 4~6周龄DBAⅠ雌性小鼠30只,购自南京大学动物模式研究所。随机抽取3只小鼠为空白组;其余的小鼠用于CIA模型的建立,每只小鼠尾根部皮内注射100 μlⅡ型胶原和完全弗氏佐剂乳化液。第21天尾根部皮内注射同等剂量Ⅱ型胶原和不完全弗氏佐剂乳化液。
1.2.3实验小鼠分组及给药 27只用于造模的小鼠,出模15只,分别分配到模型组、空载体组及OPN-siRNA1和OPN-siRNA2,每组3只,余3只不够分组未用于实验,即本实验共分为5组,分别为空白组、模型组、空载体组、OPN-siRNA1组和OPN-siRNA2组,每组3只小鼠。将构建好的OPN siRNA 60 μg和脂质体LipofectamineTM2000的混合物200 μl[DNA(μg):LipofectamineTM2000(μl)为1∶2]分别自尾静脉注射CIA小鼠,对照组CIA小鼠注射等剂量、等比例的磷酸盐缓冲液(PBS)和LipofectamineTM2000的混合物。每周注射1次,每次注射100 μl,共注射8次。
1.2.4指标的检测及组织病理学 注射后28 d处死所有组别CIA小鼠,心脏取血,分离血清,在-80℃下保存,检测血清IL-17、IL-10及IFN-γ水平;取小鼠肺组织,TRIzol提RNA,实时荧光定量PCR检测小鼠肺脏中OPN mRNA的表达水平,根据ct值计算2-ΔΔct。引物由上海生工生物工程技术服务有限公司合成,OPN上游引物:5′-CACTCCAATCG-TCCCTAC-3′,下游引物:5′-AGACTCACCGCTC-TTCAT-3′,扩增的产物长度为157 bp,内参β-actin上游引物:5′-CTGTCCCTGTATGCCTCTG-3′,下游引物:5′-ATGTCACGCACGATTTCC-3′,扩增的产物长度为218 bp;另外取肺组织和踝关节,4%甲醛固定,石蜡包埋,切2张片,分别作HE染色和荧光免疫组织化学染色,荧光免疫组织化学染色的图片采用IPP6软件分析平均A值;取小鼠脾脏,检测脾细胞Th17及Treg水平。另外检测注射后小鼠血清中细胞因子IL-17、IL-10、IFN-γ水平。

2 结果
2.1OPN siRNA注射后小鼠肺组织OPN mRNA的表达水平 注射后28 d处死小鼠OPN-siRNA1组和OPN-siRNA2组小鼠肺组织中OPN mRNA的表达水平明显低于模型组和空载体组,差异有统计学意义(P<0.05),模型组和空载体组比较差异无统计学意义(P>0.05),OPN-siRNA1组和OPN-siRNA2组比较差异有统计学意义(P<0.05)。见表1。
2.2OPN siRNA注射后小鼠踝关节和肺组织中OPN蛋白的表达水平 注射后28 d处死小鼠,检测小鼠踝关节和肺组织中OPN蛋白的表达水平,结果显示:模型组和空载体组有很强的红色荧光,而OPN-siRNA1组和OPN-siRNA2组的红色荧光量明显减弱,即OPN-siRNA1组和OPN-siRNA2组OPN的表达明显低于模型组和空载体组,模型组和空载体组比较无明显差异,siRNA1组和siRNA2组比较也无明显差异。见图1和图2 (上述应用的为荧光免疫组化,无需染色,放大倍数为10倍)。
2.3OPN siRNA注射后小鼠的踝关节和肺组织病理改变 光镜下观察踝关节的HE染色病理切片,结果发现:与空载体组和模型组比较,OPN-siRNA1组和OPN-siRNA2组中的小鼠踝关节病理显示:关节的炎性细胞浸润减少,关节肿胀程度减轻。见图3。光镜下观察小鼠肺组织的HE染色病理切片,结果发现:与模型组及空载体组比较,OPN-siRNA1组和OPN-siRNA2组肺组织炎细胞浸润减轻,间质性肺病改善。见图4。
2.4OPN siRNA注射后小鼠血清中细胞因子的变化 与模型组和空载体组相比,OPN-siRNA1组和OPN-siRNA2组中IL-17的表达水平下降,但差异无统计学意义(P>0.05),模型组和空载体组比较差异无统计学意义(P>0.05),OPN-siRNA1组和OPN-siRNA2组比较差异无统计学意义(P>0.05)。见表2。


Groups2-ΔΔCtModel group1.00±0.00Empty vector group1.01±0.06OPN-siRNA1 group0.32±0.761)OPN-siRNA2 group0.55±0.901)
Note:Compared with model group and empty vector group,1)P<0.05.

图1 小鼠踝关节中OPN蛋白的表达水平Fig.1 Expression levels of OPN protein in ankle from CIA mice
OPN-siRNA1组和OPN-siRNA2组IL-10的表达水平明显高于模型组和空载体组,差异有统计学意义(P<0.05),模型组低于空白对照组,差异有统计学意义(P<0.05),空载体组低于空白对照组,差异无统计学意义(P>0.05)。模型组和空载体组比较差异无统计学意义(P>0.05),OPN-siRNA1组和OPN-siRNA2组比较差异无统计学意义(P>0.05)。见表3。
OPN-siRNA1组和OPN-siRNA2组IFN-γ的表达低于模型组和空载体组,差异有统计学意义(P<0.05),模型组和空载体组高于空白对照组,差异有统计学意义(P<0.05)。模型组和空载体组比较差异无统计学意义(P>0.05),OPN-siRNA1组和OPN-siRNA2组比较差异无统计学意义(P>0.05)。见表4。

图2 小鼠肺组织中OPN蛋白的表达水平Fig.2 Expression levels of OPN protein in lung from CIA mice

图3 小鼠踝关节病理改变Fig.3 Pathology of ankle joint in mice

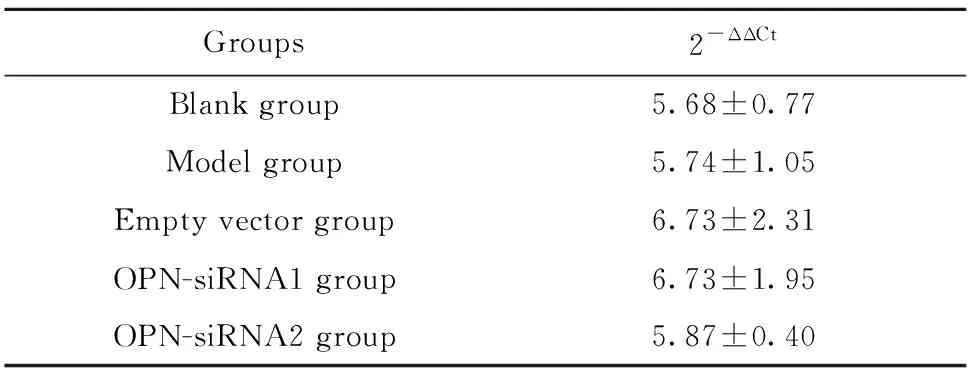
Groups2-ΔΔCtBlank group5.68±0.77Model group5.74±1.05Empty vector group6.73±2.31OPN-siRNA1 group6.73±1.95OPN-siRNA2 group5.87±0.40


Groups2-ΔΔCtBlank group65.83±5.28Model group28.55±15.982)Empty vector group55.78±32.03OPN-siRNA1 group135.86±12.191)OPN-siRNA2 group184.21±23.401)
Note:Compared with model group and empty vector group,1)P<0.05;compared with blank group,2)P<0.05.
2.5OPN siRNA注射后小鼠脾细胞中Th17和Treg的变化 OPN siRNA作用小鼠后,脾细胞中Th17细胞的比例低于模型组和空载体组,差异有统计学意义(P<0.05),模型组和空载体组比较差异无统计学意义(P>0.05),模型组和空载体组高于空白对照组,差异有统计学意义(P<0.05),OPN-siRNA1组和OPN-siRNA2组比较差异无统计学意义(P>0.05),见表5。
OPN siRNA作用小鼠后,脾细胞中Treg细胞的比例高于模型组和空载体组,差异有统计学意义(P<0.05),模型组和空载体组比较差异无统计学意义(P>0.05)。OPN-siRNA1组与OPN-siRNA2组比较差异无统计学意义(P>0.05)。模型组、空载体组与空白对照组比较差异无统计学意义(P>0.05)。见表6。

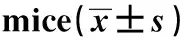

Groups2-ΔΔCtBlank group4.46±0.94Model group15.52±1.902)Empty vector group13.66±3.802)OPN-siRNA1 group5.28±1.411)OPN-siRNA2 group5.54±1.551)
Note:Compared with model group and empty vector group,1)P<0.05;compared with blank group,2)P<0.05.

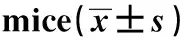

Groups The proportion of Th17 cellBlank group2.63±0.67Model group6.23±1.102)Empty vector group4.70±1.102)OPN-siRNA1 group2.33±0.851)OPN-siRNA2 group2.90±0.801)
Note:Compared with model group and empty vector group,1)P<0.05;compared with blank group,2)P<0.05.

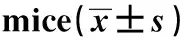

GroupsThe proportion of Treg cellBlank group3.23±0.40Model group1.87±0.25Empty vector group1.40±0.22OPN-siRNA1 group7.67±1.071)OPN-siRNA2 group6.63±0.751)
Note:Compared with model group and empty vector group,1)P<0.05.
3 讨论
RA是一种慢性、以侵犯关节为主要特征、原因未明的自身免疫性疾病。全世界RA的患病率是0.5%~1%,女性高于男性[9]。至今RA尚不能根治,治疗的总原则是达标治疗。
OPN是RA的一种自身抗原,临床上,抗OPN抗体可能与RA疾病严重程度相关[10]。在DBA/1J小鼠,抗OPN单克隆抗体23C3可有效抑制CIA疾病的发展甚至逆转病情。单克隆抗体23C3降低血清Ⅱ型胶原特异性自身抗体和炎性细胞因子的水平,并抑制T细胞针对Ⅱ型胶原的免疫应答[11]。之前的研究结果有力地提示OPN参与RA的发展,并表明OPN siRNA、OPN表位的中和性抗体以及整合素抗体有望成为RA治疗的工具。本研究针对OPN基因的cDNA序列设计2段siRNA,将上述序列的模板插入质粒载体pGFP-V-RS中,构建其真核表达载体。分别自尾静脉注射CIA小鼠。肺组织OPN mRNA的表达水平明显降低;小鼠踝关节和肺组织中OPN蛋白的表达结果显示:模型组和空载体组有很强的红色荧光,而OPN-siRNA1组和OPN-siRNA2组的红色荧光量明显减弱。以上结果说明:OPN siRNA可抑制CIA小鼠肺脏中OPN mRNA的表达;另外可以抑制肺组织和踝关节OPN蛋白水平的表达。因此,OPN-siRNA可以抑制OPN mRNA及OPN蛋白的表达,有望成为RA治疗的新武器。
OPN是一种具有多效性的细胞外基质蛋白[3]。滑膜T细胞的OPN过表达与局部炎症相关,且OPN是RA发病过程中重要的介质。在滑膜衬里层和软骨浸润部位的成纤维细胞产生的OPN不仅可以介导这些细胞附着于软骨,而且通过刺激关节软骨胶原酶1的分泌促进RA基质降解[1]。本研究结果显示:与模型组和空载体组比较,踝关节病理显示:OPN-siRNA1组和OPN-siRNA2组关节的炎性细胞浸润减少,关节肿胀程度减轻。另外肺组织病理显示炎细胞浸润减轻,间质性肺病改善。OPN-siRNA可以明显抑制关节及肺组织炎细胞浸润,从而控制疾病的进展。RA滑液刺激T细胞OPN的表达,这是由于滑液中IL-10的出现及其被IL-10抗体中和所引起[3]。OPN选择性诱导促炎因子和趋化因子(如IL-1和IL-8)的表达,从而促进炎症细胞的迁移和募集。此外,在单核细胞中OPN可以激活转录因子NF-κB[3]。OPN通过与其受体αvβ3整合素连接,可以介导破骨细胞参与的关节炎骨吸收过程[4]。OPN mRNA主要存在于关节破坏的骨侵蚀部位,该部位有活化的破骨细胞存在;同时骨侵蚀部位也检测到OPN蛋白。RA滑液中内源性OPN的产生是由于T细胞内IL-17和单核细胞内MCP-1或 MIP-1β生成增加所引起,这种作用可以被OPN抗体阻断[12,13]。OPN对Th17分化的影响是通过一个独立的IL-6/STAT-3通路或其他细胞因子,具体涉及OPN受体CD44和CD29及转录因子维甲酸相关孤核受体(Retinoic acid-related orphan receptor,ROR)。此外,OPN可以诱导IL17A基因启动子的H3乙酰化作用,主要是通过在CD4+T细胞的CD44结合域,IL17A基因位点与ROR的相互作用来实现[13]。本研究结果显示:OPN siRNA作用小鼠后,脾细胞中Th17细胞的比例低于模型组和空载体组,而脾细胞中Treg细胞的比例较模型组和空载体组增高。OPN siRNA可以抑制致病性Th17水平;OPN siRNA治疗后Treg水平升高,进一步诱导免疫耐受,促进关节炎症的控制。另外:OPN siRNA作用后,小鼠血清中细胞因子水平发生了明显的变化:引起促炎因子IL-17及IFN-γ下降,而抑炎因子IL-10升高。从而达到抑制关节炎症的目的。
本研究采用siRNA技术沉默CIA小鼠中OPN基因的表达,探讨OPN基因的siRNA对小鼠CIA的治疗作用。结果显示,OPN-siRNA抑制RA模型鼠体内OPN表达及炎症介质的水平,因此可能成为RA治疗新的潜在靶点,本研究样本量较小,有待进一步扩大样本进行证实。

