青藤碱通过抑制缺血诱导的异常自噬缓解MCAO模型大鼠脑损伤①
尹晓刚 邓 倩 潘瑞华 陈世东
(南阳医专第一附属医院,南阳473000)
自噬是降解体内受损细胞器及蛋白质的过程。研究表明,自噬在多个生理、病理过程中都发挥着重要作用,如细胞分化、细胞凋亡、感染和机体代谢紊乱等[1-3]。自噬可以调控多种神经性疾病的发生发展。多项研究表明,抑制自噬可诱导阿尔茨海默病、亨廷顿氏舞蹈病等神经退行性疾病的发生,激活自噬对脑缺血大鼠有神经保护作用[4-6]。但也有研究表明,过度自噬会导致神经细胞的死亡,抑制自噬、下调自噬蛋白的表达可减缓脑缺血后神经细胞的死亡[7,8]。青藤碱(图1,Sinomenine,SM)是从中药青风藤提取的一类生物碱,具有免疫抑制、抗炎、抗肿瘤活性[9]。研究表明,SM具有抗脑缺血损伤的作用[10]。SM还可抑制血管紧张素Ⅱ诱导的自噬[11]。但青藤碱对脑缺血损伤的作用是否与调控自噬有关还未见报道。因此,本文将采用线栓法复制大鼠脑中动脉阻塞(Middle cerebral artery occlusion,MCAO)模型以探究SM对脑缺血异常诱导的自噬的作用及作用机制。
1 材料与方法
1.1材料 青藤碱购自中国药品鉴定所,分子式为C19H23NO4,分子量为329.38,纯度≥98%,批号为120774-200507;TTC试剂购自上海惠世生化试剂公司;线栓购自北京西浓科技公司;乳酸盐脱氢酶(Lactate dehydrogenase,LDH)、丙二醛(Malondiald-ehyde,MDA)、一氧化氮(Nitric oxide,NO)和白介素-6(Interleukin,IL-6)、ELISA试剂盒购自美国Millipore试剂公司;实验所用一抗均购自美国Santa Cruz公司。
1.2方法
1.2.1动物模型构建 根据文献[12]所报道方法复制大鼠MCAO模型。实验所用SD雄性大鼠购自北京实验动物中心,体重280~320 g。适应性喂养3 d后,将大鼠随机分为Healthy Control组、SM组、MCAO组和MCAO+SM组。除Healthy Control组外,其余组大鼠用10%水合氯醛麻醉,仰卧位固定,分离右侧颈总动脉,结扎颈总动脉近心端,远心端用动脉夹夹闭,用眼科剪于颈总动脉分叉1 cm处剪口将线栓插入,轻缓推进使线栓进入颈内动脉,最后再次调整角度使线栓进入大脑中动脉。线栓插入深度约为18 mm、90 min后拔出线栓,恢复大脑供血。整个过程均用激光多普勒监测大脑局部血流量,以插入线栓大脑血流量至少下降85%、再灌注后10 min恢复至80%以上的大鼠视为造模成功。Healthy Control组大鼠除不插线栓外,其余操作同其他组。
1.2.2TTC染色 连续给予大鼠SM (20 mg/kg)7 d 后,用10%水合氯醛麻醉大鼠并立即断头取脑,去除嗅球并制作冠状切片。将切片置于0.2%的TTC溶液中,37℃避光处理10 min,弃去TTC溶液,加入4%多聚甲醛室温固定24 h,用相机记录拍照,计算脑组织梗死面积。
1.2.3免疫组化 制作大鼠脑组织冰冻切片。将切片取出复温后,用PBS清洗3次,加入0.5%的TritonX-100室温通透15 min,滴加10%封闭用山羊血清室温封闭2 h,弃去血清,滴加适宜浓度的一抗(Ki67,1∶200;Caspase-3,1∶200)4℃封闭过夜。次日加入生物素标记的二抗室温封闭1 h,最后用DAB显色,于显微镜下每片随机选取6个视野进行统计计数。
1.2.4Western blot 用RIPA裂解液提取组织总蛋白,BCA试剂盒测定蛋白浓度。用12%SDS-PAGE分离蛋白并转移蛋白质至PVDF膜。用5%脱脂牛奶室温封闭PVDF膜2 h,随后加入一抗4℃封闭过夜。第二天弃去一抗,用TBST清洗3次后,加入HRP标记二抗,室温孵育1 h,随后滴加ECL显色液,曝光显影。
1.2.5ELISA 用10%水合氯醛麻醉大鼠,进行心脏取血。将所获得的血液以3 000 r/min转速于4℃离心15 min,取上层血清根据ELISA试剂盒说明书检测血清中LDH、MDA、NO和IL-6的含量。

2 结果
2.1SM对MCAO大鼠脑梗死的影响 为探究SM对MCAO大鼠脑梗死的影响,我们检测了各组大鼠的脑梗死面积。实验结果表明,与Healthy Control比较,SM组大鼠脑梗死率没有明显变化,MCAO组大鼠脑梗死率显著升高(P<0.01,图1);与MCAO组比较,MCAO+SM组大鼠脑梗死率明显降低(P<0.05,图1)。
2.2SM对MCAO大鼠脑细胞增殖及凋亡的影响 为了探究SM对MCAO大鼠脑细胞增殖和凋亡的影响,我们检测了增殖和凋亡标记蛋白的表达情况。免疫组化实验结果显示,与Healthy Control比较,MCAO组大鼠脑组织Ki67阳性细胞密度明显降低,Caspase-3阳性细胞密度明显升高(P<0.01,图2);与MCAO组比较,MCAO+SM组大鼠脑组织Ki67阳性细胞密度明显增升高,Caspase-3阳性细胞密度明显降低(P<0.05,图2);此外,缺血能明显抑制Ki67和B细胞淋巴瘤-2(B-cell lymphoma 2,Bcl-2)的表达,促进Caspase-3和Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)的表达(P<0.01,P<0.001,图3);SM能显著诱导MCAO大鼠脑组织Ki67和Bcl-2的表达,降低Caspase-3和Bax的表达水平(P<0.05,P<0.01,图3)。
2.3SM对MCAO大鼠神经炎症及脂质过氧化的影响 ELISA实验结果表明,缺血缺氧能明显诱导大鼠血清LDH、MDA、NO和IL-6的分泌(P<0.01,图4);SM可显著降低MCAO大鼠血清LDH、MDA、NO和IL-6的含量(P<0.05,图4)。

图1 SM对MCAO大鼠脑梗死的影响Fig.1 Effect of SM on cerebral infraction of MCAO ratsNote: A.The chemical structure of SM;B.The area of cerebral infraction was determined by TTC staining.**.P<0.01 versus Healthy control group,#.P<0.05 versus MCAO group.
2.4SM对MCAO大鼠异常自噬及自噬通路的影响 为了探究SM缓解MCAO大鼠缺血损伤的机制,我们检测了自噬标记蛋白及自噬相关通路蛋白的表达情况。与Healthy Control比较,MCAO组大鼠脑组织Beclin1表达水平和LC3Ⅱ/LC3Ⅰ的比值明显升高,p62表达水平明显降低(P<0.001,图5);与MCAO组比较,MCAO+SM组大鼠脑组织Beclin1 表达水平和LC3Ⅱ/LC3Ⅰ的比值明显降低,p62表达水平明显升高(P<0.05,P<0.01,图5)。此外,缺血能明显抑制雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的表达,促进Ulk1的表达(P<0.01,P<0.001,图5);SM能显著缓解缺血对mTOR表达的抑制作用及对Ulk1表达的促进作用(P<0.05,图5)。

图2 SM对MCAO大鼠脑细胞增殖及凋亡的影响Fig.2 Effects of SM on cell proliferation and apoptosis of ratsNote: Immunohistochemical was performed for expressions of Ki67 and Caspase-3.**.P<0.01 versus Healthy control group,#.P<0.05 versus MCAO group.All experiments were repeated at least three times.
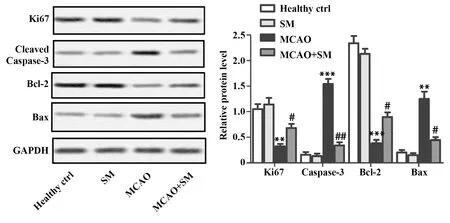
图3 SM对MCAO大鼠脑组织增殖及凋亡标记蛋白表达的影响Fig.3 Effects of SM on proliferation-and apoptosis-related proteins of MCAO ratsNote: Western blot was employed to determine the protein levels of Ki67,Caspase-3,Bcl-2 and Bax.**.P<0.01,***.P<0.001 versus Healthy control group,#.P<0.05,##.P<0.01 versus MCAO group.GAPDH was used as loading control.

图4 SM对MCAO大鼠神经炎症及脂质过氧化的影响Fig.4 Effcts of SM on neuroinflammation and lipid peroxidationNote: The concentrations of serum LDH,MDA,NO and IL-6 were measured by ELISA assay.**.P<0.01 versus Healthy control group,#.P<0.05 versus MCAO group.

图5 SM对MCAO大鼠异常自噬及自噬通路的影响Fig.5 Effects of SM on autophagy and autophagy-related signaling pathway of MCAO ratsNote: The protein levels of mTOR,Ulk1,Belcin1,p62 and LC3.GAPDH was used as loading control.**.P<0.01,***.P<0.001 versus Healthy control group,#.P<0.05,##.P<0.01 versus MCAO group.
3 讨论
SM是中药青风藤的主要活性成分,常被用于治疗关节炎[13]。研究表明,SM分子量较小,能透过血脑屏障进入脑内,因此可用于大脑疾病的治疗[14]。现代研究表明,青藤碱具有较强的神经保护作用,其可通过调控星形胶质细胞激活抑制神经炎症的发生[15],同时还能通过AMPK通路、CRYAB/STAT3信号通路抑制缺血诱导的神经炎症而减轻脑损伤[10,16]。Xie等[17]研究发现,SM可通过抑制脂质过氧化减轻心脏缺血再灌注后心肌损伤。SM还能抑制过氧化物H2O2诱导的心肌细胞凋亡[18]。炎症、脂质过氧化及细胞凋亡均是导致脑缺血后神经损伤的重要机制[19,20],提示SM可能具有抗缺血诱导的炎症、脂质过氧化及细胞凋亡作用。本实验结果表明,SM可明显促进MCAO大鼠大脑细胞增殖标记蛋白Ki67的表达,抑制凋亡标记蛋白Caspase-3及Bax的表达,降低Bcl-2的蛋白表达水平。Caspase-3是细胞凋亡的关键调控因子,Bax可促进细胞凋亡,上调Bcl-2可抑制细胞凋亡[21],表明SM可促进缺血后神经细胞增殖,抑制神经细胞凋亡。同时,SM还能抑制细胞炎症因子NO、IL-6及脂质过氧化产物LDH和MDA的释放,提示SM可通过抑制神经炎症、脂质过氧化及细胞凋亡抗大鼠脑缺血损伤。
研究表明,自噬参与了脑缺血后神经细胞死亡过程的调控[22,23]。适当的自噬可为缺血后神经细胞提供营养物质,发挥神经保护作用[24]。过度自噬则会加速神经细胞的凋亡,加重脑缺血损伤[12]。缺氧可诱导大量自噬体的形成,抑制自噬还可减少缺糖缺氧诱导的神经元的死亡[25]。本文研究发现,缺氧能明显升高大鼠脑组织Beclin1的蛋白表达水平和LC3Ⅱ/LC3Ⅰ的比值,抑制p62的表达。Beclin1在自噬的起始阶段发挥重要作用,LC3则主要参与自噬小体的形成,敲除Beclin1可通过抑制自噬减轻脑缺血后神经变性[26]。p62表达于细胞核,其随自噬的进行被不断降解,表达水平与自噬呈负相关[27]。结合实验结果进一步表明缺氧环境可诱导自噬。给予MCAO大鼠SM 7 d后,Beclin1的表达水平及LC3Ⅱ/LC3Ⅰ的比值明显降低,p62表达水平明显升高,表明SM可显著抑制缺血诱导的异常自噬。研究表明,下调自噬可缩小脑缺血大鼠的脑梗死面积,抑制神经细胞死亡,激活自噬则会加重脑损伤[28]。我们的研究也发现SM在抑制自噬的同时也可明显减小脑梗死面积,抑制神经细胞凋亡,提示SM减轻缺血诱导的脑损伤可能与其抑制自噬有关。
mTOR/Ulk1信号通路是调控自噬的经典通路之一[29]。下调mTOR可通过诱导Ulk1复合物的形成促进Beclin1活化、诱导LC3Ⅰ向LC3Ⅱ转化而促进自噬小体的形成[30]。研究表明,mTOR/Ulk1信号通路参与了脑缺血后自噬的调控。Bin等[31]研究发现,中药提取物川芎嗪可通过mTOR/Ulk1信号通路诱导自噬,减轻缺血损伤。并且针灸治疗脑缺血损伤也与通过mTOR/Ulk1通路调控自噬有关[32]。我们已经证明SM可通过调控Beclin1、LC3和p62表达抑制缺血诱导的自噬,因此,我们检测了自噬通路相关蛋白的表达。实验结果表明,SM可显著上调MCAO大鼠脑组织mTOR的表达水平,抑制Ulk1表达,从而抑制mTOR/Ulk1通路的激活,抑制缺氧诱导的异常自噬。也有研究表明,下调mTOR的表达可抑制脑缺血再灌注诱导的细胞凋亡[33]。提示,SM可能通过mTOR/Ulk1通路的激活,抑制缺血诱导的自噬而抑制神经细胞凋亡。
综合所述,SM可通过下调缺血诱导的异常自噬促进MCAO大鼠脑细胞增殖、抑制细胞凋亡、神经炎症和脂质过氧化反应的发生,并且其机制可能与抑制mTOR/Ulk1通路激活有关。本研究可能为SM应用于脑缺血损伤的治疗提供了新的理论支撑。

