SOX9基因下调JAK2/STAT3信号诱导肺癌细胞凋亡及降低免疫逃逸相关因子表达的研究
刘贵廷 杨 柳
(牡丹江医学院附属红旗医院胸外科,牡丹江157000)
肺癌是常见的恶性肿瘤之一,近些年的发病率及死亡率呈上升趋势[1]。近些年随着对肿瘤发生发展及转移的分子生物学的深入研究,提出了基因治疗的概念。SOX9位于17q24.3-q25.1,在SOX家族中研究最多,是一种与性腺发育有关的核转录因子,近几年发现其与肿瘤发生发展密切相关,多种肿瘤中SOX9出现异常表达,如肺癌、前列腺癌等,其表达影响肿瘤发生发展[2,3]。RNA干扰(RNA interference,RNAi)是一项可使特定基因表达沉默的新技术,具有特异性、高效性等特点,在基因功能研究、疾病治疗等方面均有广泛的应用[4,5]。有研究发现,通过RNAi技术抑制大肠癌中SOX9表达可抑制癌细胞生长和诱导癌细胞凋亡[6]。肺癌中对SOX9的研究发现,SOX9可能是判断肺癌预后的新标志物[7],miR-206可通过靶向抑制SOX9降低肺癌细胞的增殖和侵袭能力[8],但SOX9表达对肺癌细胞凋亡及机制的影响研究尚未明确。因此,本研究通过RNAi技术抑制肺腺癌A549细胞SOX9表达,旨在SOX9对细胞增殖凋亡影响及机制。
1 材料与方法
1.1试剂和仪器 RPMI1640培养基、胎牛血清均购自美国Bibco;DCFH-DA购自美国Sigma;LipofectamineTM2000购自美国Invitrogen;SOX9、HIF-1α、VEGF、p-JAK2、p-STAT3、survivin抗体均购自美国Abcam;CCK8试剂购自Dojindo化学研究所;Annexin V-FITC/PI细胞凋亡试剂盒购自南京凯基;酶标仪购自美国Thermo;流式细胞仪购自美国BD。
1.2方法
1.2.1细胞培养 肺腺癌A549细胞购于中国科学院上海细胞库。用含有10%胎牛血清及青链霉素双抗的RPMI1640培养基培养A549细胞,置于5%体积分数的CO2孵箱中37℃常规培养。每2 d换液一次。实验为生长至对数期的细胞。
1.2.2细胞分组及转染 将A549细胞分为空白对照组(opti-MEM培养基)、阴性对照组(含有Lip-2000的opti-MEM培养基+合成的无干扰作用的siRNA)和si-SOX9组(脂质体+合成的干扰SOX9表达的siRNA)。接种生长至对数期的A549细胞于6孔板,将配置的siRNA-Lip混合液加入到含有转染液及细胞的孔中,每孔加入1 ml,于37℃孵箱中培养6 h,换为含血清的RPMI1640培养液培养48 h,备用。
1.2.3细胞活力检测 调整转染48 h的细胞浓度,以每孔5 000个细胞每孔加入100 μl接种于96孔板,每组设置5个平行孔,于培养箱中培养4 h,加入10 μl的CCK8溶液在每个细胞孔中,培养箱孵育2 h,在酶标仪上读取各孔的OD值,波长为450 nm。实验重复3次。
1.2.4细胞凋亡检测 PBS洗涤转染48 h的细胞,稀释后的缓冲液重悬细胞,细胞浓度调整为1×106ml-1,取100 μl的细胞悬液,每个样本中分别加入5 μl的Annexin V-FITC及10 μl的PI,室温下避光反应15 min,每孔加缓冲液400 μl,轻柔混匀,上机,流式细胞仪检测细胞凋亡情况。实验重复3次。
1.2.5ROS检测 PBS洗涤转染48 h的细胞,每孔细胞中加入经无血清培养基稀释成1∶1 000的DCFH-DA(终浓度为10 μmol/L),继续避光孵育1 h,不含血清的培养基洗涤细胞,流式细胞仪检测荧光强度,以荧光强度反映ROS在细胞内的水平。实验重复3次。
1.2.6Western blot 适量的RIPA裂解液提取细胞总蛋白,BCA法测定蛋白浓度,取50 μg蛋白上样,经12%的SDS-PAGE,电泳后转NC膜,5%脱脂奶粉封膜30 min,分别加入稀释好的SOX9、HIF-1α、VEGF、p-JAK2、p-STAT3、survivin抗体(皆为1∶1 000稀释),4℃孵育过夜,洗膜,加入HRP标记的抗体(1∶2 000稀释),室温孵育2 h,ECL显色,X胶片显影。以GAPDH作为内参,分析各蛋白与内参GAPDH条带的灰度比值,作为各蛋白的相对表达量。实验重复3次。

2 结果
2.1SOX9表达检测结果 转染si-SOX9的A549细胞SOX9的表达检测结果如图1和表1所示,转染SOX9的siRNA的细胞中SOX9的蛋白表达显著降低(P<0.05),而阴性对照组SOX9的表达与空白对照组差异无统计学意义(P>0.05),这说明抑制SOX9表达的A549细胞构建成功。
2.2转染si-SOX9对肺癌细胞活力和凋亡率的影响 CCK8法检测各组细胞活力,结果显示,与阴性对照组比较,si-SOX9组细胞活力显著降低(P<0.05),采用Annexin V-FITC/PI双染法,通过流式细胞仪检测各组细胞凋亡率,结果显示,与阴性对照组比较,si-SOX9组细胞凋亡率显著升高(P<0.05)。见图2,表2。
2.3转染si-SOX9对肺癌细胞ROS水平的影响 在转染48 h的细胞中加入DCFH-DA,通过流式细胞仪检测各组细胞的荧光强度,可反映细胞内的ROS水平,检测结果如表3所示,与阴性对照组比较,si-SOX9组的ROS水平显著升高(P<0.05)。

图1 转染si-SOX9的A549细胞SOX9的表达Fig.1 Expression of SOX9 in A549 cells transfected with si-SOX9
表1转染si-SOX9的A549细胞SOX9的表达
Tab.1ExpressionofSOX9inA549cellstransfectedwithsi-SOX9

GroupsRelative protein expression of SOX9Blank control group0.425±0.036Negative control group0.437±0.037si-SOX9 group0.074±0.0091)F139.356P0.000
Note:1)P<0.05 vs Blank control group.
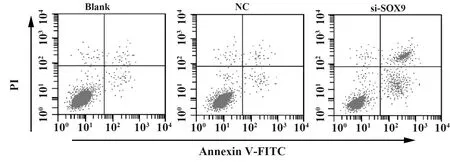
图2 转染si-SOX9对肺癌细胞凋亡的影响Fig.2 Effect of si-SOX9 transfection on apoptosis of lung cancer cells
表2转染si-SOX9对肺癌细胞活力和凋亡率的影响
Tab.2Effectofsi-SOX9transfectiononviabilityandapoptosisrateoflungcancercells

GroupsODApoptosis rate(%)Blank control group0.802±0.0611.53±0.12Negative control group0.794±0.0601.59±0.15si-SOX9 group0.513±0.0391)18.26±1.591)F27.575326.190P0.0010.000
Note:1)P<0.05 vs Negative control group.
表3转染si-SOX9对肺癌细胞ROS水平的影响
Tab.3Effectofsi-SOX9transfectiononROSlevelinlungcancercells

GroupsRelative fluorescence intensityBlank control group37.1±4.3Negative control group39.2±4.9si-SOX9 group98.8±7.411) F113.564P0.000
Note:1)P<0.05 vs Negative control group.

图3 转染si-SOX9对肺癌细胞HIF-1α、VEGF表达的影响Fig.3 Effect of si-SOX9 transfection on expression of HIF-1α and VEGF in lung cancer cells
2.4转染si-SOX9对肺癌细胞HIF-1α、VEGF表达的影响 通过Western blot检测转染si- SOX9后的肺癌细胞中与肿瘤免疫逃逸相关的基因HIF-1α和VEGF的蛋白表达,结果如图3和表4所示,与阴性对照组比较,si-SOX9组HIF-1α和VEGF的蛋白表达均显著降低(P<0.05)。
表4转染si-SOX9对肺癌细胞HIF-1α、VEGF表达的影响
Tab.4Effectofsi-SOX9transfectiononexpressionofHIF-1αandVEGFinlungcancercells

GroupsRelative protein expressionHIF-1αVEGFBlank control group0.447±0.0410.219±0.020Negative control group0.458±0.0430.226±0.022si-SOX9 group0.168±0.0191)0.096±0.0101)F62.47648.899P0.0000.000
Note:1)P<0.05 vs Negative control group.

图4 转染si-SOX9对肺癌细胞JAK2/STAT3信号通路的影响Fig.4 Effect of si-SOX9 transfection on JAK2/STAT3 signaling pathway in lung cancer cells
表5转染si-SOX9对肺癌细胞JAK2/STAT3信号通路的影响
Tab.5Effectofsi-SOX9transfectiononJAK2/STAT3signalingpathwayinlungcancercell

GroupsRelative protein expressionp-JAK2p-STAT3survivinBlank control group0.142±0.0150.192±0.0190.689±0.059Negative control group0.133±0.0130.204±0.0210.627±0.051si-SOX9 group0.054±0.0081)0.088±0.0101)0.149±0.0171)F46.06740.603123.355P0.0000.0000.000
Note:1)P<0.05 vs Negative control group.
2.5转染si-SOX9对肺癌细胞JAK2/STAT3信号通路的影响 通过Western blot检测转染si-SOX9后对肺癌细胞JAK2/STAT3信号通路p-JAK2、p-STAT3及下游相关基因survivin蛋白表达的影响,结果如图4和表5所示,与阴性对照组比较,si-SOX9组p-JAK2、p-STAT3和survivin的蛋白表达均显著降低(P<0.05)。
3 讨论
SOX家族基因与肿瘤发生发展存在密切关系,多种肿瘤中有异常表达,一些肿瘤中上调表达,起癌基因样作用,促进肿瘤生长和形成,而一些肿瘤中下调表达,起到抑癌样作用。如SOX7在胃癌、胰腺癌中表达上调[9,10],而在乳腺癌中表达下调[11]。SOX9是SOX家族一员,也是被研究最多的一员,有研究发现,SOX9的缺失可引起前列腺癌腹侧发生发育障碍和前列腺畸形,而前列腺肿瘤中SOX9的表达上调,促进肿瘤的发生发展[12]。宫颈癌中SOX9的表达与ki67表达呈现负相关,SOX9表达增加可抑制细胞增殖,发挥抑癌基因作用[13]。肺癌细胞中SOX9的过表达可引起E-钙黏蛋白表达下调,而SOX9表达受到抑制后E-钙黏蛋白表达上调[14],这提示SOX9可通过对E-钙黏蛋白的负向调控促进肺癌的侵袭和运动。此外,也有研究指出,miR-185可通过靶向SOX9抑制肺癌细胞增殖、侵袭[15]。本研究旨在通过RNAi技术抑制A549细胞SOX9表达对癌细胞增殖凋亡、免疫逃逸相关因子HIF-1α和VEGF表达的影响和机制研究。
以脂质体Lip-2000为载体,将针对SOX9特异性靶点的siRNA转染肺腺癌A549细胞,细胞中SOX9的表达明显受到抑制,这提示抑制SOX9表达的A549细胞构建成功。CCK8检测细胞活力,流式细胞仪检测细胞凋亡率结果显示,SOX9表达受到抑制后肺癌细胞的活力明显降低,凋亡率增加。ROS是细胞内重要的氧化还原信号分子,影响细胞的增殖、凋亡、分化等过程,有研究表明,ROS高水平可促进肺癌、卵巢癌等多种肿瘤细胞凋亡[16,17],因此可通过提高肿瘤细胞内ROS水平诱导癌细胞的凋亡。本研究结果显示,SOX9表达受到抑制后肺癌细胞ROS水平显著升高,这提示SOX9可通过提高ROS途径诱导肺癌细胞凋亡。有研究显示,JAK2/STAT3信号通路的活化可调控VEGF、bFGF等与血管生长相关因子表达,促进肺癌微血管形成,VEGF表达与HIF-1α密切相关[18]。VEGF和HIF在肿瘤免疫逃逸方面起了决定性的作用[19]。有研究发现,抑制肺癌细胞JAK2/STAT3信号通路可对癌细胞生长起抑制作用,且可降低VEGF和HIF-1α的表达[20]。本研究结果显示,RNAi技术抑制A549细胞SOX9表达后JAK2/STAT3信号通路p-JAK2、p-STAT3和下游相关基因survivin及VEGF和HIF-1α的表达均明显降低,这提示抑制肺癌细胞SOX9表达可通过下调JAK2/STAT3信号通路降低肺癌发生发展。
综上所述,利用RNA干扰技术抑制SOX9基因表达可降低肺癌细胞活力,诱导细胞凋亡,降低免疫逃逸相关因子HIF-1α和VEGF表达,作用机制可能是细胞内ROS水平升高及JAK2/STAT3信号通路的下调。本研究可能为以SOX9为靶点的肺癌靶向治疗提供了一定的理论依据。

