单个B细胞制备CRP单克隆抗体及其ELISA检测体系的初步建立①
林 骏 山 云 刘 谦 王晓炜 王洪涛 刘 尧
(深圳市药品检验研究院 深圳市医疗器械检测中心,深圳518057)
1975年德国科学家Kohler和英国科学家Milstein将能产生抗体的B淋巴细胞与能永生的髓瘤细胞融合成杂交瘤细胞,成功建立了表达单克隆抗体技术[1]。单个B细胞抗体制备技术是借助PCR方法的发展和抗体生产的成熟使得通过单细胞RT-PCR,在体外进行克隆和表达,使单个人类B细胞产生单克隆抗体成为可能。与传统的单克隆抗体技术相比,单个B细胞技术需要的细胞量少,基因多样性好、效率高、可全人源、同时保留了自然的重链和轻链[2]。
CRP(C-reactive protein)是一种非特异性炎症标志物,正常的人血清浓度在5~10 mg/L之间,晚期妊娠妇女、轻度炎症和病毒感染(10~40 mg/L)、活跃炎症、细菌感染(40~200 mg/L)、严重细菌感染和烧伤(>200 mg/L)。CRP在炎症开始后2 h内上升,48 h内达到峰值,半衰期为18 h,CRP在临床上常作为急性炎症和感染的诊断指标[3]。目前的研究证明CRP不仅作为炎症预示因子,其本身也作为一种促炎因子与动脉粥样硬化等疾病息息相关,人血浆内CRP浓度在1~10 mg/L浓度的高低与心血管疾病密切相关[4-6]。高敏CRP诊断(high-sensitivity CRP,hs-CRP)检测灵敏度高,能准确定量 0.1~10 mg/L浓度范围内的 CRP含量,但是hs-CRP 诊断试剂盒和主要单抗原料依赖进口,价格昂贵不利推广[7]。本研究的目的是利用单个B细胞抗体制备技术结合Exip 293真核表达系统制备高灵敏CRP单克隆抗体,并经过试验获得两个能检测人CRP的单克隆抗体,初步建立并评估了双抗体夹心ELISA生物素-亲和素检测体系。
1 材料与方法
1.1实验材料、试剂 载体pcDNA3.1(+),限制性内切酶EcoRⅠ和XhoⅠ,Expi 293真核表达系统购自Thermo Fisher公司;菌株E.coli DH5α由本实验室保存;实验动物BALB/c小鼠购自北京维通利华实验动物技术有限公司;去内毒素质粒抽提试剂盒、Ni-NTA亲和层析柱、Protein A纯化层析柱、Western blot试剂、快速银染试剂盒、生物素、HRP-链霉亲和素购自生工生物工程(上海)股份有限公司;ELISA板购自美国康宁公司; TMB单组分显色液购自北京索莱宝科技有限公司;全波长酶标仪购自Thermo Fisher公司。
1.2实验方法
1.2.1CRP重组蛋白的制备与鉴定 对GenBank提供的CRP 全长基因编码序列进行分析,在编码序列两端加上酶切位点EcoRⅠ和XhoⅠ及保护碱基进行全基因合成。双酶切载体 pcDNA3.1(+)后与同样酶切过的 CRP 基因片段连接转化,构建重组质粒并送往华大基因进行测序。将测序结果比对正确的CRP重组质粒转染进Expi 293真核表达系统中进行表达。
1.2.2免疫小鼠 用重组CRP蛋白免疫小鼠,免疫四周后初步检测抗体滴度,免疫6周后处死小鼠,取出小鼠脾脏,用剪刀剪碎脾脏组织并用胰蛋白酶将脾脏组织消化分离成单细胞。
1.2.3分离单个B细胞 利用不同荧光标记抗体anti-CD3、anti-CD8、anti-F4/80,anti-CD20对不同的淋巴细胞进行染色标记,同时加入抗原蛋白CRP制备的荧光标记探针对目标B淋巴细胞进行染色,借助流式细胞荧光分选技术FACS(Fluorescence activated Cell Sorting)从中分离出能表达特异性抗体的单个B细胞(CD3-/CD8-/F4/80-/CD20+/IgM-/IgD-/IgG+/Probe+)。
1.2.4扩增编码序列 提取单个B细胞的mRNA,进行RT-PCR合成cDNA,以cDNA为模板分别扩增出编码抗体轻重链的核酸序列,将编码序列酶切插入pcDNA3.1(+)载体中构建出编码特定抗体轻重链的重组质粒。
1.2.5真核表达系统制备抗体 将同一抗体的轻链质粒与重链质粒按1∶1 质量比混合后转染进Expi 293细胞中进行单克隆抗体轻重链的表达和组装,收集细胞培养液并用Protein A亲和纯化出单克隆抗体。SDS-PAGE电泳后用银染方法检测其纯度。
1.2.6ELISA生物素-亲和素检测体系的初步建立
1.2.6.1筛选特异性抗体 本实验采用间接ELISA法将重组CRP蛋白和CRP(+)血清1,CRP(+)血清2分别包被在酶联免疫微孔板上,浓度为1 μg/ml,筛选出能识别重组CRP蛋白及血清中CRP成分的单克隆抗体,并进一步检测已筛选的抗体对CRP识别的特异性。
1.2.6.2建立检测方法体系 将纯化后的特异性单抗作为捕获抗体稀释成不同浓度,在4℃条件下过夜,包被在酶联免疫微孔板上,采用常规实验方法对制备的另一特异性单抗进行生物素标记,进行不同比例稀释,通过棋盘滴定法确定配对抗体的最适工作浓度,见表1。
1.2.7ELISA体系性能的评估
1.2.7.1标准曲线的分析范围测试 将质量浓度为1 000 ng/ml的CRP重组蛋白作为检测标准品,用PBS倍比稀释成500、250、125、62.5、31.25、15.625、7.8125 ng/ml,用所建方法进行测定,以蛋白质浓度为横坐标,相应的A450 nm为纵坐标做标准曲线。
1.2.7.2精密度分析 用PBS分别将CRP重组蛋白分别稀释成150 ng/ml和100 ng/ml作为质控样品,用所建方法分4个批次分别测定上述样品,每批次设置8个复孔,分别计算批内精密度和批间精密度。
表1棋盘滴定确定工作浓度
Tab.1Optimizationofworkingconcentration

Dilution of biotin-labeled antibodyConcentration of capture antibody10 μg/mlN WP SP5 μg/mlN WP SP1∶2 0000.0440.6521.8840.0460.6781.8501∶3 0000.0100.3691.1320.0220.3841.0321∶40000.0010.2000.6710.0030.2070.5771∶6 0000.0040.1070.3040.0040.0920.249
1.2.7.3回收实验 用胎牛血清作为基质液,将CRP重组蛋白的检测标准品稀释成质量浓度为1 250、1 000、625、500 ng/ml,按以下方法配置实验样品:①基质液0.9 ml+PBS 0.1 ml;②分析样品1:基质液0.9 ml+1 250 ng/ml标准品0.1 ml;③分析样品2:基质液0.9 ml+1 000 ng/ml标准品0.1 ml;④分析样品3:基质液0.9 ml+625 ng/ml标准品0.1 ml;⑤分析样品4:基质液0.9 ml+500 ng/ml标准品0.1 ml。用所建方法测定上述样品,每份样品设置8个复孔,取平均值后计算回收率(回收率=检测值/实际值×100%)。
1.2.7.4与临床样品的比较 用ELISA检测体系分别对48例临床血清标本进行检测,以ELISA检测结果为横坐标,临床血清标本值为纵坐标绘制散点图并进行相关性分析。

2 结果
2.1重组CRP蛋白的表达与鉴定 将构建好的含CRP重组DNA的质粒转染进Expi 293细胞中进行真核表达,由于CRP的重组DNA在N端融合表达了一个6×His-tag的氨基酸序列,采用常规的Ni离子亲和层析柱进行纯化,SDS-PAGE电泳的银染结果显示重组CRP蛋白的纯度较高(图1)。
2.2单克隆抗体的制备和鉴定 重组CRP蛋白免疫小鼠后,筛选分离后获得4对抗体轻重链基因,表达纯化后SDS-PAGE电泳胶银染后可见清晰的轻,重链条带,且纯度较高(图2)。分别用重组CRP蛋白,CRP(+)血清1,CRP(+)血清2对纯化后的4个抗体进行筛选,最终获得2个能够特异性免疫CRP蛋白的单克隆抗体20#,22#(图3A)。分别以重组CRP、CRP+FBS、重组PCT、FBS作为检测原检测这2个抗体的特异性,最终,间接ELISA法结果显示20#,22#这两个抗体对CRP重组蛋白都具有良好的特异性,并且与无关蛋白PCT及FBS均不反应(图3B)。
2.3ELISA体系初步建立
2.3.1实验条件的初步优化 将抗体22#作为捕获抗体包被在酶联免疫微孔板上,浓度分别为10、5、1 μg/ml,生物素标记的抗体20#作为检测抗体用PBS按比例分别稀释为1∶2 000、1∶3 000、1∶4 000、1∶6 000,以强阳性OD值在1.0左右,阴性OD值<0.1为最适工作浓度。最终确定最佳的工作条件为:包被抗体5 μg/ml,检测抗体稀释度为1∶3 000。
2.3.2建立标准曲线 将质量浓度为1 000 ng/ml的CRP重组蛋白作为检测标准品,用PBS倍比稀释,以蛋白质浓度为横坐标,相应的A450 nm为纵坐标做标准曲线,回归分析结果显示CRP浓度介于15~250 ng/ml之间有较好的检测线性(y=0.003x-0.035 8,R2=0.997 4)(图4)。
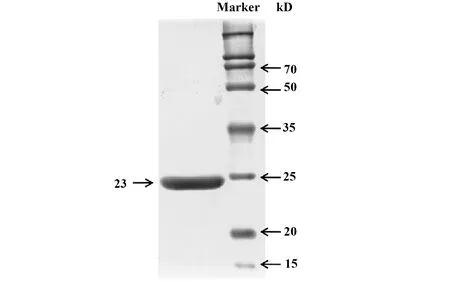
图1 纯化后重组CRP蛋白的SDS-PAGE电泳Fig.1 SDS-PAGE of purified recombinant CRP
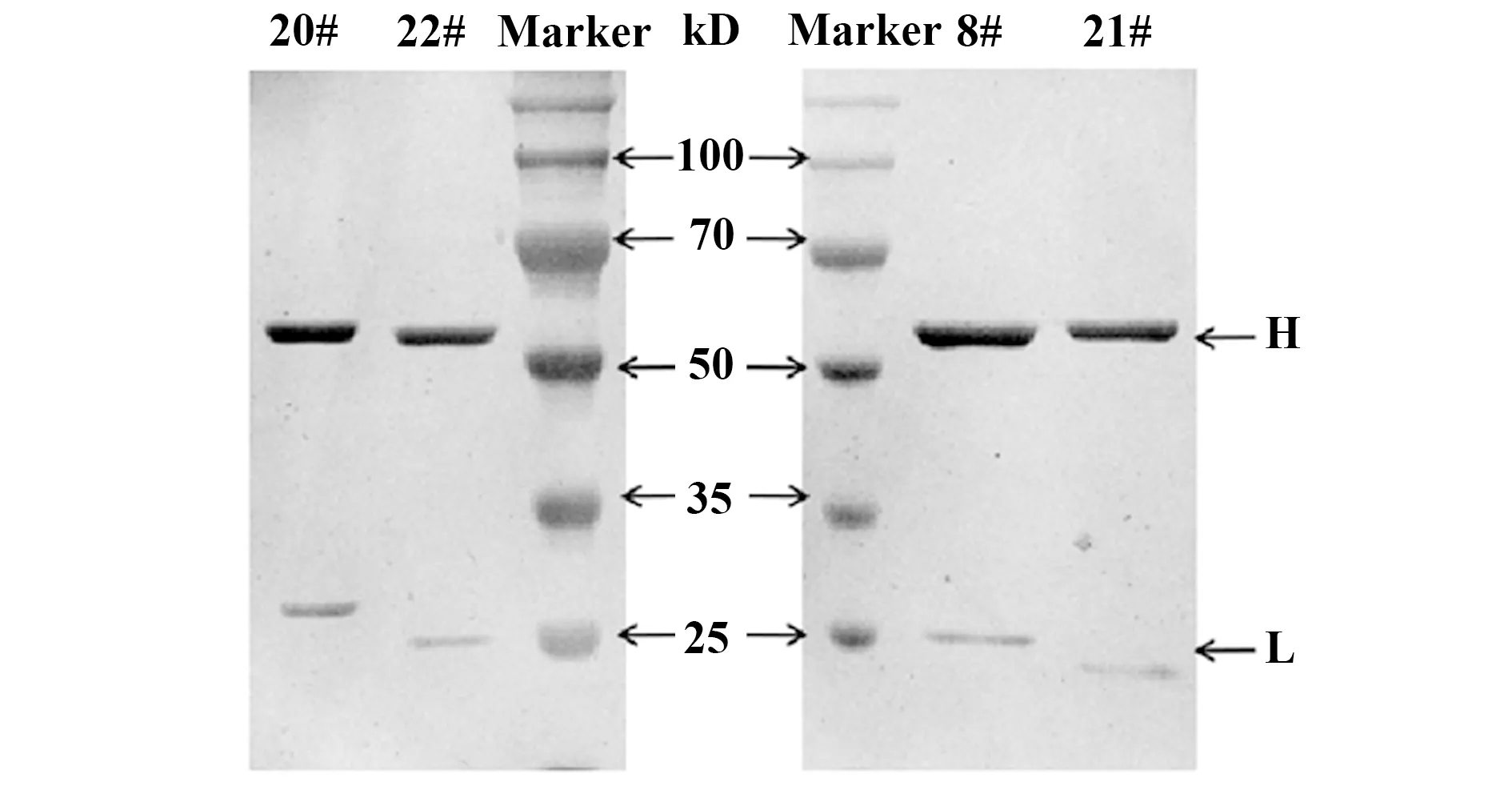
图2 纯化后抗体的SDS-PAGE电泳Fig.2 SDS-PAGE of purified antibodyNote: H.Heavy chain of antibody;L.Light chain of antibody.

图3 单克隆抗体特异性检测Fig.3 Specific identification of monoclonal antibodyNote: A.Specific identification of different monoclonal antibody by ELISA;B.Specific identification of different protein;n=3,P<0.000 1.
表2精密度分析
Tab.2Imprecisionofintra-assayandextra-assay

Standard ofCRP (ng/ml)Intra-assay precisionx±s(ng/ml)cv(%)Inter-assay precisionx±s(ng/ml)cv(%)10099.00±6.706.7097.63±8.328.52150153.03±14.349.37145.65±13.259.10
表3回收率分析
Tab.3RecoveryassayofCRP
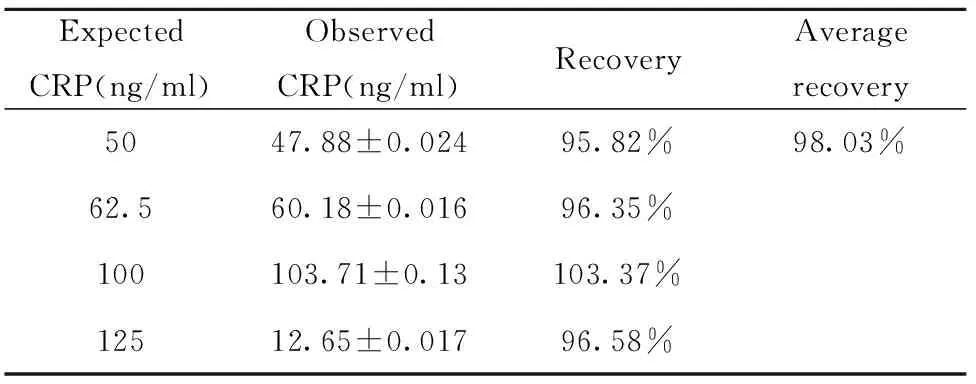
ExpectedCRP(ng/ml)ObservedCRP(ng/ml)RecoveryAveragerecovery50 47.88±0.02495.82% 98.03% 62.5 60.18±0.016 96.35% 100 103.71±0.13103.37% 125 12.65±0.017 96.58%

图4 CRP 的ELISA检测体系线性范围分析Fig.4 Linear range of ELISA system for CRP
2.3.4精密度 本研究使用精密度实验确定CRP检测的可重复性,结果显示批内变异系数CV(变异系数CV=标准方差SD/平均值Mean×100%)为6.7%~9.37%,小于标准值10%,批间变异系数为8.52%~9.10%,小于标准值15%,说明本法检测CRP的精密度良好(表2)。
2.3.5回收率 回收率实验中,不同浓度的CRP检测的回收率介于95%~103%之间,平均回收率为98%,说明本法对CRP检测具有较好的准确性(表3)。
2.3.6与临床样品检测值的比较分析 同时对48例新鲜临床血清样品进行检测,对比临床检测数值,检测结果行线性回归分析(y=0.950 7x+0.956 1,R2=0.976 1),两者检测结果有良好的相关性(图5)。

图5 ELISA检测与临床样品检测相关性分析Fig.5 Linear correlation between ELISA and clinical sample
3 讨论
单克隆抗体技术是现代生命科学研究的重要工具,单克隆抗体的应用涉及医学、食品、环境等众多邻域,其在基础研究、蛋白纯化、环境及食品监测、疾病诊断、预防及治疗方面均有不可代替作用[8]。相较于传统的单克隆抗体制备技术,单个B细胞技术可以直接从人体外周血中分离出特异性B细胞,以此为模板扩增编码基因,省去了动物源到人源的改造步骤,所制备的全人源化单克隆抗体在治疗和研究自身免疫性疾病和人类免疫系统等方面有突出优势。目前单个B细胞抗体制备技术已经应用于制备多种抵抗病原微生物感染的高度特异性人源抗体,如HIV 抗体、破伤风抗体、乙肝抗体、流感抗体等[9-12]。虽然单个B细胞法制备单克隆抗体技术已经成为众多科研机构的重要研究工具,但该技术涉及到众多的技术平台和关键技术。不同的实验室在围绕此技术的不同环节各有侧重和优势,但缺乏对整套技术的完整把握,这些问题极大地阻碍了该技术的推广和应用。随着B 细胞分选技术、后续 PCR 扩增基因方法以及抗体基因高通量分析鉴定等方法的成熟和完善,未来单个B 细胞抗体制备技术仍然将在诊断、药效学及临床应用中发挥重大作用。本研究将单个B细胞抗体制备技术结合Exip 293真核表达系统制备的hs-CRP单克隆抗体20#,22#对重组CRP蛋白以及CRP(+)血清都具有良好的特异性和高灵敏度,达到了hs-CRP检测要求,为进一步的免疫检测试剂盒研发及其他检测方法体系奠定了良好基础。

