醋酸对轻烧氧化镁水化的影响研究
颜粉鸽,黄建翠,凌观爽,翟 俊,宗 俊
(华东师范大学化学与分子工程学院化学系,上海 200241)
1 前言
氢氧化镁(Mg(OH)2)作为一种无机环保材料,已被应用于许多工业领域,如中和酸性工业废水、制备抗酸药以及烟气脱硫等[1-4]。 特别是在聚合物生产中,氢氧化镁广泛用作阻燃剂和抑烟添加剂,因为它具有较高的分解温度,在高温下分解释放出水,既能降低聚合物内部的温度以防遇火燃烧,也不会产生有毒和腐蚀性的物质[5-6]。
氧化镁水化法是制备氢氧化镁常用的一种方法,虽然操作简单,但水化过程复杂,影响水化率的因素很多,因此,必须严格控制反应条件才能制备高质量的氢氧化镁。自 20 世纪 60 年代以来,许多国内外学者针对氧化镁水化动力学提出了几种不同的水化机理,包括“缩核”[7-8], “成核—晶体长大”[9-10]和“溶解—重结晶”[11-13],其中“溶解—重结晶”机理被广泛认可,该机理提出氧化镁分解过程是水化反应的速控步。
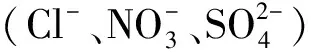
2 实验部分
2.1 实验原料
轻烧氧化镁(西藏昌都菱镁矿石1 000 ℃煅烧产物);去离子水(实验室自制);醋酸(分子质量=60 g/mol,纯度=99.7%);无水乙醇。
图1为不同粒径轻烧氧化镁颗粒分布(由BT-9300S激光粒度分析仪测定),表1为其物理性质。
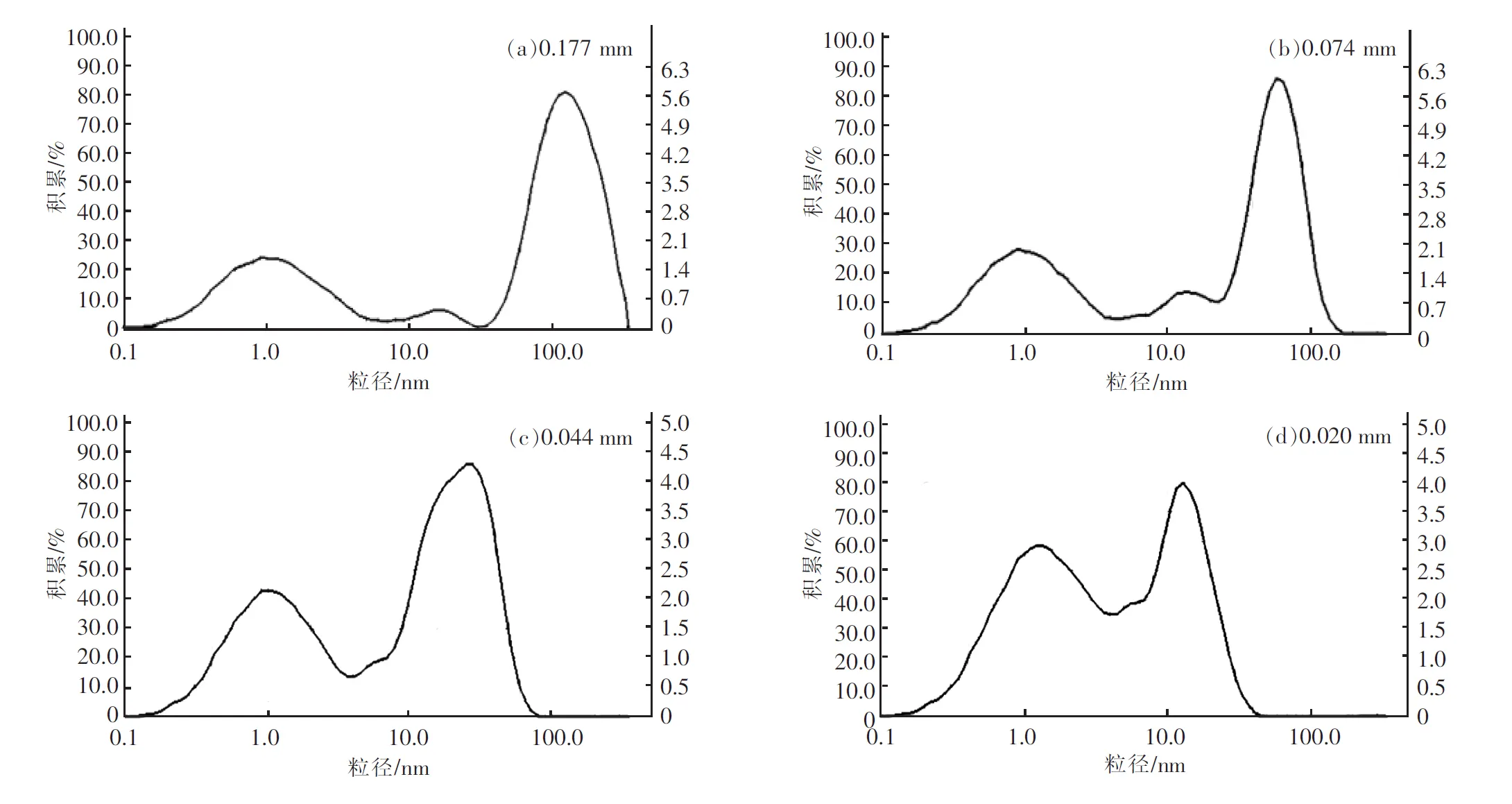
图1 不同粒径轻烧氧化镁颗粒大小分布Fig.1 Particle-size distribution of light burned magnesium oxide obtained via laser diffraction technique(Mastersizer BT-9300S)

表1 不同颗粒度轻烧氧化镁物理性质Tab.1 Physical properties of different particle-size light-burning magnesium
2.2 水化反应
准确称取3 g轻烧MgO,加入到150 mL热溶液中,超声分散,水浴加热,回流进行水化反应。反应结束,悬浮液自然冷却,然后真空抽滤,依次用蒸馏水、无水乙醇洗涤滤饼,再将水化产物放于150 ℃ 鼓风干燥箱内烘干至恒重,得白色细小的固体粉末。准确称取水化产物,放在已恒重的瓷坩埚中,500 ℃煅烧2 h,称量煅烧前后的样品质量。按以下公式计算不同条件下氧化镁的水化率:
式中:α——氧化镁的水化率,%;m1——水化产物未煅烧的质量,g;m2——水化产物煅烧后的质量,g;40/18——MgO与H2O摩尔质量之比。
2.3 水化产物特性表征
用S-4800冷场发射扫描电子显微镜(日本,日立公司)观察水化产物形貌和结构;X射线粉末衍射仪(德国,Bruker公司)进行物相分析,参数设置(CuKα 辐射,λ=1.541 8 Å,镍滤光片,25 mA,35 kV,扫速= 30 °/min);用差热热重分析仪(TGA/SDTA851e)(瑞士,梅特勒-托利多仪器公司)分析产物氢氧化镁的热分解过程,参数设置(温度范围:室温~800 ℃,升温速率20 ℃/min,N2氛);Nicolet iS50傅立叶变换红外光谱仪(美国,thermo公司)分析水化产物结构及化学键,采用KBr 压片,波数范围为400 cm-1~4 000 cm-1。
3 结果与讨论
3.1 轻烧氧化镁水化条件的探究过程
3.1.1 探究在水溶液中水化温度、时间和搅拌速度对水化率的影响(图2)
如图2(a),随着水化温度的升高,反应速率增大,水化程度随之增加。在低温区(30 ℃~50 ℃),反应速率增大较快,水化率增大较明显。而在高温区(70 ℃~90 ℃),反应速率增大较慢,水化率增大不明显。80 ℃ 后基本保持不变。考虑到温度高会消耗更多的电能,增加成本。因此,选择80 ℃ 为最佳水化温度,水化率达72.91 %。
如图2(b),水化温度80 ℃,反应时间小于1.5 h,轻烧氧化镁的水化率低于70%,氧化镁水化不充分。水化初期(0.5 h~2 h)反应速率较快,水化率增大较多。当反应2 h 时,水化率达到72.76%。随着时间的延长(超过2 h),水化程度变化幅度缓慢,水化率趋于稳定,说明反应已基本完全。因此,确定2 h 为最佳反应时间。
如图2(c),搅拌速度增大(0 r/min~1 400 r/min),氧化镁水化率缓慢增加。但当搅拌速度增大到2000 r/min时,水化率又明显降低。因为在磁场力的推动下,磁转子在静止的液体中旋转引起周围流体作圆周运动,增加了两相物质的碰撞机率,不仅使反应物混合更均匀,也加快了反应速率。当转速超过某一数值时,水化率反而降低,这是因为转速过大,在漩涡内部会形成一个密集的水化区域,大部分氧化镁颗粒聚集于此,减少了与水的接触面积和碰撞机会,使得反应不完全,导致水化率大大降低,从76.93%(1 400 r/min)降到了69.65%(2 000 r/min)。

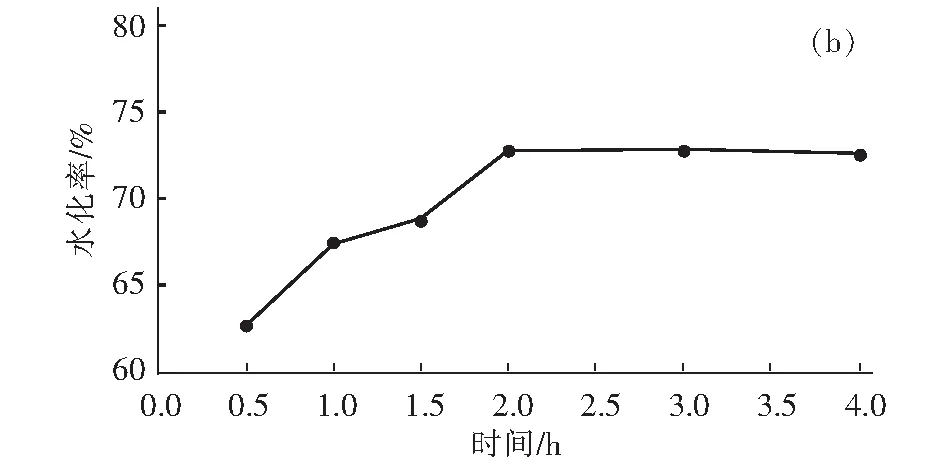
图2 水溶液对氧化镁水化率的影响Fig.2 Effect of aqueous solution on hydration rate of magnesium oxide
3.1.2 探究在醋酸溶液中醋酸浓度、液固比和氧化镁颗粒度对水化率的影响(图3)
根据Filippou et al.[17]提出的水化机理,醋酸作为水化剂时,轻烧氧化镁水化反应如下:
醋酸解离:
CH3COOH(aq)+H2O
H3O+(aq)+CH3COO-(aq)
(1)
氧化镁在络合作用下逐渐溶解,不断地释放出OH-和Mg2+:
MgO(s)+CH3COO-(aq)+H2O→
CH3COOMg+(aq)+2OH-(aq)
(2)
CH3COOMg+(aq)→
CH3COO-(aq)+Mg2+(aq)
(3)
当溶液达到过饱和时,氢氧化镁沉淀生成:
Mg2+(aq)+2OH-(aq)→Mg(OH)2(s)
(4)
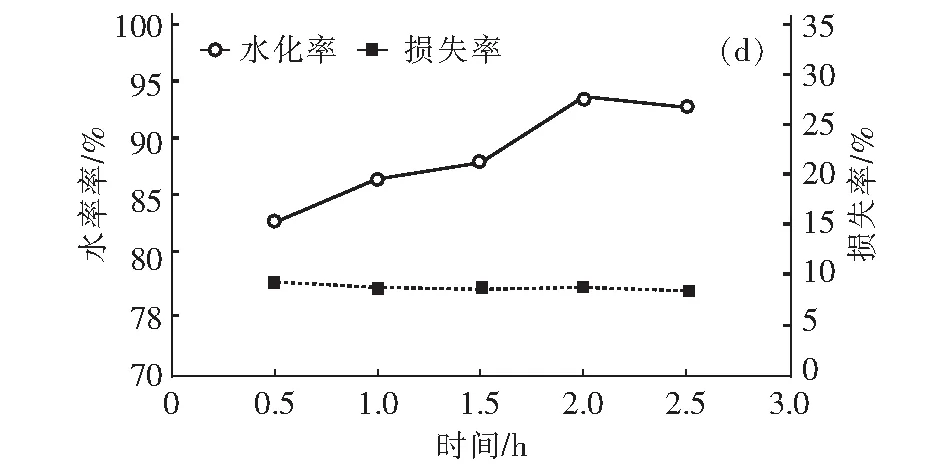
图3 CH3COOH溶液对氧化镁水化率的影响Fig.3 Effect of acetic acid solution on hydration rate of magnesium oxide
如图3(a),随着醋酸浓度的增大,水化率逐渐增大,损失率也增大。因为CH3COOH解离产生了CH3COO-和H+,CH3COO-吸附在MgO表面,形成络合物CH3COOMg+,促进水化反应。但是H+导致固相中一部分MgO溶解到溶液中生成Mg(CH3COOH)2,随滤液流失;继续增大醋酸浓度,虽然水化率超过了90%,但水化产物量大幅度减小,产率大大降低。因此,确定醋酸的最适宜浓度为0.07 mol/L。
如图3(b),随着液固比的增大,水化率先增大后减小,损失率持续增大,但增大不明显。溶液体积过小时,空间位阻增大,导致CH3COO-难以与MgO络合,不利于水化反应进行;溶液体积增大,两者接触面积增大,碰撞机会增多,因此,将有更多的CH3COO-附着在MgO表面,增大水化率;当溶液体积增大到一定程度,水化率又降低,因为两者之间的距离增大,导致碰撞的机会又减少。
如图3(c),随着网筛孔径的缩小,氧化镁颗粒越小,表面积越大,为醋酸的吸附提供了更多的位点,在MgO和CH3COOH络合的位点周围将集聚大量的水分子,有利于水化反应形成Mg(OH)2,因此,水化率呈增大趋势,而氧化镁的损失率基本不变,综合反应,选定0.020 mm直径氧化镁作为镁源。
如图3(d),用已探究的最佳实验条件进行水化反应得到不同时间水化率及损失率。反应时间小于1.5 h,水化率不超过90 %;继续反应至2 h,水化率增加到了93.81%,再增加反应时间水化率基本不变。整个反应过程中,氧化镁损失率无明显变化。最终确定反应时间为2 h。
3.1.3 MgO-H2O和MgO-CH3COOH溶液体系pH值变化(图4)

图4 MgO-H2O和MgO-CH3COOH溶液体系pH值变化Fig.4 Variation of pH in MgO-H2O and MgO-CH3COOH solution system
在MgO-H2O溶液体系中,溶液pH值随时间变化缓慢,pH值变化范围为11.53~11.66。在MgO-CH3COOH溶液体系中,刚加入MgO瞬间溶液pH值为11.22,随着反应进行,pH值从11.22变到了10.51,因为CH3COOH解离产生的H+中和了一定量的OH-。在0.5 h ~ 1.5 h内pH值保持相对稳定,因为解离生成的CH3COO-和CH3COOH本身构成了一个缓冲体系。在1.5 h ~ 2 h内,水化率变化显著,如图3(d),说明此阶段生成了更多的Mg(OH)2,消耗了大量的OH-,所以,溶液pH值降低。
3.2 水化产物特性表征
3.2.1 水化过程XRD分析(图5)
图5(a)为原料MgO的XRD图,与标准图谱MgO(JCPDS:45-0946)一致,但在2θ=18.57° 处出现一个很小的Mg(OH)2特征峰,这是因为原料轻烧氧化镁在放置过程有少量潮解。图5(b)是氧化镁水化不同时间的产物XRD图谱,随着水化时间的延长, MgO特征峰强度逐渐降低,同时出现了Mg(OH)2的特征衍射峰,与标准图谱Mg(OH)2(JCPDS:44-1482)相一致。水化反应2 h时 2θ=42.99 °和62.30 °的两个MgO衍射峰仍然存在,说明水化产物中还含有一少部分氧化镁,与测得的水化率结果相一致,这与原料氧化镁本身的活性有很大关系。

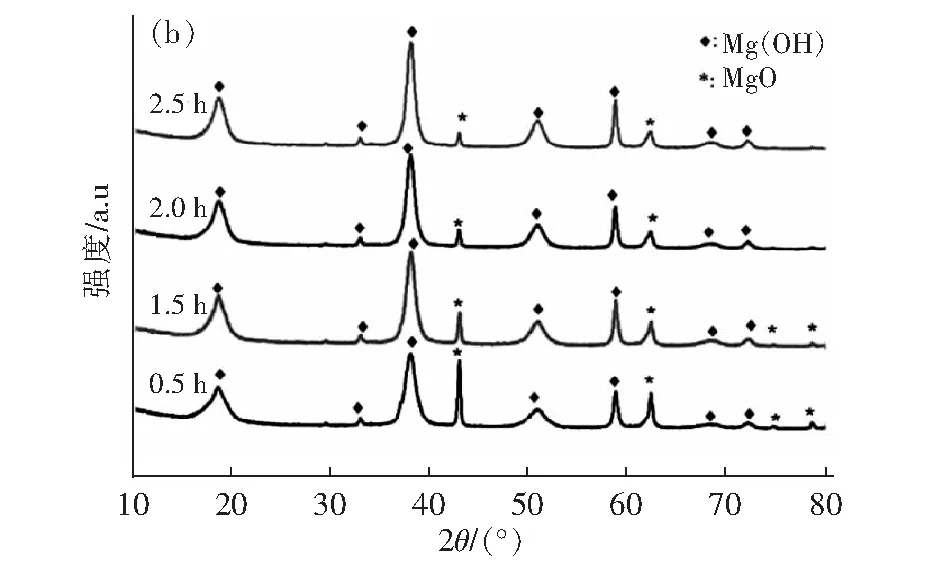
图5 轻烧氧化镁(a)和不同反应时间的水化产物(b)XRD图谱Fig.5 XRD pattern of Light burned magnesia(a)and hydration products at different reaction time(b)
3.2.2 水化产物SEM 分析(图6)
如图6(a),原料氧化镁表面平整致密,呈不规则的V 型、L 型等短棒状结构,分散性好。当氧化镁与水接触,结构发生了明显变化(如图6(b))。棒状消失,出现了薄片状,片层的边与边、边与面之间互相嵌套形成“卡房”状,这种结构与C.Henrist等[21]的实验结论一致。在0.07 mol/L CH3COOH溶液中水化 0.5 h,产物初有片状,但形状不明显(如图6(c));反应2 h时有大量的氢氧化镁片状生成,轮廓较清晰(如图6(d)),块状团聚体显著减少,片层结构明显增多,进一步表明醋酸能够促进氧化镁的水化。

图6 原料MgO和水化产物的SEM图Fig.6 SEM image of light burned magnesia and hydration product
3.2.3 水化产物TG-DTG 图(图7)

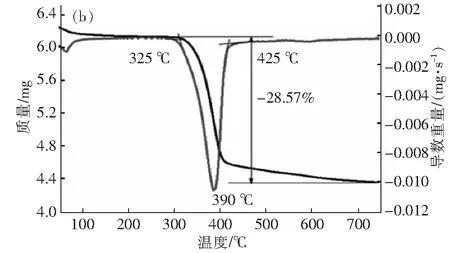
图7 水化产物TG-DTG曲线(a)H2O(b)CH3COOHFig.7 TG-DTG curves of hydration product(a)H2O(b)CH3COOH
图7(a)和图7(b)分别为氧化镁在水和醋酸溶液水化反应产物TG-DTG曲线,比较两条TG曲线可以看出,Mg(OH)2的分解包含两个阶段:第一阶段在50 ℃~150 ℃范围内,因氢氧化镁表面的吸附水或结晶水蒸发导致质量均有所减小,但是b对应的水化产物失水更多,说明产物中含有更多的结晶水。第二阶段是氢氧化镁分解生成氧化镁和水的过程,热失重率分别为25.63 % 和28.57%,b的质量损失更多,说明醋酸有利于生成更多的氢氧化镁。比较两条DTG曲线可知,b产物的初始分解温度相比于a降低了12.5 ℃,在温度390 ℃处两者的失重速率均达到最大值,说明此时氢氧化镁转变为氧化镁的速率最快,生成的氧化镁相比于其他温度更多。当温度达到425 ℃ 时两者都分解完全。
3.2.4 水化产物红外光谱分析(图8)
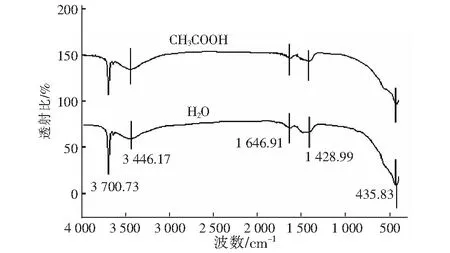
图8 水化产物的FT-IR 图谱Fig.8 FT-IR spectrum of hydration products
图8显示氧化镁在水和醋酸溶液中水化反应的产物IR峰型,它们均在3 700.73 cm-1、3 446.17 cm-1、1 646.91 cm-1、1 428.99 cm-1和435.83 cm-1处有强的吸收峰。3 700.73 cm-1处形成的尖峰是Mg(OH)2的-OH的伸缩振动峰,3 446.17 cm-1处的峰是由于H2O分子与H2O分子之间或H2O分子与Mg(OH)2中的H和O原子之间形成氢键,出现了-OH的特征展宽峰。[22]1 646.91 cm-1和1 428.99 cm-1处的峰分别是Mg-OH和-OH的弯曲振动,而435.83 cm-1处的峰是Mg-O键的伸缩振动峰。以上的吸收峰表明水化产物中主要是Mg(OH)2和MgO的混合物,不含有醋酸盐化合物,此结果与XRD的测试结果相一致。
4 结论
1)以轻烧氧化镁为原料,醋酸作为水化剂,探究了氧化镁水化最佳的反应条件:反应温度80 ℃,反应时间2 h,搅拌速度1 400 r/min,醋酸浓度0.07 mol/L,氧化镁与溶液质量体积比1 ∶30,氧化镁颗粒度20 μm。在此条件下反应,水化率达到93.81%。
2)在MgO-CH3COOH溶液体系中,CH3COOH解离生成CH3COO-和H+,CH3COO-吸附在氧化镁表面,与Mg2+结合形成中间体络合物CH3COOMg+,进而促进了水化反应过程,生成了更多的氢氧化镁,且水化产物中未引入其他物种。
3)水化产物中氢氧化镁呈“卡房”状结构,且醋酸没有改变其形貌。

