动物炭疽病的病理及防控建议
覃春英
(杨凌宝味生物科技有限公司,陕西 杨凌 712100)
炭疽病在全世界广泛传播,曾经被用作生化武器,对人类的健康、畜牧业的发展及社会的稳定有重要的影响。最早分离出炭疽杆菌并证明炭疽杆菌就是炭疽病病原的是德国科学家科赫,为表彰其在此方面的贡献,科赫获得了1905年的诺贝尔生理与医学奖[1]。炭疽杆菌有营养体和芽孢两个状态。在感染初期到病死早期,炭疽杆菌主要以营养体的形式存在。感染者死后较长时间,在低CO2条件下,炭疽杆菌营养体产生芽孢,并释放到环境中。芽孢一旦感染生物体会再次转化成营养体。芽孢对pH、温度、压力、干燥及各种化学剂有很强的抵抗能力,因此存活时间长达两百年以上。
炭疽杆菌主要由呼吸道、皮肤伤口、消化道等途径感染。炭疽早期症状是感染者起初情绪兴奋,接着抑郁,发热,黏膜出血,肌肉颤抖,没有食欲,进食量减少,后期主要症状是颈部、胸部、腹部等皮肤出现渗血性脓包,血液从口腔、鼻子、肛门等渗出,最后休克致死,死后血液凝固不良。
草食动物易感染炭疽杆菌,其次是杂食性动物和肉食性动物,按照易感程度降序排列分别是牛、绵羊、马、猪、山羊、骆驼、驴、螺、斑马、鹿等,人也属于易感者。相对草食动物,猪和腐食动物对炭疽杆菌有一定的抵抗能力,可能是一些草食动物没有上门牙,它们在采食过程中容易发生口腔上颚皮肤出现微创口,分布于自然界的炭疽杆菌芽孢由伤口进入引发感染[2]。
1 炭疽病的病理
炭疽病主要由炭疽杆菌的pXO1和pXO2两个毒性质粒引起的。pXO1全长182 kb,编码三个蛋白质,分别是锌金属蛋白酶,即致死因子(LF)、钙调素依赖的腺苷酸环化酶,即水肿因子(EF)和保护性抗原(PA)。pXO2编码线性多聚D-谷氨酸包囊(CAP)蛋白,见图1。
PA是一个83kD的起转运作用的蛋白质,可识别宿主细胞膜上的肿瘤内皮细胞标记8(TEM8)和毛细血管发生蛋白2(CMG2)。这两个蛋白常表达于许多类型细胞的表面,尤其是免疫细胞。PA结合细胞表面受体后被弗林蛋白酶(furin)切割,释放活性成分的C端(20kD),C端自发寡聚化,形成一个7聚体(PA63)7。7聚体分别与LF和EF结合,形成复合物(PA)7-LF和(PA)7-EF,在动力蛋白-网格蛋白依赖的细胞内吞作用下进入细胞。在酸性内体的条件下,复合物(PA)7-LF和(PA)7 -EF构象发生改变,并被转运到晚期内体,释放毒性因子EF和LF。
细胞内的EF是一个钙调素依赖的酸苷环化酶,可促进细胞产生高浓度的环腺苷酸(cAMP)。环腺苷酸减少Cl-和水的外流,导致组织水肿,同时抑制呼吸爆发并刺激炎性因子的产生。随后LF促进裂原蛋白活化激酶激酶(MEKs)剪切活化,发生级联反应。MEKs是一条与促炎因子和一些免疫反应活化相关蛋白的细胞信号通路。LF的活化最终导致宿主休克。胞内囊泡中的LF和EF可以转移至旁边未感染的细胞,呈现持续的毒性作用,见图1。
pXO2编码的CAP可以使宿主逃避巨噬细胞的吞噬作用,由此逃避宿主的免疫,促进败血的发生[3-4]。
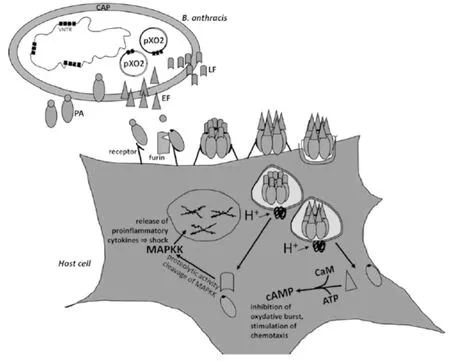
图1 炭疽杆菌的致病机理[4]
2 动物炭疽病的防控建议
2.1 严守相关技术规范
动物一旦确诊为炭疽病,应该严格按照农业部关于《炭疽防治技术规范》进行防治。虽然炭疽杆菌对青霉素等抗生素敏感,但炭疽杆菌在感染生物体后,炭疽杆菌的毒性因子已释放到细胞内,并可转移至旁边未感染的细胞,因此单纯靠抗生素来治疗炭疽病不易根治,且有扩大传染的风险。因此牧群中出现疫情,一定及时报告相关部门,逐一排查,做好隔离工作。对于未感染的动物要做好免疫防疫工作,而对已感染的动物则进行无血扑杀,并做无害化处理。
2.2 对饲草的来源做好跟踪检查工作
青海某奶牛场2016年9月发生的奶牛感染炭疽杆菌事件,可能的原因是喂养了从炭疽疫区收割回来的饲草[5]。因此在放牧或者喂养饲草之前,要确定动物所食用的草料不在疫区或患畜无害化处理区域。
2.3 加强对农民的教育,增强防疫意识
2016年5月,新疆T县出现10例皮肤炭疽,其原因是村民为减少经济损失,宰杀病牛,并以低于市
场的价格出售导致宰杀人员和食用者发生感染[6];2018年4月,宁夏海原县发生3例人患皮肤炭疽的事故,原因在于3名患病者在患病前宰剥一头病牛和一只病羊。牛羊的经济价值较高,对于学识有限的农民来说是家畜患病是不小的损失,为把损失减到最小,农民心存宰杀病畜的想法。以畜牧业为主的地方政府有义务对散养农户进行定期集中培训,增强疫病的防控意识,同时考虑建立村村实时监控饲养牲畜的状态的机制,防治疫病的爆发。
3 小结
炭疽杆菌的致病因子分别是由毒性质粒pXO1和pXO2编码的致死因(LF)、水肿因子(EF)、保护抗原(PA)以及线性多聚D-谷氨酸包囊(CAP),由此可以LF、EF、PA和CAP作为鉴定炭疽杆菌的分子标志,并以此为靶点设计相应的药物。由于自然界的炭疽杆菌的孢子容易扩散,且不易清除,加之炭疽病传染性强,因此应当增强防控炭疽病的意识,严格按照相应的规范进行防控。

