微透析法研究六味地黄丸在肾阴虚糖尿病大鼠模型的药动学
王华富,桂志红,张小如,叶一萍,丁 汀,储卫华
(1.丽水市人民医院临床药学科,丽水 323000;2.丽水市人民医院肾内科,丽水 323000;3.丽水市人民医院中医科,丽水 323000;4.中国药科大学生命科学与技术学院,南京 210009)
肾阴虚型糖尿病的症状主要为尿频量多、混浊如脂膏、尿甜、口干、头晕和腰腿酸痛[1]。六味地黄丸作为治疗肾阴虚型糖尿病的主要药物,其使用剂量依医生经验给出。本次实验利用微透析取样法,采集肾阴虚型糖尿病大鼠模型的透析液,并处理大鼠的糖尿病效应细胞[2],检测效应细胞的变化情况,进而得到六味地黄丸对肾阴虚型糖尿病效应细胞的 “药物剂量/D-时间/t-效应/E”模型,得出具有临床意义的六味地黄丸给药方案。
1 仪器与材料
1.1仪器 微透析系统,包括CMA402微透析泵、CMA12Elite PAES微透析探针(膜长1 mm)和CMA/170微透析样品收集器3部分,均为瑞典CMA公司生产;XR 205SM DR分析天平(瑞士Precisa公司)。
1.2材料 药物:六味地黄丸(浓缩丸,北京同仁堂科技发展股份有限公司制药厂)。
肾阴虚型糖尿病模型大鼠[3]:选择大鼠高脂蔗糖饮食联合热应激处理造模方法,成年雌性Wistar大鼠,给予主要含质量分数为20%的猪油和50%的蔗糖为食料,造模时每天被置于干燥球室40球、湿球32球的人工气候室内进行热应激3 h处理。
试剂:质量浓度为20 g·L-1的戊巴比妥钠溶液(购自Sigma Aldrich公司,批号69020100)。D-Hanks液(批号14170-112),Hanks液(批号14025-076),Kreb-hepes缓冲液(批号15630080),PBS缓冲液(批号20012-043),均购自赛默飞世尔公司。质量浓度为4 g·L-1的台盼蓝(Solarbio公司,批号T8070),1%胶原酶Ⅱ型(YEASEN公司,批号40508ES60),体积分数为10%的胎牛血清(Science Cell公司,批号0500)。100 u·mL-1青霉素(批号Z130437)和质量浓度为100 μg·mL-1的链霉素(批号S66602),上海源叶生物科技公司。质量浓度为0.167 mg·mL-1的LiberaseRI酶溶液(罗氏生物公司,批号11213865001),Ficoll溶液(南京森贝伽生物科技有限公司,批号SBJ-0155),5%肝素钠(上海阿拉丁生化科技股份有限公司,批号9041-08-1)。丹皮酚(批号552-41-0),马钱苷(批号18524-94-2),莫诺苷(批号25406-64-8),芍药苷(批号23180-57-6),均购自成都德思特生物技术有限公司。林格氏液(NaCl 8.5 g,KCl 0.3 g,CaCl20.33 g,ddH2O 1 L)。
2 方法
2.1糖尿病效应细胞的分离和培养 模型大鼠肝细胞的分离纯化和培养[4-5]:成年雌性Wistar大鼠,腹腔注射质量浓度为20 g·L-1的戊巴比妥钠溶液麻醉(30 mg·kg-1),200 u肝素钠溶液。皮肤消毒后,腹部切开U形切口,暴露门静脉,导管从门静脉插入2 cm。导管连接到一次性输血器。后端被连接到输液瓶,注射用无钙和镁的Hanks液(EDTA 1 mmol·L-1的溶液)200 mL,从下腔静脉导管注射Hanks液(含有质量浓度为0.5 g·L-1的Ⅱ型胶原酶)100 mL,静滴速率为15 mL·min-1。取出肝脏,置于含Hanks液的平板上,在4 ℃清除肝包膜和血管肝静脉闭塞,钝性撕肝组织,并透过多层纱布制成细胞悬液。滤过200目不锈钢筛网,以42 g·min-1离心2 min,弃上清液用Hanks溶液,4 ℃离心3次,除去非肝细胞。通过质量浓度为4 g·L-1的台盼蓝染色测定细胞活性。分离钝化的肝细胞合成培养基(含体积分数10%胎牛血清的DMEM)在37 ℃ CO2培养箱中培养6 h,在倒置相差显微镜下观察6 h后的生长情况。
模型大鼠脂肪细胞的分离纯化和培养[6]:分离大鼠脂肪组织,立即放在Kreb-HEPES缓冲液(KRHB)中,转移到低温实验室。在超净台中分离并去除脂肪组织中的白色筋膜和血管,KRHB溶液洗涤3次。切碎脂肪组织,放在含体积分数5%胎牛血清白蛋白的质量浓度为10 g·L-1Ⅱ型胶原酶中消化,37 ℃摇床振荡1 h,100目过滤网筛细胞,滤液以1 000 r·min-1离心5 min,收集,脂肪细胞浮在最上面,再加上含有100 u·mL-1青霉素、质量浓度为100 mg·mL-1的链霉素和体积分数为10%的胎牛血清的完全培养基,6孔板培养后计数。
模型大鼠胰岛β细胞的分离纯化和培养[7-8]:成年雌性Wistar大鼠断脊椎处死,胆总管结扎至十二指肠。破碎心脏放血,立即用质量浓度为0.167 mg·mL-1的LiberaseRI酶溶液通过原位快速原位灌注胰腺胆总管,钝性解剖分离。把胰腺置于50 mL离心管中,37 ℃水浴,同时加入适量消化液静止消化30 min。消化结束后用Votex振荡仪剧烈振荡消化管10 s,终止消化时加入等量PBS缓冲液保存于4 ℃的PBS缓冲液中。分别用直径1.0和0.5 mm的不锈钢滤网过滤消化物,离心,得到糜状消化终产物;把4 mL质量浓度为0.25 g·L-1的Ficoll溶液加入到消化终产物中,涡旋混匀,从下往上逐层加入质量浓度为0.11,0.21和0.23 g·L-1的Ficoll溶液各2 mL,形成界面清晰的密度梯度离心溶液。用水平转头进行离心分离,自然加速,零阻力降速,在21%和11%界面分层处吸出细胞团,该细胞团即为纯化的胰岛β细胞,双硫腙特异染色法鉴定胰岛β细胞纯度。
2.2微透析取样技术的建立 将阴虚糖尿病模型大鼠仰位固定,颈部剪毛备皮,消毒后在大鼠颈部右侧沿颈静脉方向剪2~3 cm的切口,钝性分离颈静脉,结扎远心端,并剪一小口,将浸泡在质量浓度为50 g·L-1的肝素钠注射液中20 min以上的血液探针朝右心室方向植入约2.5 cm,并用缝合线固定探针。探针植入24 h后,用含不同质量浓度丹皮酚、马钱苷、莫诺苷和芍药苷的林格氏液以1.5 μL·min-1的流速灌注探针,平衡1 h后,开始采样,20 min为取样间隔,每份样品20 μL,及时采用HPLC法直接进样测定,共3次,计算探针的相对回收率,评价微透析系统的实用性和稳定性。测定探针的相对回收率后,以2 μL·min-1灌注速度灌注PBS缓冲液,洗脱1 h,开始给药[9]。
2.3效应细胞的筛选 针对单一细胞,将40只肾阴虚型糖尿病模型大鼠均分为2组,每组20只,实验组喂服六味地黄丸5倍等效剂量,对照组喂服等量生理盐水,处理24 h,然后用微透析法采集透析液,并用该液处理提取的细胞,2 h后检测葡萄糖浓度,从而检测糖尿病模型大鼠制备的肝细胞、脂肪细胞及胰岛β细胞对5倍六味地黄丸临床等效剂量多次给药所得微透析液的敏感程度。检测肝细胞和脂肪细胞对糖代谢的影响[10],检测胰岛β细胞功能的变化[11]。选取药物反应变化幅度最大的细胞作为糖尿病敏感效应细胞。
2.4给药模型的建立和验证 各实验组用20只肾阴虚型糖尿病模型大鼠,选择6,8和12 h 3个给药时间间隔,各给药间隔设置4个剂量组,分别为0.5,1,1.5和2倍等效剂量,1倍等效剂量为每次0.1 mg,喂药前和喂药48 h后分别收集微透析液,用上一步骤选定的胰岛β细胞消化透析液,处理2 h后检测葡萄糖浓度,分析浓度变化并给出最优给药方案。
2.5最优给药方案与常规方案比较 实验组使用20只肾阴虚型糖尿病模型大鼠,以2.4项下步骤确定的最优方案给药,分别收集给药后4,8,12,16,24,36,48和72 h的微透析液,处理胰岛β细胞2 h后检测葡萄糖浓度;对照组采用常规给药方案,即间隔8 h、1倍等效剂量,同样收集上述几个时间点的微透析液并处理效应细胞,检测葡萄糖浓度。比较检测结果,分析优化后的给药方案是否比常规方案有优势。

3 结果
3.1糖尿病效应细胞的筛选 六味地黄丸多次给药所得微透析液中既含有血糖又含有药物成分,故可作为参考指标考量细胞的糖代谢能力,用提取的3种细胞消化微透析液(服药24 h后),2 h后检测葡萄糖浓度。结果表明,3种细胞处理的含药微透析液葡萄糖浓度均比服用生理盐水显著下降(P<0.01),但胰岛β细胞相较于肝细胞和脂肪细胞更显著,结果见表1,故选择胰岛β细胞为六味地黄丸微透析液的效应细胞。
表13种细胞对微透析液敏感程度的差异
Tab.1 Differences in sensitivity of 3 type cells to microdialysate (n=20)

细胞葡萄糖浓度/mmol·L-1处理前处理后tP肝细胞10.497±0.39111.508±0.6336.077<0.01脂肪细胞10.624±0.57011.447±0.3275.601<0.01胰岛β细胞10.153±0.41211.601±0.44510.678<0.01
3.2“药物剂量/D-时间/t-效应/E”模型的建立 给药间隔选择6,8和12 h 3个时间点;给药剂量为等效剂量,0.5即为0.5倍等效剂量,1倍等效剂量为0.1 mg;给药前和给药后48 h收集透析液。各处理组处理后的葡萄糖浓度均显著低于处理前(P<0.01),可以证明六味地黄丸对肾阴虚型糖尿病有较好的疗效,其中给药间隔12 h,每次1.5倍等效剂量的处理组处理后葡萄糖浓度显著低于其他组(P<0.05)。故给药间隔12 h,每次给药1.5倍等效剂量,即0.15 mg疗效最佳,此给药方案为最优方案。见表2。
3.3最优给药方案与常规给药方案对比 结果显示,最优给药方案下,葡萄糖浓度36 h即到达稳定值,且下降幅度更大(P<0.05),而常规方案需要48 h到达稳定,因此整体治疗效果优于常规给药方案。见表3。
表2给药间隔-剂量-疗效相关性
Tab.2 Dosage interval-dose-efficacy correlation (n=20)
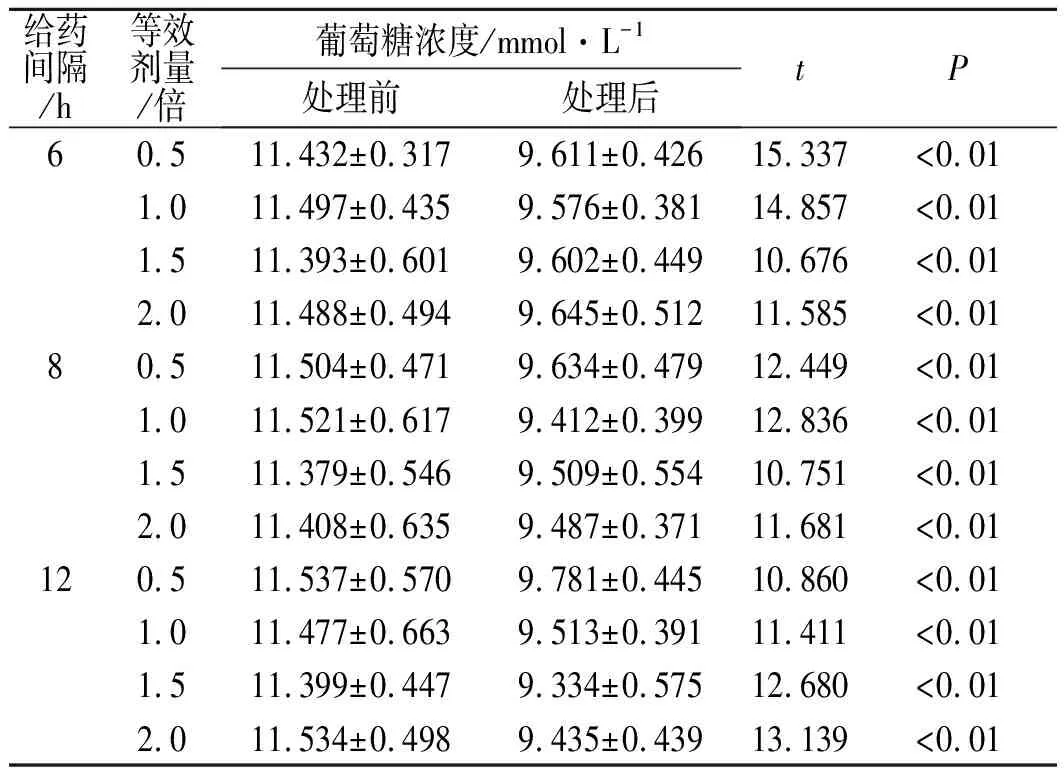
给药间隔/h等效剂量/倍葡萄糖浓度/mmol·L-1处理前处理后tP60.511.432±0.3179.611±0.42615.337<0.011.011.497±0.4359.576±0.38114.857<0.011.511.393±0.6019.602±0.44910.676<0.012.011.488±0.4949.645±0.51211.585<0.0180.511.504±0.4719.634±0.47912.449<0.011.011.521±0.6179.412±0.39912.836<0.011.511.379±0.5469.509±0.55410.751<0.012.011.408±0.6359.487±0.37111.681<0.01120.511.537±0.5709.781±0.44510.860<0.011.011.477±0.6639.513±0.39111.411<0.011.511.399±0.4479.334±0.57512.680<0.012.011.534±0.4989.435±0.43913.139<0.01
表3最优给药方案与常规给药方案对比
Tab.3 Comparison between optimal dosing regimen and conventional dosing regimen (n=20)

给药后时间/h葡萄糖浓度/mmol·L-1最优给药方案常规给药方案tP411.529±0.45211.506±0.4740.1570.876811.243±0.37911.237±0.5010.0430.9661210.862±0.49010.910±0.4350.3280.745169.947±0.53410.271±0.3342.3010.027249.554±0.3989.701±0.4621.0780.288369.391±0.4199.549±0.4181.1940.240489.342±0.5139.422±0.5570.4720.639729.397±0.4669.419±0.3480.1690.867
4 讨论
糖尿病在中医概念上属“消渴”。消渴病变分为上、中、下消3种,其中下消(肾虚精亏,即肾阴虚型)为最主要的发病方式。六味地黄丸重用熟地黄,滋阴补肾,填精益髓,为君药。山茱萸补养肝肾,并能涩精;山药补益脾阴,亦能固精,共为臣药。三药相配,滋养肝脾肾,称为“三补”,在临床上取得了较好的治疗效果[12]。微透析取样法可以做到活体、实时取样分析,在研究药物动力学、生物代谢等领域有极大的应用价值[13]。此最优方案相对于其他给药方案在同等治疗时间内可以最有效地降低葡萄糖水平,具有临床推广的意义。本实验的不足之处在于处理和检测步骤均在体外,不能完全模拟体内的复杂环境。此外,微透析法需要固定模型大鼠,因此可能导致实验大鼠的生理活性与自由活动的大鼠有差异。
六味地黄丸虽然对肾阴虚型糖尿病有较好的治疗效果,但并不适合作为唯一方药,应辅以其他药物共同治疗。

