辛伐他汀与阿司匹林共无定形复合物的制备
姚鸿萍,贺琬茸,杨广德,曾爱国*
(1.西安交通大学第一附属医院药学部,西安 710061;2.西安交通大学药学院,西安 710061)
共无定形复合物是将2种或2种以上的小分子物质通过合适的方法制备得到的无定形单相体系[1-4]。该体系可改善药物的理化性质[5-10],提高药物的药效,降低药物的毒性和不良反应[11]。
辛伐他汀是HMG-CoA还原酶抑制剂,能降低总胆固醇和血清低密度脂蛋白的质量浓度,减少基质金属蛋白酶的产生,抑制巨噬细胞的活性,改善内皮依赖性血管扩张功能[12-13]。阿司匹林是目前应用最广泛的抗血栓药物[14-15]。临床实验表明,在抗动脉粥样硬化、不稳定性心绞痛、扩张性心肌病、糖尿病和高血压导致的心血管疾病中,阿司匹林与他汀类药物联用效果优于单独使用。但这类患者往往服用药物多,易漏服或呈现药物相互作用,导致治疗效果降低、不良反应增加。笔者拟制备辛伐他汀与阿司匹林共无定形复合物,以减少患者服用药品的种数,提高患者用药顺应性,减少药物间的相互作用,提高药效,降低毒性和不良反应。
1 仪器与试药
1.1仪器 DSC822e型差示扫描量热仪(瑞士梅特勒-托利多仪器有限公司);LCMS-8040型高效液相色谱-质谱联用仪(日本岛津公司);XRD-6100型X射线衍射仪(日本Shimadzu公司);DF-101S集热式恒温加热磁力搅拌器(郑州长城科工贸易有限公司)。
1.2试药 辛伐他汀(质量分数>99.1%),阿司匹林(质量分数>98.0%),均购自西安海鑫生物科技有限公司;乙腈为色谱纯(Muskegon USA);甲醇(山东浩中化工科技有限公司)和氯仿(成都市科隆化学品有限公司)均为分析纯。水为自制三蒸水。
2 方法
2.1辛伐他汀-阿司匹林共无定形复合物的制备 分别精密称取研磨成粉的阿司匹林0.354 0,0.602 0和0.925 0 g,分别置于3个干燥的蒸发皿中,加入少量氯仿,室温下搅拌至溶解,分别超声10 min。分别加入精密称取的辛伐他汀1.646 0,1.398 0和1.075 0 g(辛伐他汀与阿司匹林的摩尔比分别为2∶1,1∶1和1∶2),室温下搅拌至溶解,再加入20 mL氯仿,超声5 min,置于通风橱下自然挥发12 h,至氯仿完全挥干。
2.2辛伐他汀-阿司匹林共无定形复合物的表征
2.2.1差示扫描量热分析法(DSC) 精密称取各样品5 mg,置于铝坩埚中,盖上盖,置于DSC分析仪中的S位置;将1个空白坩埚置于DSC分析仪的R位置;打开STAReDSC应用软件,设置参数:起始温度为25 ℃,结束温度为160 ℃,升温速率为10 ℃·min-1。当温度降至25 ℃时,取出样品,得到样品的DSC曲线。
2.2.2粉末X射线衍射法(PXRD) 采用Cu-Kα靶,波长为1.540 6 Å,管压为40 kV,管流为30 mA,步长为0.02°,扫描速度为6°·min-1,扫描范围为5°~35°。数据用Jade 6.5软件分析。比较分析辛伐他汀原料药、阿司匹林原料药和辛伐他汀-阿司匹林共无定形复合物的PXRD图谱。
2.3辛伐他汀-阿司匹林共无定形复合物样品的溶出度测定
2.3.1色谱条件 辛伐他汀:Tianhe C18(250 mm×4.6 mm,5 μm)色谱柱;流动相:乙腈-0.020 mol·L-1磷酸二氢钠(70∶30),滤过并超声后使用;流速:1.0 mL·min-1;检测波长:238 nm;进样量:20 μL;柱温:25 ℃。阿司匹林:Tianhe C18(250 mm×4.6 mm,5 μm)色谱柱;流动相:乙腈-四氢呋喃-冰醋酸-三蒸水(20∶5∶5∶70),滤过并超声后使用;流速:1.0 mL·min-1;检测波长:276 nm;每次进样量:20 μL;柱温:25 ℃。
2.3.2对照品溶液的制备 精密称取辛伐他汀对照品0.50 mg,置于50 mL 量瓶中,用甲醇溶解并稀释至刻度,摇匀,得辛伐他汀质量浓度为10 μg·mL-1的对照品溶液。精密称取阿司匹林对照品20 mg,置于50 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,得阿司匹林质量浓度为400 μg·mL-1的对照品溶液。
2.3.3线性关系考察 辛伐他汀:精密量取2.3.2项下制备的辛伐他汀对照品溶液0.5,1,2,4,6和8 mL,分别置于10 mL 量瓶中,加甲醇稀释至刻度,摇匀。按照辛伐他汀的色谱条件进行HPLC 测定,以峰面积积分值为纵坐标(y1)、质量浓度为横坐标(x1),进行线性回归,方程为:y1=47 616x1+3 644,r1=0.999 5,线性范围为0.5~8 μg·mL-1。阿司匹林:精密量取2.3.2项下制备的阿司匹林对照品溶液0.5,1,3,5,6和8 mL,分别置于10 mL量瓶中,加甲醇稀释至刻度,摇匀。按照阿司匹林的色谱条件进行HPLC测定,以峰面积积分值为纵坐标(y2)、质量浓度为横坐标(x2),进行线性回归,得回归方程为:y2=6 296x2-19 889,r2=0.999 9,线性范围为20~320 μg·mL-1。
2.3.4药物的溶出度测定 精密称取辛伐他汀原料药、阿司匹林原料药和辛伐他汀-阿司匹林共无定形复合物,采用《中国药典》2015年版四部溶出度与释放度测定法中第二法,即桨法进行测定。转速为50 r·min-1,温度为37.0±0.5 ℃,释放介质选择经脱气处理的蒸馏水,并于2,5,10,15,20,30,45,60,90,120,180和240 min分别取样1 mL(同时补加同温度等量溶出介质),以0.22 μm 微孔滤膜滤过,取续滤液20 μL 进行HPLC测定,测定结果代入标准曲线方程计算质量浓度,并换算成累积溶出率。
3 结果与讨论
3.1辛伐他汀-阿司匹林共无定形复合物的制备 辛伐他汀与阿司匹林摩尔比为1∶1和1∶2时得到淡黄色黏稠状物质,不能得到固体产物。而辛伐他汀与阿司匹林的摩尔比为2∶1时可得到白色、类白色的固体产物,将该固体产物在真空烘干箱中烘干,从蒸发皿中剥离,研磨成粉末,待用。
3.2差示扫描量热分析 见图1。由图1可知,辛伐他汀和阿司匹林分别在144.6和138.6 ℃处有单一且尖锐的吸热熔融峰,摩尔比为2∶1的辛伐他汀-阿司匹林共无定形复合物(图1C中的a)在40.4 ℃有一玻璃化转变温度特征峰,初步判断其可能形成了共无定形体系药物。而其他2个摩尔比的样品溶液并未出现类似的特征峰,初步判断其可能未形成共无定形体系的药物,需要结合其他表征测定方法进一步确定。

图1DSC曲线
A.辛伐他汀;B.阿司匹林;C.辛伐他汀-阿司匹林共无定形复合物; a:辛伐他汀∶阿司匹林=2∶1;b:辛伐他汀∶阿司匹林=1∶2;c:辛伐他汀∶阿司匹林=1∶1。
Fig.1 DSC curves
A.simvastatin;B.aspirin;C.simvastatin-aspirin co-amorphous complex;a.simvastatin∶aspirin=2∶1;b:simvastatin∶aspirin=1∶2; c:simvastatin∶aspirin=1∶1.
3.3粉末X射线衍射 分别将辛伐他汀原料药、阿司匹林原料药和摩尔比为1∶1,1∶2和2∶1的3个辛伐他汀-阿司匹林的样品进行PXRD测定,结果见图2。由图2可知,原料药辛伐他汀具有高度的结晶形态,原料药阿司匹林的相对结晶程度较小,摩尔比为1∶1和1∶2的辛伐他汀-阿司匹林样品溶液PXRD曲线有较强的结晶态峰,呈叠加状,结合DSC曲线判定辛伐他汀与阿司匹林摩尔比为1∶1和1∶2时未形成共无定形体系。摩尔为2∶1的辛伐他汀-阿司匹林样品溶液的PXRD曲线中晶态峰消失,此结果与DSC曲线结果一致,因此判定辛伐他汀-阿司匹林共无定形复合物的摩尔比为2∶1。
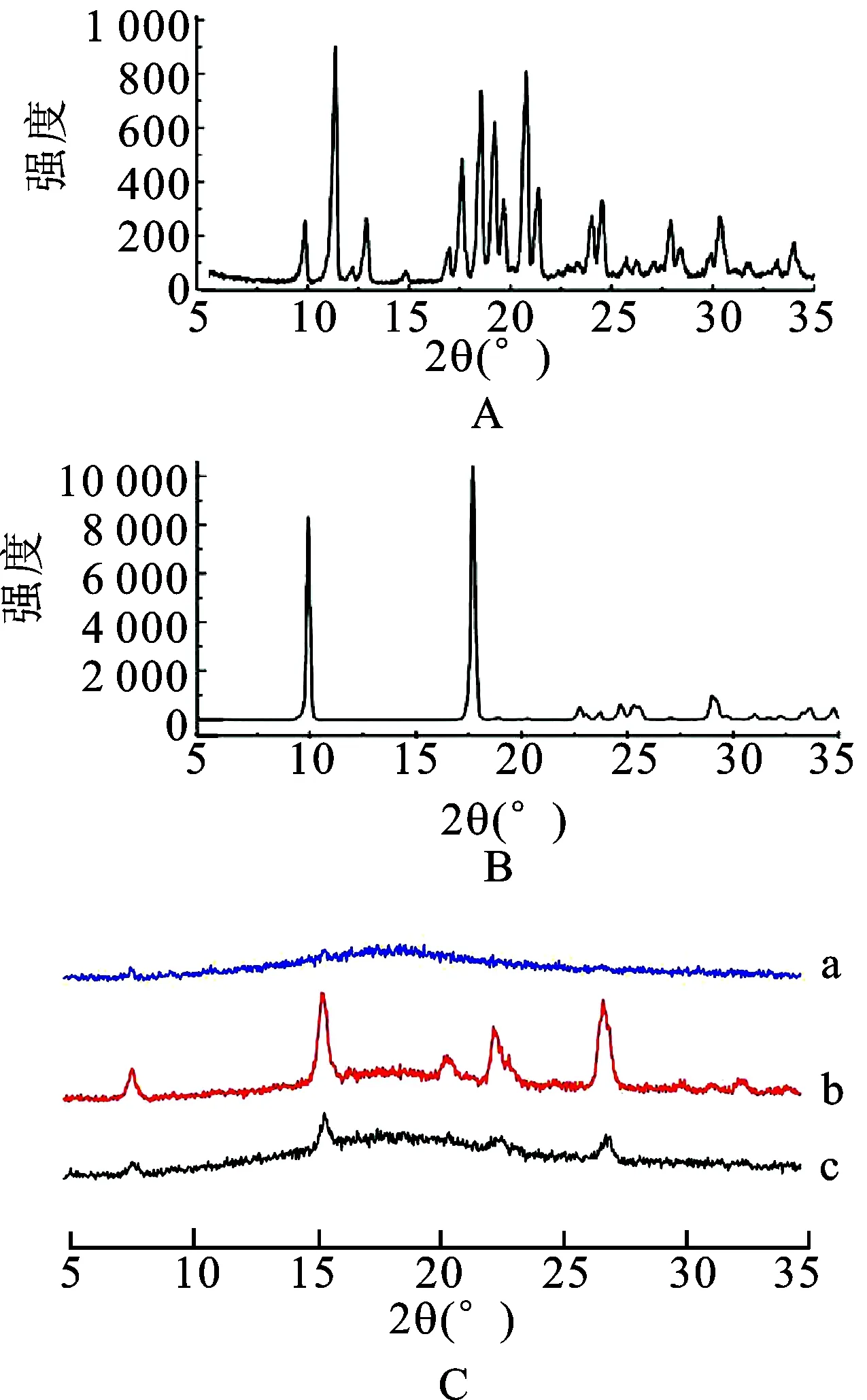
图2PXRD曲线
A.辛伐他汀;B.阿司匹林;C.辛伐他汀-阿司匹林共无定形复合物;a:辛伐他汀∶阿司匹林=2∶1;b:辛伐他汀∶阿司匹林=1∶2;c:辛伐他汀∶阿司匹林=1∶1。
Fig.2 PXRD curves
A.simvastatin;B.aspirin;C.simvastatin-aspirin co-amorphous complex;a.simvastatin∶aspirin=2∶1;b:simvastatin∶aspirin=1∶2; c:simvastatin∶aspirin=1∶1.
3.4辛伐他汀-阿司匹林共无定形复合物样品的溶出度测定 鉴于辛伐他汀与阿司匹林摩尔比为1∶1和1∶2时,DSC和PXRD表明其未形成共无定形体系,故只测定了摩尔比为2∶1的辛伐他汀-阿司匹林共无定形复合物的溶出度。辛伐他汀溶出曲线见图3。由图3可知,辛伐他汀-阿司匹林共无定形复合物(2∶1)样品中辛伐他汀在溶出介质中能较快溶解;辛伐他汀原料药的溶出曲线比辛伐他汀-阿司匹林共无定形复合物中辛伐他汀的溶出曲线低,溶出度小。辛伐他汀原料药在25 min时溶出达到第1个峰值,质量浓度为2.25 μg·mL-1,辛伐他汀-阿司匹林共无定形复合物中辛伐他汀的溶出达到第1个峰值的时间稍晚于其原料药,但溶出质量浓度为4.75 μg·mL-1,是原料药的2.5倍。在第7个时间点时,辛伐他汀-阿司匹林共无定形复合物中辛伐他汀的溶出质量浓度可达到原料药的3倍。以上均证明将辛伐他汀制备为辛伐他汀-阿司匹林共无定形复合物(2∶1)有利于提高辛伐他汀的溶出速率和溶出度。
阿司匹林溶出曲线见图4。由图4可知,阿司匹林原料药的溶出稳定,而辛伐他汀-阿司匹林共无定形复合物(2∶1)中阿司匹林的溶出曲线低于阿司匹林原料药的溶出曲线,原因可能是与辛伐他汀形成共无定形后,存在一些作用力,限制了阿司匹林进一步的溶出,具体原因还需进一步研究。
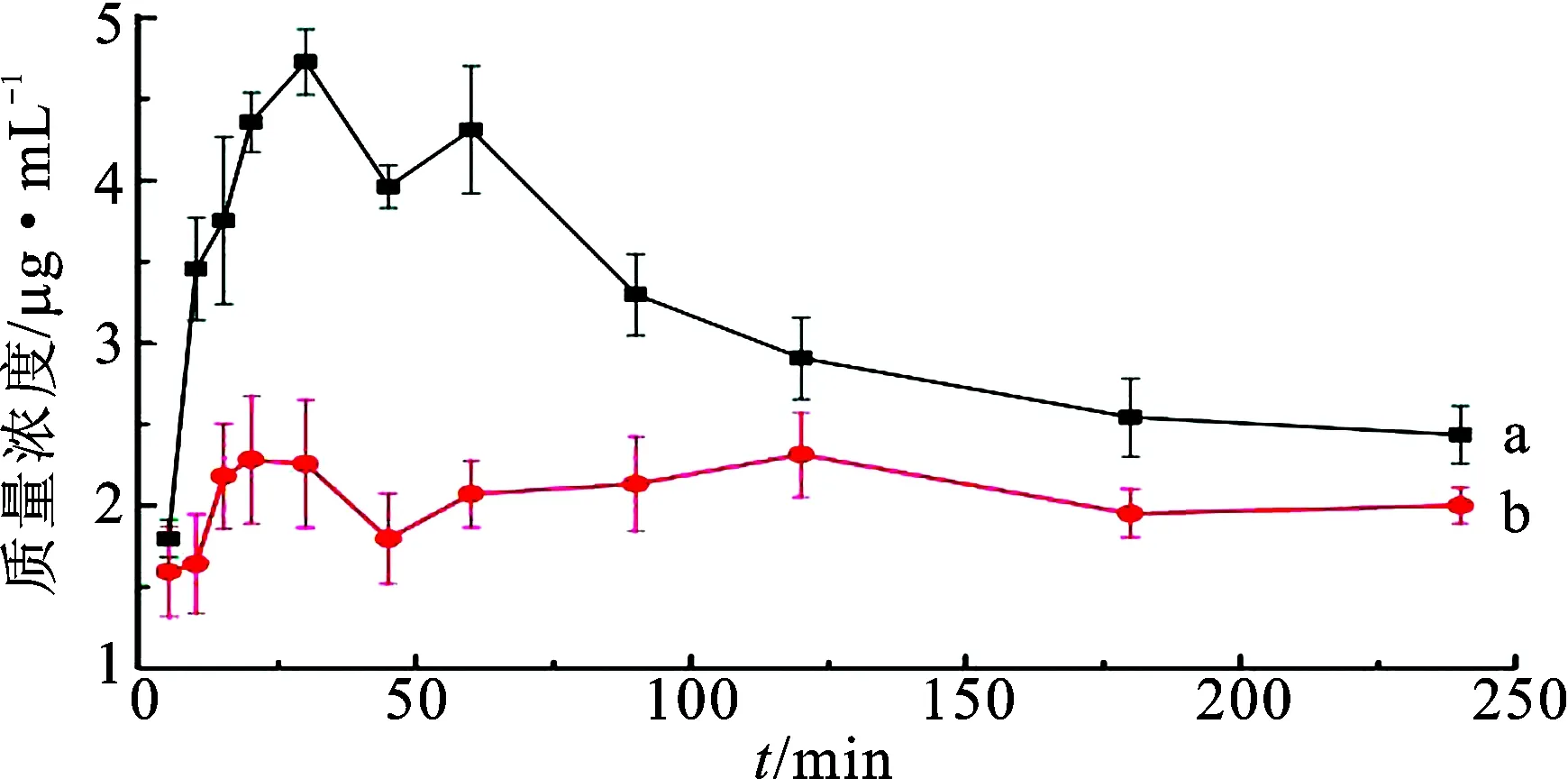
图3辛伐他汀(b)与辛伐他汀-阿司匹林共无定形复合物(2∶1)(a)中辛伐他汀的溶出曲线
Fig.3 Dissolution curves of simvastatin in co-amorphous complex (simvastatin∶aspirin=2∶1)(a) and simvastatin(b)
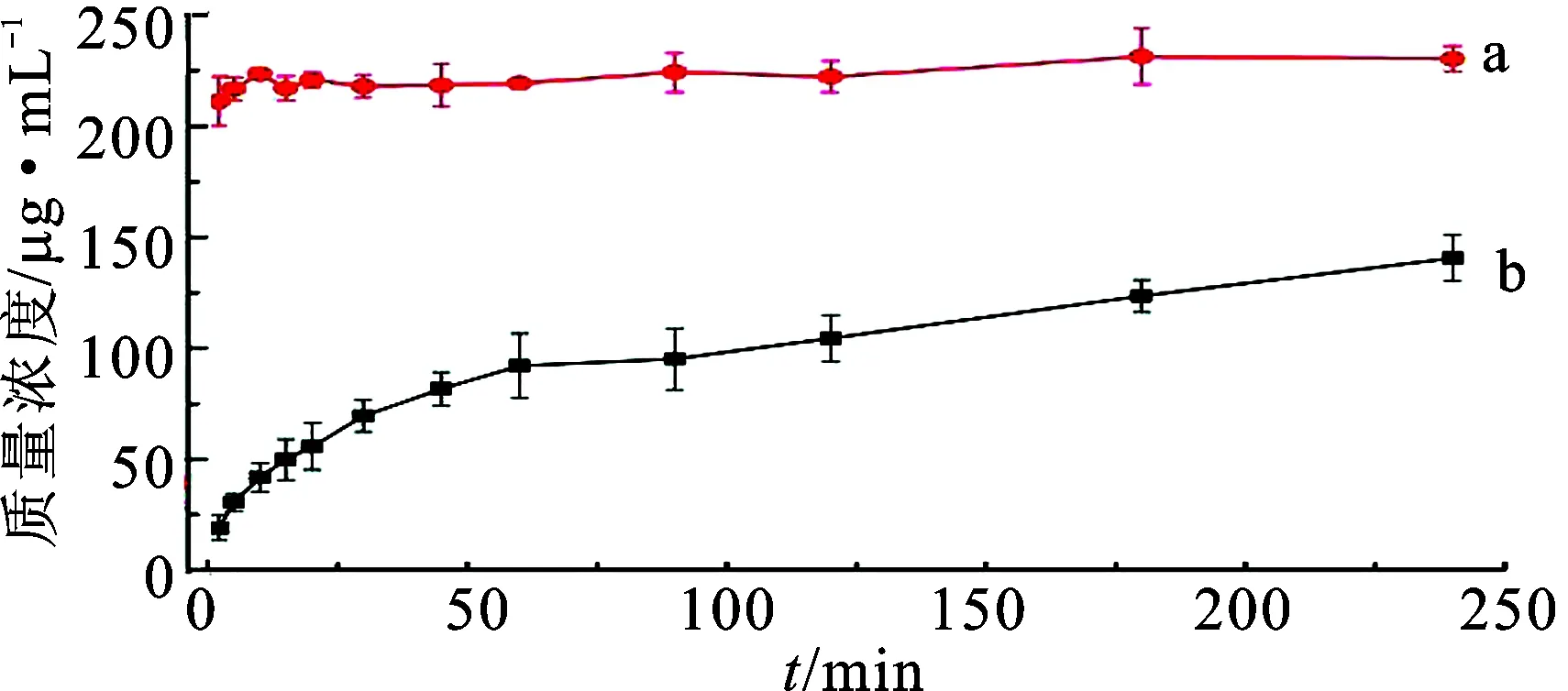
图4阿司匹林(a)与辛伐他汀-阿司匹林共无定形复合物(2∶1)(b)中阿司匹林的溶出曲线
Fig.4 Dissolution curves of aspirin (a) and aspirin in co-amorphous complex (simvastatin∶aspirin=2∶1)(b)
4 小结
共无定形药物是在晶型药物、共晶药物、无定形药物的基础上发现的新的药物固体形态[10,14]。它克服了无定形药物在制备、储存和给药等过程中易发生转晶的稳定性问题[16-20],且与无定形药物一样,都属于单相体系。药物与药物形成的共无定形药物可通过研磨法、低温研磨法、溶剂挥发法和熔融-骤冷法等方法制备[21],本课题以三氯甲烷为溶剂,辛伐他汀和阿司匹林作为原料药,通过溶剂挥发法制备摩尔比为1∶1,1∶2和2∶1的辛伐他汀-阿司匹林样品。经过DSC和PXRD 2种表征法确定所制比例的药物中摩尔比为2∶1的辛伐他汀-阿司匹林样品可通过此方法成功制得辛伐他汀-阿司匹林共无定形复合物。结果表明,辛伐他汀-阿司匹林共无定形复合物(2∶1)中辛伐他汀的溶出度较原料药有了很大的提高。但阿司匹林的溶出却降低,其原因需要进一步研究。

