β相纳米氧化铁催化材料制备实验研究
徐啸 刘杰
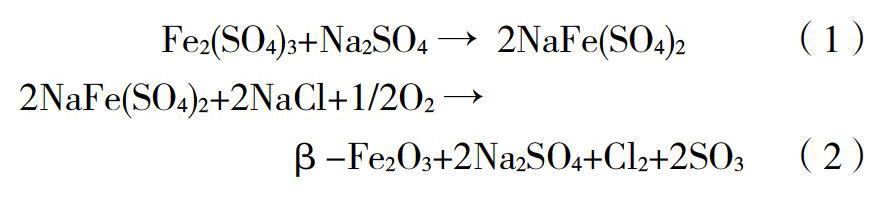


摘 要: 作为Fenton反应的重要催化载体,氧化铁一直是环境催化领域关注的热点。氧化铁有多个晶型,其中β相氧化铁在催化领域具有良好的应用前景。但作为亚稳态物质其制备易受实验条件影响,限制了其研究及应用。针对β-Fe2O3制备过程中灼烧温度、升温速率、灼烧时间、空气湿度等影响因素进行了实验研究,确定了其最佳制备条件,能够为后续相关研究提供参考。
关 键 词:氧化铁;β相;α相;灼烧实验
中图分类号:TQ 426.6 文献标识码: A 文章编号: 1671-0460(2019)12-2723-04
Abstract: As the main catalytic carrier in Fenton process, Fe2O3 is widely studied in the field of environmental remediation. Fe2O3 has multiple crystal forms; β-Fe2O3 among them has a promising prospect in the field of catalysis. However, as a metastable material, the preparation of β-Fe2O3 is easy affected by many experimental conditions, which restricts its research and application. In this paper, the effect of calcination temperature, calcination time, air moisture on the preparation of β-Fe2O3 was investigated, and the optimum preparation conditions were determined, which could provide some reference for further related researches.
Key words: Fe2O3; β pahse; α pahse; Calcination experiment
氧化铁是高级氧化技术常用催化剂之一。氧化铁的晶型结构通常有四种,分别为α-Fe2O3、β-Fe2O3、γ-Fe2O3和ε-Fe2O3。由于较好的稳定性与顺磁特性,α-Fe2O3(赤铁矿)和γ-Fe2O3(磁赤铁矿)在环境催化领域己有大量的研究及应用[1-3],而β-Fe2O3和ε-Fe2O3两种晶型属于比较少见的晶型,其研究和应用也比较少。相较于α型和γ型,β型无磁性,从而材料的团聚效应不明显,能够均匀的分散在水中,带来处理效果的提升。
目前β-Fe2O3材料的制备主要采用灼烧法。采取硫酸铁和氯化钠直接灼烧[4-7],或者硫酸铁和硫酸钠首先反应生成硫酸铁钠,再与氯化钠混合灼烧的方法[8,9]。具体反应如下:
部分研究者认为β-Fe2O3是制备α-Fe2O3的中间产物,其亚稳态特性导致难以控制实验条件制备纯相β-Fe2O3[8]。本研究针对β-Fe2O3制备过程中灼烧温度、升温速率、灼烧时间、空气湿度等影响因素进行研究,以确定制备纯相β-Fe2O3的最佳实验条件。
1 实验部分
1.1 实验用药剂
硫酸铁(Fe2(SO4)3,分析纯),上海麦克林公司;硫酸钠(Na2SO4,分析纯)、氯化钠(NaCl,优级纯),上海国药公司。
1.2 实验用仪器
电子天平(ME140E,瑞士梅特勒公司);扫描电镜(Quanta FEG250,美国FEI公司);X射线衍射仪(6100,日本岛津公司);管式炉(ZKGL1200,天津天有利公司),配备石英舟。
1.3 材料制备及实验方法
1.3.1 材料制备
硫酸铁钠:按照1∶1的摩尔比,称取适量硫酸铁和硫酸钠,溶解于去离子水中,在80 ℃水浴条件下不停搅拌,待溶液中水蒸干成糊状,放入烘箱中烘干,48 h后取出研磨成粉状。
β-Fe2O3:按照不同摩尔比,称取适量硫酸铁钠和氯化钠,混合后倒进石英舟中放入管式炉内灼烧,调节管式炉灼烧温度、升温速率、灼烧时间,待灼烧完毕降到室温后,将样品用去离子水和乙醇清洗数遍,放入烘箱烘干。
1.3.2 实验方法
分别以灼烧温度、升温速率、氯化钠投加比、灼烧时间、空气作为变量,按照材料制备方法进行实验。
2 结果与讨论
2.1 灼烧温度
由于硫酸铁钠与氯化钠在350 ℃以下不发生反应[8],而温度超过600 ℃,将完全生成α-Fe2O3[10]。因此,为考察灼烧温度对材料制备的影响,在400~600 ℃范围内进行灼烧。硫酸铁钠和氯化钠的摩尔比为1∶4,升温速率为10 ℃/min,设定温度下灼烧时间为1 h。
2.1.1 XRD谱图
所得材料XRD谱图如图1所示。
当2θ在23.2°、33°、38.3°、45.2°、55.2°、65.9°处出现的衍射峰,属于β-Fe2O3的(211)、(222)、(400)、(332)、(440)晶面[11];当2θ在24.2°、35.5°、49.5°、54.1°处出现的衍射峰,属于α-Fe2O3的(012)、(110)、(024)、(018)晶面[12]。由图1可知,当温度低于450℃时,β相氧化铁生成量少,成晶效果差,这与Danno等的研究一致[9];当温度逐渐从450 ℃升温到500 ℃时,可生成β-Fe2O3,且无其他杂峰,结晶度高;但当温度继续升高到550 ℃以上时,出现了α-Fe2O3的特征峰,说明随着温度的升高,氧化铁出现了相的转化,由β相转化为α相,证明了β相的亚稳态特征。因此,制备β-Fe2O3的灼燒温度为450°~500°,且500 ℃左右成晶效果较好。
2.1.2 SEM图像
图2为不同温度条件下生成材料的扫描电镜图像。
从图像可知,在400 ℃时,β-Fe2O3即开始出现,固体表面逐渐出现规则几何结构;500℃时,形成立方体晶型的β-Fe2O3,且尺寸较均匀,约1.2μm;温度逐渐升高后,β-Fe2O3的晶型结构被高温破坏,逐渐熔融空化,形成颗粒状的α-Fe2O3,进一步证实了β-Fe2O3的亚稳态结构。
2.2 升温速率
升温速度影响成晶效果。为考察升温速率的影响,设置了3种升温速率,如图3所示。
可以看出,升温速率为5~10 ℃/min时可以生成β-Fe2O3,且10 ℃/min时形成的晶型最好。而随着升温速率的不断加快,硫酸铁钠与氯化钠反应产物中出现了α-Fe2O3。
2.3 氯化钠投加量
2.3.1 未投加氯化钠条件下的反应产物
为揭示氯化钠在氧化铁生成中的作用,单独对硫酸铁、硫酸铁与硫酸钠混合物、硫酸铁钠在500 ℃条件下灼烧1 h,得到材料XRD谱图如图4所示。
从图4中可以看出,硫酸铁在灼烧后仍与其XRD标准图谱(JCPDS:33-0679)相同,不发生变化,这与其熔点较高(超过480 ℃)有关;硫酸铁和硫酸钠混合物在燃烧后,生成硫酸铁钠,而单独灼烧硫酸铁钠不发生变化,说明氯化钠作为反应前体物,在β-Fe2O3的晶型制备过程中起到了非常重要的作用。
硫酸铁钠的扫描电镜图像如图5所示。
图5中可以看出,与β-Fe2O3的立方体结构截然不同,硫酸铁钠为片状结构。硫酸铁与硫酸钠混合后灼烧生成的硫酸铁钠粒径不均匀,这可能是由于人工研磨混合不均匀导致的。而先水浴制备硫酸铁钠再灼烧的样品则粒径分布比较均匀,也比较有规则。
2.3.2 不同氯化钠投加比例反应产物
进一步考察氯化钠在β-Fe2O3形成过程中的作用,按照不同摩尔比投加硫酸铁钠与氯化钠进行灼烧制备材料XRD谱图如图6所示。
由图中可以看出,当氯化钠含量较低时,生成β-Fe2O3的量较少,且大部分转化为α相;随着氯化钠含量的升高,β-Fe2O3的纯度不断增高,当硫酸铁钠与氯化钠摩尔比为1∶4时,制备的β-Fe2O3纯度最高。
2.4 灼烧时间
灼烧时间不同,形成的材料产物也有较大的区别。如图7所示。
当灼烧时间为0.5 h时,生成的β-Fe2O3较少,这主要是由于之前所述的硫酸铁钠与氯化钠的反应结晶需要一定的时间;当反应时间超过1 h时,β-Fe2O3开始向α-Fe2O3转化。因此,控制灼烧的时间能够有效降低α-Fe2O3晶型的生成,提升β-Fe2O3的纯度。
2.5 空气湿度
为考察空气湿度对反映结果的影响,采用硫酸铁钠和氯化钠分别在空气中和真空手套箱中研磨混合的方法,并对结果进行了分析,如图8所示。
由图可知,研磨方式对最终成晶结果有一定的影响,在真空手套箱中研磨混合得到的β-Fe2O3晶形结构好,纯度较高。这主要是由于空气中水蒸气造成的。硫酸铁钠在空气中容易吸潮,当湿度降低后,硫酸铁钠能够更好的与氯化钠混合均匀,从而使整个反应体系更加趋于稳定。
3 结论
本研究针对β-Fe2O3在制备过程中的处于亚稳态、易转化的问题,分别考察了灼烧温度、升温速率、氯化钠投加比、灼烧时间、空气湿度等不同条件对材料制备的影响,确认β-Fe2O3最佳制备条件为:硫酸铁钠与氯化钠摩爾比1∶4,真空手套箱研磨混合后,按照10 ℃/min的升温速率在500 ℃下灼烧1 h。
参考文献:
[1]CONG Y, GE Y, ZHANG T, et al. Fabrication of Z-Scheme Fe2O3–MoS2–Cu2O Ternary Nanofilm with Significantly Enhanced Photoelectro -catalytic Performance[J]. Industrial & Engineering Chemistry Research, American Chemical Society, 2018, 57(3): 881–890.
[2]FU Y, LI Y, HU J, et al.Photocatalytic degradation of acetochlor by α-Fe2O3 nanoparticles with different morphologies in aqueous solution system[J]. Optik, Elsevier, 2019, 178(October 2018): 36–44.
[3]刘晓成,魏建宏,周耀渝,张嘉超,罗琳.电芬顿与光芬顿环境应用研究进展[J].当代化工,2018,47(01):128-131.
[4]ZBORIL R, MASHLAN M, KRAUSOVA D, et al. Cubic β-Fe2O3 as the product of the thermal decomposition of Fe2(SO4)3[J]. Hyperfine Interactions, 1999, 120121: 497–501.
[5]MACHALA L, TU?EK J, ZBO?IL R. Polymorphous transformations of nanometric iron(III) oxide: A review[J]. Chemistry of Materials, 2011, 23(14): 3255–3272.
[6]ZBORIL R, MASHLAN M, MACHALA L, et al.Iron(III) Oxides Formed During Thermal Conversion of Rhombohedral Iron(III) Sulfate[M]. 2003.
[7]ZBORIL R, MASHLAN M, PETRIDIS D. Iron(III) oxides from thermal processes-synthesis, structural and magnetic properties, M?ssbauer spectroscopy characterization, and applications[J]. Chemistry of Materials, 2002, 14(3): 969–982.
[8]DANNO T, ASAOKA H, NAKANISHI M, et al. Formation mechanism of nano-crystalline β-Fe2O3 particles with bixbyite structure and their magnetic properties[C].Journal of Physics: Conference Series. 2010, 200(SECTION 8).
[9]DANNO T, NAKATSUKA D, KUSANO Y, et al.Crystal Structure of β-Fe2O3 and Topotactic Phase Transformation to α-Fe2O3[J]. Crystal Growth & Design, 2013, 13(2): 770–774.
[10]胡建設, 孙楠, 李松,等. 具有不同形貌的α-Fe2O3超细粒子可控制备[J]. 东北大学学报(自然科学版), 2015(9): 1260–1264.
[11]ZHANG Y, ZHANG N, WANG T, et al.Heterogeneous degradation of organic contaminants in the photo-Fenton reaction employing pure cubic β-Fe2O3[J]. Applied Catalysis B: Environmental, 2019, 245: 410–419.
[12]SUN S, SUN M, KONG Y,等. MoS2 and graphene as dual, cocatalysts for enhanced visible light photocatalytic activity of Fe2O3[J]. Journal of Sol-Gel Science and Technology, Springer US, 2016, 80(3): 719–727.

