Smad7修饰的骨髓间充质干细胞通过肝星状细胞Smads信号与MMP-1/TIMP-1平衡的抗肝纤维化机制
苏冬娜, 吴诗品
(暨南大学 第二临床医学院∥深圳市人民医院 感染内科, 广东 深圳 518020)
肝硬化是各种慢性肝病发展的晚期阶段,具有发病率高、治疗效果差及死亡率高的特点,我国是肝硬化高发病率国家,研究肝硬化的治疗方法十分迫切.肝纤维化(hepatic fibrosis, HF)是慢性肝病进展至肝硬化的重要阶段,其主要特点是细胞外基质(extracellular matrix, ECM)的沉积[1-2].降解是治疗肝纤维化的主要思路.肝纤维化是可逆的,但是肝硬化是不可逆的,加上肝硬化的治疗效果很差,所以对逆转纤维化潜在机制的研究具有极其重要的意义.
TGF-β基因家族在细胞的增殖、分化和免疫等方面起重要作用,能够促进肝星状细胞转化为成纤维细胞,在损伤部位产生大量的细胞外基质[3].TGF-β/Smad途径是TGF-β发挥作用的主要途径,在肝星状细胞向肝纤维化的转化过程中起关键作用[4].ECM的降解主要依靠蛋白酶水解,基质金属蛋白酶MMP家族就是其中比较重要的蛋白酶.近年来研究发现肝星状细胞能够分泌MMP-1、基质金属蛋白酶的抑制物TIMP-1[5-6],所以MMP-1/TIMP-1系统的平衡对细胞外基质ECM的降解影响较大,但是相关研究较少.在前期的研究中,发现Smad7修饰的骨髓间充质干细胞(BMSCs)能够在体内减弱肝纤维化的发生[7],在体外影响肝星状细胞中TGF-β信号转导,通过促进星状细胞的凋亡对抗肝纤维化[8].本研究旨在探究Smad7修饰的BMSCs对肝星状细胞中Smads信号与MMP-1/TIMP-1系统的影响,以揭示Smad7修饰的BMSCs对细胞外基质ECM的降解逆转肝纤维化的潜在机制.
1 材料与方法
1.1 主要试剂
Smad7基因修饰的骨髓间充质干细胞由本实验室构建保存;肝星状细胞系HSC-T6购自中国科学院上海生物化学与细胞生物学研究所;DMEM培养基、胎牛血清(FBS)及胰蛋白酶购自美国Thermo公司;质粒提取试剂盒、Trizol试剂均购自美国Thermo公司;荧光定量试剂盒One Step SYBR® PrimeScriptTMRT-PCR Kit购自大连宝生物有限公司;一抗Smad7、Smad3、p-Smad3、MMP-1、TIMP-1、Col1及GAPDH及HRP标记的二抗均购自美国Abcam公司;四甲基偶氮唑盐(MTT)购自碧云天生物科技公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司.
1.2 实验方法
1.2.1 HSC-T6细胞培养和传代
从液氮中取出HSC-T6细胞株迅速复苏后转入培养瓶中(1×105/mL),用质量分数为10% 胎牛血清、1% 青霉素和链霉素混合液的DMEM 培养基于体积分数为5% CO2、37 ℃的恒温培养箱培养.当细胞生长接近于90%,用质量分数为0.25%的胰蛋白酶消化细胞,进行传代.
1.2.2 Smad7-BMSCs处理肝星状细胞
取生长状态良好的肝星状细胞HSC-T6接种到6孔板,每孔细胞密度为1×106.试验分成A组和B组,待细胞融合至70%时,每组分别加入Smad7-BMSCs(1×104/mL)和同体积的PBS进行培养[9].
1.2.3 ELISA检测HSC-T6合成的Ⅰ型胶原Col1及透明质酸酶HA的表达
细胞处理72 h后,用ELISA检测试剂盒检测培养液中Ⅰ型胶原Col1及透明质酸酶HA的表达.
1.2.4 MTT检测肝星状细胞HSC-T6增殖
将HSC-T6细胞按照毎孔1×106的密度接种到24孔板中,待孔内的细胞密度达到80%左右.分别加入Smad7-BMSCs(1×104/mL)和同体积的PBS进行培养.培养72 h后,每孔分别加入质量浓度5 μg/μL的MTT溶液,置于细胞培养箱内继续培养4 h后加入DMSO终止,采用酶标仪在490 nm的波长下测定各孔内吸光度值,以空白为对照判断各孔内细胞的增殖情况.
1.2.5 总RNA的提取及cDNA合成
细胞处理72 h后,向毎孔细胞中加入1 mL Trizol试剂进行裂解,将裂解液转移至干净的EP管中,加入200 μL氯仿用力震荡15 s后室温放置10 min,4 ℃ 12 000 r/min离心15 min. 吸取上层水相至新EP管,加入500 μL异丙醇,室温放置10 min,4 ℃ 12 000 r/min离心15 min,弃上清,可见白色RNA沉淀.用预冷的体积分数为75%乙醇洗涤,4 ℃ 12 000 r/min离心10 min,弃上清液;重复2次.自然晾干,DEPC水溶解RNA.cDNA合成使用TAKARA的One Step PrimeScript Cdna Synthesis Kit按照说明书进行逆转录PCR.
1.2.6 荧光定量PCR实验
RT-qPCR使用的One Step SYBR® PrimeScriptTMRT-PCR Kit(taraka)按照说明书在ABI 7300 Real-Time PCR System 仪器上进行(引物列表见表1),反应的程序如下:95 ℃ 30 s;40个循环的95 ℃ 5 s及 60 ℃ 30 s.样品中目标基因的表达使用GAPDH作为内参,定量结果采用2-ΔΔCt表示.
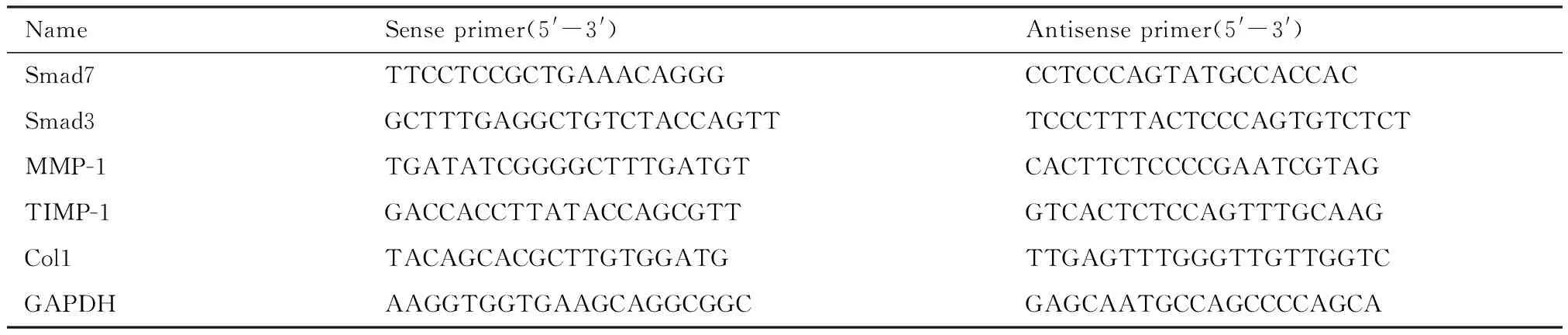
表1 引物序列表Table 1 Primer sequence
1.2.7 Western blot检测
待转细胞处理72 h后,向毎孔细胞中加入200 μL蛋白裂解液(已添加蛋白酶抑制剂),冰上裂解30 min后,将裂解液转入EP管中12 000 r/min离心10 min,取上清用BCA法测定蛋白浓度.每组取等量的蛋白样品,加入SDS上样缓冲液混匀后于煮沸10 min使蛋白变性.然后进行常规SDS-PAGE凝胶电泳,采用湿转法将凝胶上的蛋白转移至PVDF膜.经过质量分数为5%的脱脂奶粉室温封闭2 h,4 ℃过夜孵育一抗(稀释体积比为1∶1 000).第2天室温孵育二抗1 h, TBST洗涤3次后用ECL化学发光显色液进行显色,并采用凝胶成像设备进行结果观察并拍照.最终结果表示为目标条带与内参GAPDH的光密度比值.
1.2.8 统计学分析

2 结果
2.1 Smad7修饰的BMSCs降低肝星状细胞HSC-T6的Ⅰ型胶原Col1与透明质酸酶HA的表达
通过ELISA法检测结果显示,与对照组相比Smad7修饰的BMSCs处理组细胞培养液中Col1与HA的表达量显著降低(P<0.05,图1).
2.2 Smad7修饰的BMSCs抑制肝星状细胞HSC-T6的增殖
为了探究通过Smad7修饰的BMSCs抑制肝星状细胞HSC-T6增殖的影响,通过MTT法检测Smad7修饰的BMSCs与HSC-T6细胞共培养24、48、72 h后细胞的增殖情况.结果显示,与对照组相比Smad7修饰的BMSCs处理组显著抑制细胞增殖(P<0.05,图2).
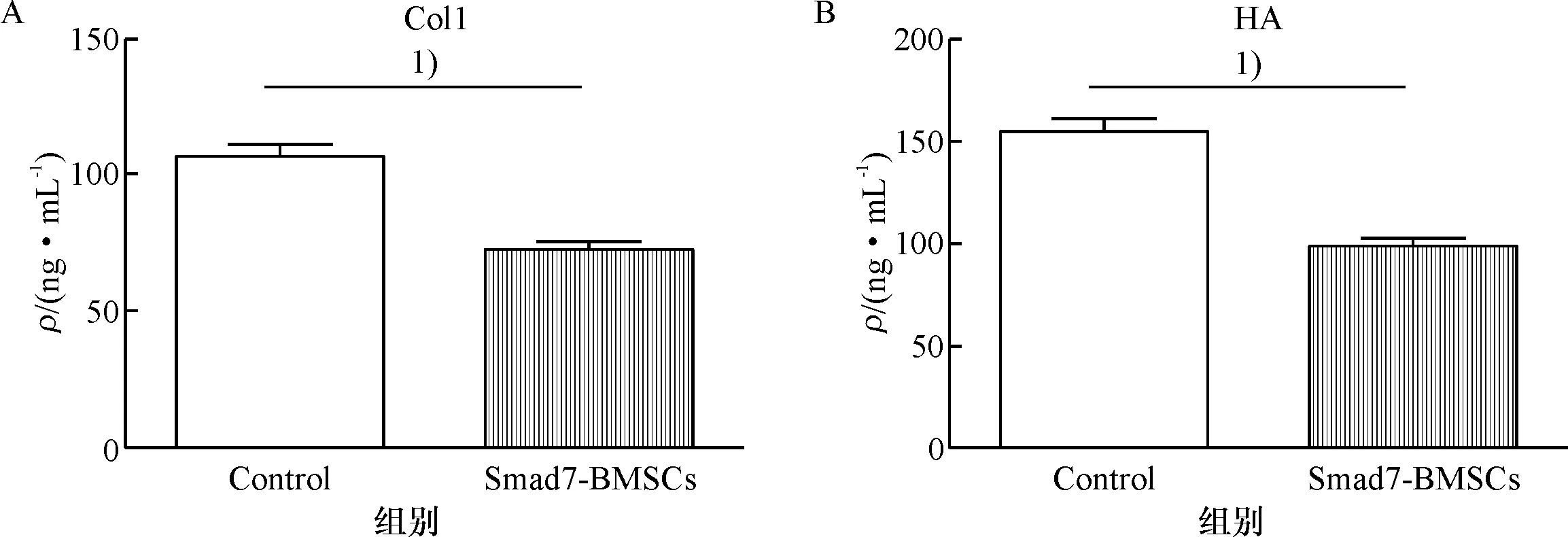
2.3 Smad7修饰的BMSCs对肝星状细胞HSC-T6中Smad2/3表达的影响
为了探究通过Smad7修饰的BMSCs对肝星状细胞HSC-T6中Smad3表达的影响,Smad7修饰的BMSCs与HSC-T6细胞共培养72 h后,提取细胞中总RNA和总蛋白.通过定量PCR检测细胞中Smad7、Smad3的表达;Western blot检测细胞中Smad7、Smad3、p-Smad3蛋白的表达水平.结果显示,与对照组相比Smad7修饰的BMSCs处理组细胞中Smad7表达显著增加(P<0.05),而Smad3的mRNA与蛋白表达没有显著性变化(P>0.05),但是p-Smad3蛋白的表达量显著降低(P<0.05,图3).
1)P<0.05; A:细胞培养液中Col1含量;B:细胞培养液中HA的含量.

1)P<0.01
Fig.2 The effect of smad7 modified BMSCs on the proliferation of HSC-T6 cells
1)P<0.01, 2)P>0.05.
2.4 Smad7修饰的BMSCs对肝星状细胞HSC-T6中MMP-1/TIMP-1系统的影响
为了探究通过Smad7修饰的BMSCs对肝星状细胞HSC-T6中相关因子表达的影响, Smad7修饰的BMSCs与HSC-T6细胞共培养72 h后,提取细胞中总RNA和总蛋白.通过定量PCR检测细胞中Smad7、MMP-1、TIMP-1、 Col1的表达;Western blot检测细胞中MMP-1、TIMP-1、Col1蛋白的表达水平.结果显示,对于对照组相比Smad7修饰的BMSCs处理组Smad7、MMP-1表达显著增加(P<0.01),而TIMP-1、 Col1的表达则显著降低(P<0.01,图4).

1)P<0.01
3 讨论
肝纤维化是肝脏遭受损伤以后的一种自我恢复反应,细胞外基质ECM的过度合成和沉积是肝纤维化的主要特征之一.研究发现肝星状细胞是肝脏分泌细胞外基质ECM 的主要场所,而肝星状细胞的激活是肝纤维化形成的重要环节[10].当机体处于正常状态时,肝星状细胞处于静息状态,仅合成少量胶原;当肝脏发生病变的情况下,肝星状细胞被激活,分泌大量的Col1使ECM降解受到抑制从而引发肝纤维化.肝细胞中Col1主要在肝星状细胞中表达,因此抑制星状细胞中Col1的表达,对肝纤维化的治疗具有重要意义.
骨髓间充质干细胞BMSCs是一种多能干细胞,能够分化为多种器官组织参与机体的多项功能调节[11].近年来,研究显示BMSCs能够一定程度的保护肝功能衰竭、改善肝衰竭大鼠的免疫功能和肝组织炎性反应坏死状态,促进肝功能的恢复[12].Smads是TGF-β信号通路中的关键因子,Smad7与Smad3参与TGF-β信号转导途径,并且Smad7是改信号通路中的重要负向调节因子,Smad7表达上调会阻止Smad2/3磷酸化,从而抑制TGF-β/Smad信号转导途径[13].研究显示TGF-β/Smad信号能够促进肝星状细胞的增殖与细胞外基质ECM的沉积与合成[14].本研究通过ELISA检测细胞培养液发现Smad7修饰的BMSCs能够抑制肝星状细胞增殖,降低肝星状细胞分泌的一型胶原和透明脂酸;另外,Smad7修饰的BMSCs能够抑制细胞中Smad3蛋白的磷酸化.说明Smad7-BMSCs可能通过下调Smad3蛋白的磷酸化从而抑制TGF-β/Smad信号转导途径,降低肝星状细胞分泌的Col1和透明脂酸HA进而减少细胞外基质ECM的积累.
基质金属蛋白酶MMP及其抑制剂TIMP在细胞外基质ECM的降解过程中起着重要的作用.MMP与TIMP的活性呈负相关,与肝纤维化的发生发展密切相关.研究发现,TIMP能够抑制MMP,而MMP能够降解细胞外基质ECM.所以MMP/TIMP系统的平衡对细胞外基质的沉积与降解甚至对肝纤维化的进程起着极其重要的作用[15].本研究发现Smad7修饰的BMSCs能够促进细胞中MMP-1的表达,而抑制TIMP-1与Col1的表达.说明Smad7-BMSCs可能通过影响肝星状细胞中MMP-1/TIMP-1系统的平衡来影响细胞外基质的沉积.有研究发现TGF-β信号能够上调TIMP的表达从而抑制细胞外基质ECM的降解.所以,Smad7修饰的BMSCs可能通过TGF-β中Smads蛋白的磷酸化影响肝星状细胞中MMP/TIMP系统的平衡进而影响肝纤维化的进程.
综上所述,本研究证实了Smad7修饰的BMSCs能够降低肝星状细胞中Smad3蛋白的磷酸化,增加MMP/TIMP的比值、抑制细胞分泌胶原蛋白与透明质酸促进ECM的降解从而缓解肝纤维化.揭示Smad7修饰的BMSCs抗肝纤维化的潜在机制,为肝纤维化的治疗提供理论基础.

