低温胁迫下油菜素内酯对黄瓜种子萌发及幼苗生长的影响
张爱敏 周国顺 付丽军 李娟 陆晴 任瑞星
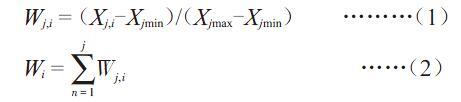

摘 要:以耐冷型黄瓜品种‘RT-5和冷敏型黄瓜品种‘W-108种子为试验材料,采用2,4-表油菜素内酯(EBR)浸泡法和添加法处理,研究了15 ℃低温胁迫下不同质量浓度(0.001、0.010、0.100、1.000 mg·L-1)EBR对黄瓜种子萌发及幼苗生长的影响。结果表明,适当质量浓度的(0.001~0.100 mg·L-1)EBR处理可以提高黄瓜种子的发芽势、发芽率、胚轴长、轴根比和侧根数,减轻种子萌发和幼苗受到的低温伤害,且冷敏品种‘W-108的低温缓解效应大于耐冷品种‘RT-5。高质量浓度(1.000 mg·L-1)EBR则显著抑制黄瓜种子萌发和幼苗生长。各浓度EBR处理均不同程度降低了黄瓜幼苗的胚根长,随EBR浓度升高,抑制作用加强。运用隶属函数法对EBR各处理进行综合评价,结果表明EBR浸泡法处理效果优于添加法,其中以浸泡法0.010 mg·L-1 EBR处理对低温胁迫下黄瓜种子萌发及幼苗生长的促进效果最好。
关键词:黄瓜;油菜素内酯;低温胁迫;种子萌发;幼苗生长
Effects of brassinosteroids on seed germination and seedling growth of cucumber under low temperature stress
ZHANG Aimin, ZHOU Guoshun, FU Lijun, LI Juan, LU Qing, REN Ruixing
(Tangshan Research Institute of Agricultural Sciences, Tangshan 063001, Hebei, China)
Abstract: Two cucumber seed of different varieties were used as experimental materials, one was cold-resistant varieties ‘RT-5 and the other was cold-sensitive varieties ‘W-108. The experiment was designed to study the effects of different concentrations of 2, 4- Epibrassinolide (EBR) (0.000、0.001、0.010、0.100、1.000 mg·L-1)on seed germination and seedling growth of cucumbe under 15 ℃ low temperature stress by EBR immersion. The results showed that in a certain range of concentration of EBR, the treatment could improve the germination potential, germination rate, root length, hypocotyl ratio and the number of lateral roots of cucumber, reduce the risk of low temperature on seed germination and seedling, and the effect on cold sensitive cultivar ‘W-108 was greater than the cold resistant variety ‘RT-5. High concentration EBR (1.000 mg·L-1) significantly inhibited cucumber seed germination and seedling growth. The length of cucumber seedlings was reduced in all concentrations of EBR treatment. With the increasing of concentration of EBR, the inhibition was strengthened. The membership function method was used to evaluate the treatment of EBR. The results showed that EBR soaking method was better than adding method, and 0.010 mg·L-1 EBR soaking treatment had the best effect on seed germination and seedling growth of cucumber under low temperature stress.
Key words: Cucumber; Brassinolide; Low temperature stress; Seed germination; Seedling growth
低温胁迫是常见的非生物胁迫之一,是限制作物产量和品质的重要因素[1]。黄瓜(Cucumis sativus L.)起源于亚热带地区,属喜温作物,对低温反应敏感[2] ,生长期间特别是种子发芽期间对温度要求较高。研究表明,黄瓜种子萌发适宜温度为25~32 ℃,低于15 ℃发芽率显著降低[3-4],低于10~12 ℃幼苗生長缓慢或停止发育[5] 。然而在我国冬季和早春保护地栽培中,黄瓜常遭受0~15 ℃低温伤害,低温逆境下黄瓜种子萌发受阻、幼苗生长停滞、叶片萎蔫黄化,严重时可导致整株死亡[6]。如何提高低温下黄瓜种子萌发和幼苗期耐冷性,对解决冬春季黄瓜生产有着重要的现实意义。
油菜素内酯(brassinosteroid,BR)是20世纪70年代首次从油菜花粉中分离鉴定出的一种甾醇类化合物[7],其广泛存在于植物体内,对植物的生长发育有重要影响[8],能有效缓解多种不良因素对植物造成的伤害,增强植株抗性[9-12]。近年来研究表明,油菜素内酯在提高黄瓜耐冷性方面发挥了重要作用。外源喷施油菜素内酯可显著提高亚低温弱光环境下黄瓜幼苗的抗氧化酶活性,降低H2O2 含量及膜透性,有效促进了亚低温弱光环境下黄瓜幼苗的生长[13]。丁锦新等[14]研究发现,表油菜素内酯处理能够减缓黄瓜幼苗叶绿素的降解和电解质的外渗,从而延缓黄瓜幼苗冷害症状的出现以及生长的恢復。程群柱[15]利用不同浓度的表油菜素内酯诱导黄瓜幼苗,结果表明,无论在低温胁迫处理前和处理后施用表油菜素内酯,均可以提高黄瓜幼苗抗氧化酶活性,提高叶绿素含量,降低丙二醛含量,从而减轻黄瓜在低温弱光胁迫中所受的伤害。综上所述,外源喷施油菜素内酯(EBR)为缓解黄瓜低温胁迫提供了新方法,但目前有关油菜素内酯对低温胁迫下黄瓜种子萌发影响的研究较少,油菜素内酯对不同耐冷型黄瓜品种种子萌发、幼苗生长影响差异的研究尚未见报道。为此,笔者以2个耐冷性不同的黄瓜品种为材料,采用2,4-表油菜素内酯浸泡法和添加法处理,在15 ℃低温条件下探讨2,4-表油菜素内酯对黄瓜种子萌发和幼苗生长的促进作用,以期为黄瓜低温生产提供理论依据。
1 材料与方法
1.1 材料
供试黄瓜种子由唐山市农业科学研究院黄瓜课题组提供,其中‘RT-5为耐冷型黄瓜品种,‘W-108为冷敏型黄瓜品种。供试药剂2,4-表油菜素内酯(EBR)购自中科瑞泰(北京)生物科技有限公司。
1.2 处理
试验于2017年3—5月在唐山市农业科学院蔬菜实验室进行。挑选大小均匀、籽粒饱满的黄瓜种子,55 ℃温汤浸种15 min,期间不断搅拌,待冷却至室温,取出种子冲洗干净后进行EBR浸泡法和添加法处理。(1)EBR浸泡法:将温汤浸种后的黄瓜种子分别置于不同质量浓度(0.001、0.010、0.100、1.000 mg·L-1)的EBR溶液中,室温浸泡4 h,然后取出用蒸馏水反复冲洗3遍,均匀摆放在放有2层湿润滤纸的发芽盒内,种子置于(15±0.5)℃光照培养箱中黑暗培养,每隔1日补充2 mL清水,以清水浸泡处理的种子为对照(CK1)。(2)EBR添加法:将温汤浸种后的种子放入清水中,室温继续浸泡4 h,充分吸涨后取出摆放在2层滤纸的发芽盒内,每盒加入上述不同质量浓度EBR溶液各10 mL,待滤纸浸透后吸去多余溶液,置于(15±0.5)℃光照培养箱内黑暗培养,分别于第3天和第7天向每发芽盒内加入2 mL相应质量浓度的EBR溶液,其余同浸泡法,在相同时间添加等量清水。以添加清水处理为对照(CK2)。每品种每处理5次重复,每重复30粒种子。
1.3 调查指标与方法
自发芽之日起(以胚根突破种皮2 mm视为发芽),每天观察记录种子发芽情况,第4天统计发芽势,第12天待种子完全发芽且子叶全部展开后结束培养,统计发芽率,称量幼苗鲜质量,在每处理中随机选取15株幼苗,用LA-S万深植物根系分析仪测定胚根长、胚轴长和侧根数。干质量测定于烘箱105 ℃杀青30 min,75 ℃烘干至恒重后称量。
发芽势/%=第4天发芽种子数/供试种子数×100;
发芽率/% =第12天正常发芽种子数/供试种子数×100。
1.4 数据分析
采用 Microsoft Excel 2003 和 DPS 7.05数据处理系统对试验数据进行统计分析,用LSD法进行差异显著性检验。采用隶属函数法进行EBR低温效应的综合评价,计算发芽期8项指标的隶属值,将其平均值作为最终评价指标。计算方法为:
Wj,i = (Xj,i-Xjmin)/(Xjmax-Xjmin) ………(1)
Wi =[n=1jWj,i] ……(2)
公式(1)中Wj,i 为第j,i水平指标的得分,Xj,i 为第i水平第j个观测指标值,Xjmin 为第j个观测指标的最小值,Xjmax为第j个观测指标的最大值,n为观测指标数,Wi 为第i水平的综合隶属值。
2 结果与分析
2.1 低温胁迫下EBR对黄瓜种子萌发的影响
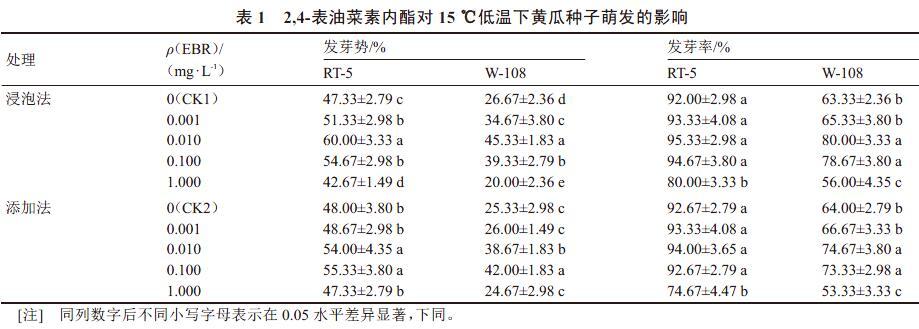
由表1可知,适当质量浓度的EBR(0.001~0.100 mg·L-1)处理能够提高低温胁迫下黄瓜种子的发芽势和发芽率,随EBR质量浓度的增加,促进作用先升高后降低。当EBR质量浓度升高到1.000 mg·L-1时对黄瓜发芽势和发芽率产生显著抑制。浸泡法中,以0.010 mg·L-1的EBR处理对2个黄瓜品种的发芽势和发芽率促进效果最好,而添加法处理中,以0.100 mg·L-1的EBR处理效果较好,显著高于对照和其他处理。
EBR对低温下耐冷性不同的2个黄瓜品种种子萌发促进效果存在差异。与对照相比,0.010 mg·L-1的EBR浸泡法处理使冷敏品种‘W-108的发芽势和发芽率分别提高了68.73%和26.32%,显著高于对照;而在相同质量浓度下,耐冷品种‘RT-5的发芽势较对照提高了26.77%,发芽率最高仅提高了3.62%,与对照差异不显著。可见EBR对种子萌发的促进效果不仅与处理方法和浓度有关,与品种耐冷程度也相关,EBR对冷敏品种的低温缓解效应大于耐冷品种。
2.2 低温胁迫下EBR对黄瓜幼苗胚根长、胚轴长和轴根比的影响
2.2.1 低温胁迫下EBR对黄瓜幼苗胚根长的影响 图1显示,各EBR处理均对黄瓜胚根长产生了不同程度的抑制,随质量浓度增加抑制作用加重。浸泡法中(图1-A),当EBR质量浓度为0.010 mg·L-1时,2个黄瓜品种的胚根长显著低于对照,当EBR质量浓度升高到1.000 mg·L-1时,‘RT-5和‘W-108的胚根长分别比对照降低了38.2%和50.2%;而添加法中(图1-B),0.001 mg·L-1的EBR即能显著抑制2个黄瓜品种的胚根长,当EBR质量浓度为1.000 mg·L-1时,‘RT-5和‘W-108的胚根长分别比对照降低了51.3%和63.8%,表明在相同EBR质量浓度下,添加法对黄瓜幼苗胚根生长的抑制率高于浸泡法。
2.2.2 低温胁迫下EBR对黄瓜幼苗胚轴长的影响 由图2可知,随着EBR质量浓度的增加,2个黄瓜品种的胚轴长表现为先升高后降低。浸泡法中,0.001~0.100 mg·L-1质量浓度范围的EBR处理对黄瓜幼苗的胚轴长起促进作用,当EBR质量浓度为0.010 mg·L-1时,冷敏品种‘W-108胚轴长达最高值,为3.35 cm,较对照提高了26.4%,差异显著;耐冷品种‘RT-5在EBR质量浓度为0.100 mg·L-1时胚轴长达最高值,为3.45 cm,较对照提高了17.3 %,表明EBR对冷敏品种胚轴长的促進效果大于耐冷品种。添加法中,0.001 mg·L-1的EBR对胚轴长起促进作用,大于此浓度则对胚轴生长产生显著抑制。
2.2.3 低温胁迫下EBR对黄瓜幼苗轴根比的影响 由图3可知,浸泡法和添加法处理下,各质量浓度EBR均能够提高15 ℃低温胁迫下黄瓜幼苗的轴根比,且随EBR质量浓度升高,轴根比不断增加。2种处理方法中,‘RT-5和‘W-108黄瓜的轴根比均在EBR质量浓度为1.000 mg·L-1时达到最高。浸泡法中,‘RT-5和‘W-108的轴根比最高分别达到了0.83和 0.97,而添加法中‘RT-5和‘W-108的轴根比最高分别达到了0.79和1.05,表明EBR对低温胁迫下黄瓜幼苗生长有缓解效应,能使低温下黄瓜幼苗的轴根比趋于正常,EBR对冷敏品种‘W-108的轴根比缓解效应大于耐冷品种‘RT-5。
2.3 低温胁迫下EBR对黄瓜幼苗侧根数的影响
由图4可知,低温胁迫下黄瓜根系生长缓慢,侧根数较常温下大量减少。2种EBR处理方法均对侧根数有明显影响,表现为随EBR质量浓度升高,侧根数呈先增加后减少的趋势。浸泡法中,EBR质量浓度低于0.001 mg·L-1时,2个黄瓜品种的侧根数与对照相比无显著差异,随EBR质量浓度进一步升高,侧根数大幅增加,冷敏品种‘W-108的侧根数在EBR质量浓度为0.010 mg·L-1时达到最多,较对照提高了45.3%,而耐冷品种‘RT-5在EBR质量浓度为0.100 mg·L-1时侧根数达到最多,较对照提高了42.3%。相较于浸泡法,添加法对黄瓜侧根数的影响较小,冷敏品种‘W-108在EBR质量浓度为0.001 mg·L-1时侧根数有所增加,较对照提高了28.4%,耐冷品种‘RT-5在EBR质量浓度为0.010 mg·L-1时侧根数达到最多,较对照提高了17.9%,之后2个品种的侧根数均随EBR质量浓度的增加呈显著下降趋势。
2.4 低温胁迫下EBR对黄瓜幼苗鲜质量和干质量的影响
由表2可以看出,EBR浸泡法和添加法处理对黄瓜幼苗鲜质量和干质量的影响存在差异。浸泡法中,0.001~0.100 mg·L-1 质量浓度范围的EBR处理对低温胁迫下2个黄瓜品种的幼苗鲜质量和干质量没有显著性影响,当EBR质量浓度达到1.000 mg·L-1时则对幼苗鲜质量和干质量产生显著抑制。添加法中,各质量浓度EBR处理均对黄瓜幼苗鲜质量和干质量产生了不同程度的抑制,随着EBR质量浓度升高,抑制作用加重,当添加法中EBR质量浓度为0.100 mg·L-1时,2个黄瓜幼苗的鲜质量和干质量较对照显著降低,且各浓度处理下的幼苗鲜质量和干质量均小于相应浓度的浸泡法处理。
2.5 综合评价
采用隶属函数法对EBR各浓度处理的应用效果进行综合评价(表3)。结果表明,0.001、0.010、0.100 mg·L-1的EBR浸泡法处理效果较好,综合隶属值分别位列第3、第1和第2,高于对照处理。而添加法中,0.001和0.010 mg·L-1 EBR处理的综合得分值略高于对照,0.100 mg·L-1的EBR处理得分值低于对照,排序为第4、第5、第8,均低于相应浓度的浸泡法处理,表明EBR浸泡法处理效果好于添加法处理,其中以0.010 mg·L-1 的EBR浸泡法处理对低温胁迫下黄瓜种子萌发及幼苗生长的促进效果最好,而EBR添加法对黄瓜幼苗低温缓解效果较差,甚至起到了负作用。
3 讨论与结论
低温胁迫是影响植物正常生长的各种不良因素之一,尤其在我国冬春季保护地生产中,低温往往是作物生长的主要限制因子。黄瓜作为喜温性蔬菜,对低温反应敏感, 当温度低至0~15 ℃时, 植株体内的各种生理机能就会发生障碍,并逐渐演变为低温伤害[16-18]。近年来研究表明,油菜素内酯在缓解低温胁迫,提高作物耐冷性方面表现出了良好效果[19-22]。笔者利用油菜素内酯中的2,4-表油菜素内酯(EBR),探讨了15 ℃低温胁迫下不同浓度EBR和不同EBR处理方式对黄瓜种子萌发及幼苗生长的影响,得出了以下结论:
(1)适当浓度的EBR对低温下黄瓜种子萌发和幼苗生长起促进作用,浓度过高则抑制种子萌发和幼苗生长。0.001~0.100 mg·L-1 的EBR浸泡法处理和0.001~0.010 mg·L-1的EBR添加法处理可以提高黄瓜种子在低温下的发芽势、发芽率、胚轴长、轴根比和侧根数,表明EBR对提高黄瓜种子萌发期的抗寒能力起到了积极的作用,这与前人的研究结果一致。但超过此浓度范围,EBR则对黄瓜幼苗各项生长指标均产生显著抑制。本试验结果表明,0.010 mg·L-1 的EBR浸泡处理对低温胁迫下黄瓜种子萌发及幼苗生长的促进效果最好。
(2)不同处理方法影响EBR作用效果。从试验结果来看,EBR浸泡法和添加法处理对低温胁迫的缓解效应存在差异。添加法中,较低质量浓度的EBR(0.100 mg·L-1)即可对黄瓜幼苗生长产生抑制作用,且各浓度EBR处理下的发芽势、发芽率、鲜质量、干质量、侧根数等指标均小于相应浓度的浸泡法处理。综合评价结果显示,得分值排名前3的处理均为EBR浸泡法,说明浸泡法对低温胁迫的缓解作用较好,效果明显优于添加法,这与闫小红等[22]的研究结果一致。
(3)EBR对耐冷性不同黄瓜品种的低温缓解效应存在差异。本研究结果表明,0.010~0.100 mg·L-1 的EBR处理能够显著提高低温下冷敏品种‘W-108的发芽率,但对耐冷品种‘RT-5的发芽率影响不大;EBR最佳处理质量浓度下(浸泡法0.010 mg·L-1),冷敏品种‘W-108的发芽势、发芽率、胚轴长、轴根比、侧根数等指标的提高幅度均大于耐冷品种‘RT-5,说明EBR对冷敏型黄瓜品种的低温缓解效应大于耐冷型黄瓜品种。
鉴于不同浓度EBR的作用效果存在差异且不同抗性品种对EBR的耐受性不同,在今后的研究中还需进一步细化处理浓度,探索EBR在不同抗性试验以及对不同抗性品种的最佳使用浓度。除此以外,对于EBR在低温下生理、分子方面的作用机制还需进一步探索研究。
参考文献
[1] 向娟,潘绍坤,鲁荣海,等.不同 CaCl2 浓度对低温胁迫下豇豆幼苗生理指标的影响[J].中国瓜菜,2019,32(3):38-42.
[2] 王红飞,李锡香,王海平,等.黄瓜低温耐受性鉴定方法的初步研究[J].中国蔬菜,2015(3):17-25.
[3] 于拴仓,崔鸿文,孟焕文.黄瓜发芽期耐低温性鉴定方法与指标的研究[J].西北农业大学学报,2000,28(3):1-6.
[4] 王永健,姜亦巍,曹苑虹,等.低温对不同品种黄瓜种子萌发、过氧化物酶及同功酶的影响[J].华北农学报,1995,10(5):72-76.
[5] 史跃林,宋述尧.温度对黄瓜生理生育的影响及管理实践[J].中国蔬菜,1989(3):43-47.
[6] 高志杰,王国华.黄瓜对低温反应的研究进展[J].华北农学报,2002,17(S1):29-31.
[7] MITCHELL W J,MANDAVA N,WORLEY F J,et al. Brassins - a new family of plant hormones from rape pollen[J].Nature,1970,225(5237):1065-1066.
[8] 郑洁,王磊.油菜素内酯在植物生长发育中的作用机制研究进展[J].中国农业科技导报,2014,16(1):52-58.
[9] KRISHNA P.Brassinosteroid-mediated stress responses[J].Plant Growth Regulation,2003,22(4):289-297.
[10] NAKAYA M,TSUKAYA H,NURAKAMI N,et al.Brassinosteroids control the proliferation of leaf cells of Arabidopsis thaliana[J].Plant Cell Physiology,2002,43(2):239-244.
[11] ANURADHA S,RAO S R.Effect of brassinosteroids on salinity stress induced inhibition of seed germination and seedling growth of rice (Oryza sativa L.)[J].Plant Growth Regulation,2001,33(2):151-153.
[12] SAIRAM R K.Effect of homobrassinolide application on plang metabolismand grain yield under irrigated and moisture stress conditions of two wheat varieties[J].Plant Growth Regulation,1994,14(2):173-181.
[13] 吴秀,陆晓民.亚适宜温光盐环境下油菜素内酯对黄瓜幼苗抗氧化系统及光合作用的影响[J].应用生态学报,2015,26(9):2751-2757.
[14] 丁锦新,陶晓東,黄素青.表油菜素内酯对黄瓜幼苗抗冷性的影响[J].浙江农业科学,1998(4):195-197.
[15] 程群柱.低温弱光对黄瓜伤害机制及油菜素内酯诱导抗性研究[D].长春:吉林农业大学,2011.
[16] 张红梅,金海军,丁小涛,等.黄瓜早期耐冷性鉴定指标的筛选[J].上海农业学报,2009,25(4):31-35.
[17] 逯明辉,娄群峰,陈劲枫.黄瓜的冷害及耐冷性[J].植物学通报,2004,21(5):578-586.
[18] 邬树桐,孙小镭,王冰.黄瓜不同品种苗期耐低温弱光特性测定初报[J].中国蔬菜,1994(1):26-28.
[19] 王红红,李凯荣,侯华伟.油菜素内酯提高植物抗逆性的研究进展[J].干旱地区农业研究,2005,23(3):213-219.
[20] 周爱清,骆炳山,任筱波.油菜素内酯对水稻幼苗生长及耐冷性的影响[J].华中农业大学学报,1987,6(1):8-13.
[21] 王炳奎,曾广文.表油菜素内酯对水稻幼苗抗冷性的影响[J].植物生理学报,1993,19 (1) :38-42.
[22] 闫小红,胡文海,曾守鑫,等.低温胁迫下2,4-表油菜素内酯对辣椒种子萌发及幼苗生长的影响[J].华中农业大学学报,2012,31(5): 563-568.

