目标血糖管理下脓毒症肺损伤大鼠转录激活因子3与内皮特异性分子-1的表达及意义
(新疆石河子大学医学院第一附属医院重症医学二科,石河子市,832000) 田培刚 李建华 程青虹
急性肺损伤(acute lung injury,ALI)是由各种原因造成弥漫性肺间质及肺泡水肿进而出现急性低氧性呼吸功能不全,其中脓毒症被认为是造成急性肺损伤最主要的危险因素[1]。在中国,因感染入住ICU的患者高达59%,其中约37.3%发展为严重脓毒症及脓毒症休克,27.1%发展为ALI及ARDS[2]。对脓毒症患者进行严格目标血糖管理能降低机体炎症反应,恢复患者免疫功能,改善预后[3]。本研究观察胰岛素目标血糖管理下脓毒症大鼠转录激活因 子 3(signal transducers and activators of transcription 3,Stat3)和内皮细胞特异性分子-1(endothelial cell specific molecule-1)的表达情况,探讨二者在发生急性肺损伤时是否具有相关性及其可能的作用机制。
1 材料与方法
1.1 脓毒症大鼠模型的建立
40只由新疆医科大学实验中心提供的SPF级健康雄性SD大鼠,体重(300±20)g。术前禁食12h,不禁水,戊巴比妥钠100mg/kg腹腔注射麻醉,仰卧位固定。颈、腹部备皮,右颈外静脉置管用于输液,用改良的盲肠结扎穿孔术(CLP)制备大鼠脓毒症模型。脓毒症造模成功标准:可达到动物全身炎症反应综合征参照标准[4]。盲肠结扎穿孔术具体方法为:沿中下腹正中切口2cm,盲肠根部结扎,自制穿孔针在盲肠末端1cm处戳直径约0.5cm的孔,挤出约黄豆粒大小的粪便。结扎离断双侧大网膜,关闭腹腔缝合,术后立即经皮下注射50ml/kg乳酸钠林格液。
1.2 动物模型分组及处理
随机分为5组,每组8只:假手术组(Sham组)仅做开关腹处理,Sham组和脓毒症组(CLP组)术后静脉泵给予与血糖控制组等容量的生理盐水;各血糖控制组(A、B、C组)静脉泵入胰岛素生理盐水,A组血糖控制在4.4-6.1mmol/L,B组血糖控制在6.2-8.3mmol/L,C组血糖控制在8.4-10.0mmol/L。胰岛素用法为15U速效胰岛素(江苏万邦生物医药公司)加入20ml生理盐水内用微量泵泵入,快速血糖仪测大鼠尾静脉血糖水平,及时调整胰岛素用量,间隔为1h,各组间进液体量的差异用生理盐水补齐。
表1各组大鼠肺组织损伤病理评分的比较(± s)
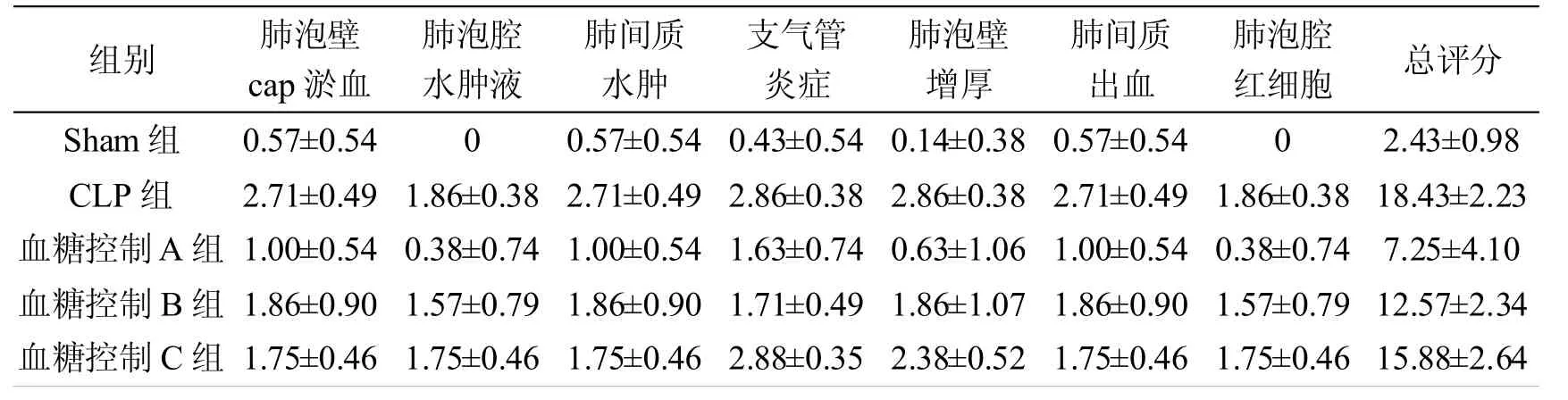
表1各组大鼠肺组织损伤病理评分的比较(± s)
组别 肺泡壁cap淤血肺泡腔水肿液肺间质水肿支气管炎症肺泡壁增厚肺间质出血肺泡腔红细胞 总评分Sham 组 0.57±0.54 0 0.57±0.54 0.43±0.54 0.14±0.38 0.57±0.54 0 2.43±0.98 CLP 组 2.71±0.49 1.86±0.38 2.71±0.49 2.86±0.38 2.86±0.38 2.71±0.49 1.86±0.38 18.43±2.23血糖控制A 组 1.00±0.54 0.38±0.74 1.00±0.54 1.63±0.74 0.63±1.06 1.00±0.54 0.38±0.74 7.25±4.10血糖控制 B 组 1.86±0.90 1.57±0.79 1.86±0.90 1.71±0.49 1.86±1.07 1.86±0.90 1.57±0.79 12.57±2.34血糖控制 C 组 1.75±0.46 1.75±0.46 1.75±0.46 2.88±0.35 2.38±0.52 1.75±0.46 1.75±0.46 15.88±2.64
表2各组大鼠血清ESM-1含量的比较(± s)
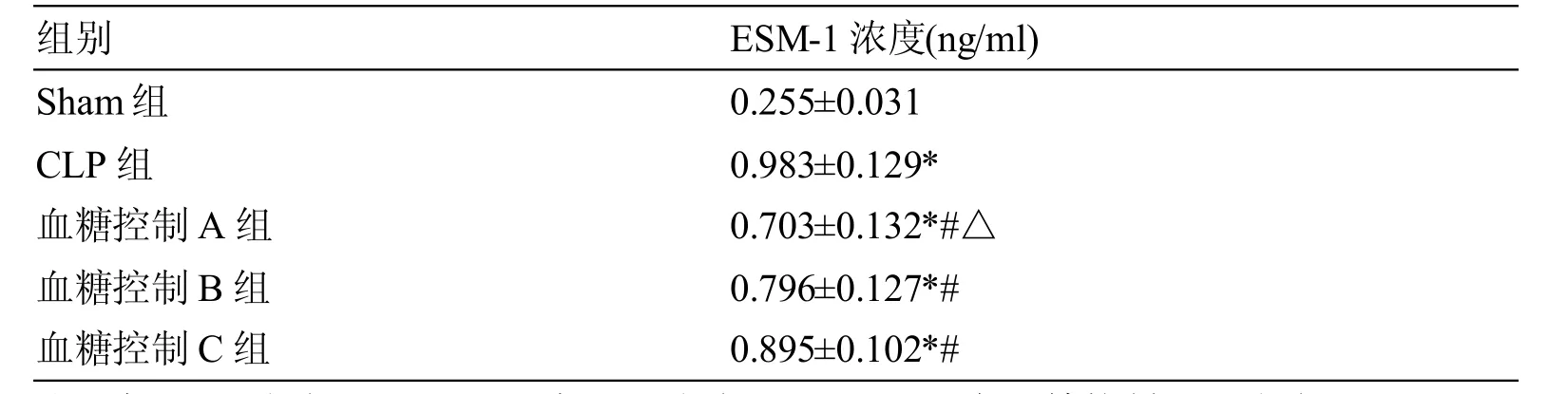
表2各组大鼠血清ESM-1含量的比较(± s)
注:*与Sham组相比,P<0.05;#与CLP组相比,P<0.05;△与血糖控制B、C组相比,P<0.05。
组别Sham组CLP 组血糖控制A组血糖控制B组血糖控制C组ESM-1浓度(ng/ml)0.255±0.031 0.983±0.129*0.703±0.132*#△0.796±0.127*#0.895±0.102*#
1.3 采集标本
于术后12h从大鼠右颈外静脉取血1ml,3000r/min,离心15min后取血清分装后,-80℃冰箱保存。大鼠处死后,开胸取出完整肺组织,切取3mm×3mm大小的右下肺组织两块,石蜡固定。
1.4 血清ESM-1检测
采用大鼠ESM-1双抗体夹心试剂盒(上海西唐生物科技有限公司)检测,严格按照说明书操作,在酶标仪上选择波长450nm处测定。
1.5 肺组织p-Stat3检测
采用免疫组化染色试剂盒(北京中杉金桥生物有限公司)检测,组织切片中p-Stat3为细胞核呈浅黄色至棕色颗粒。400倍光学显微镜下选取10个不同视野,每个视野分别计数100个同类细胞,并按照许良中等[5]的评分标准对染色结果进行评分。
1.6 肺组织病理学检查
用常规方法制作HE染色石蜡病理切片,光镜下观察、拍照,并参考Hamid等[6]的评分标准计算肺组织损伤病理积分。
1.7 统计学处理
采用SPSS17.0统计软件,计量资料以(x±s)表示,整体比较方差齐采用单因素方差分析,两两比较采用SNK-q检验,相关性分析采用Pearson法和Spearman法,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肺组织损伤病理评分
各组大鼠肺组织损伤病理总评分中,Sham组与CLP组和血糖控制A、B、C组相比,差异均有统计学意义(均P<0.05);CLP组与血糖控制A、B组相比,差异均有统计学意义(均P<0.05),与血糖控制C组相比差异无统计学意义(P>0.05);血糖控制三组间比较,均有统计学意义(均P<0.05)。见表1。
2.2 各组大鼠血清中ESM-1的比较
经单因素方差分析,各组大鼠血清ESM-1含量见存在显著性差异(P<0.05),进一步采用SNK-q法进行各组间的两两比较发现:CLP组血清ESM-1含量明显高于Sham组及血糖控制A、B和C组,差异有统计学意义(P均<0.05);血糖控制A、B、C三组血清ESM-1含量高于Sham组(P均<0.05);血糖控制A组的血清ESM-1含量较B组和C组明显降低(P均<0.05);而血糖控制B组和C组的ESM-1含量差异无统计学意义(P>0.05)。见表2。
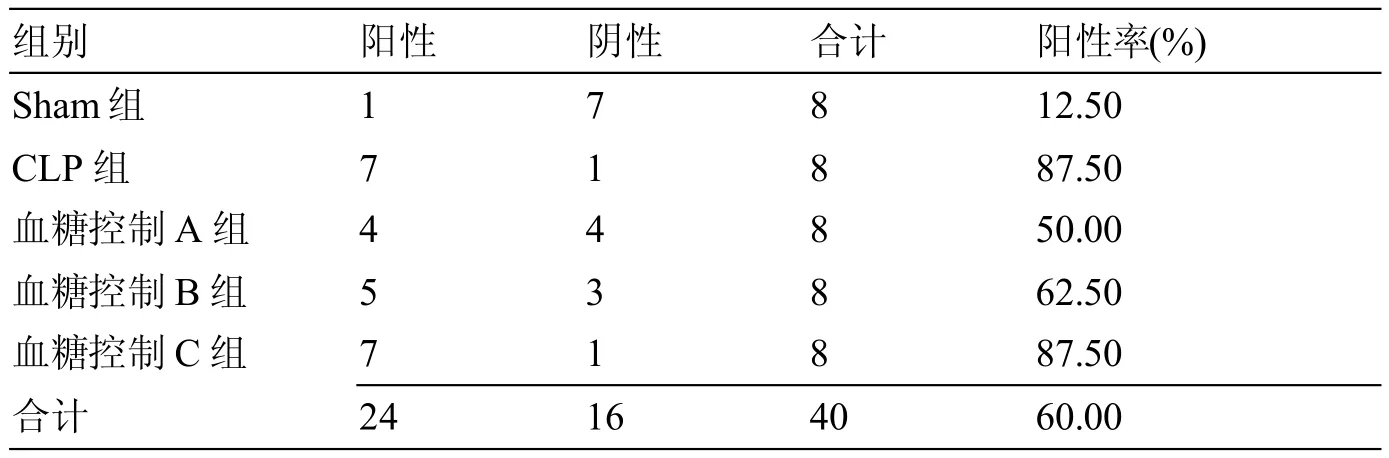
表3 p-Stat3在各组肺组织中表达阳性率的比较
2.3 各组大鼠肺组织p-Stat3免疫组化染色结果
p-Stat3在Sham组、CLP组、血糖控制A组、血糖控制B组和血糖控制C组的阳性表达率分别为12.50%、87.50%、50.00%、75.00%和87.5%。与Sham组相比,CLP组、血糖控制B组和血糖控制C组差异有统计学意义(均P<0.05),其余相比均无统计学意义。免疫组化染色显示p-Stat3的表达在组织炎症反应中病损较严重的区域表达水平较高,尤其在CLP组中。见表3。
图1Sham组
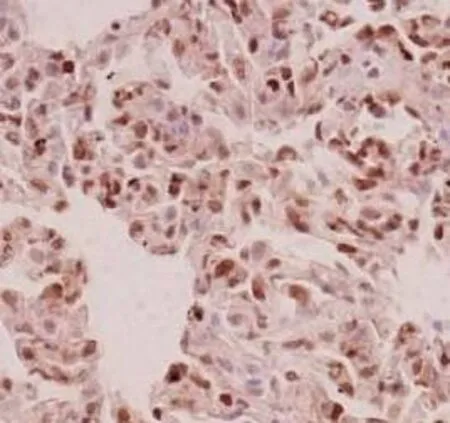
图2CLP组
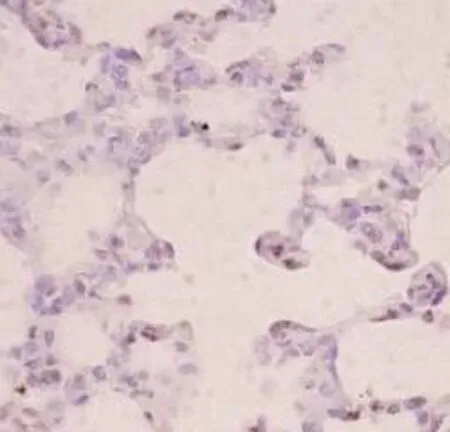
图3 血糖控制A组
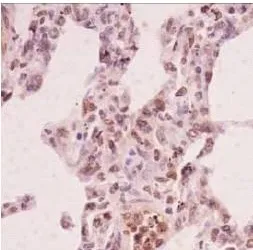
图4 血糖控制B组
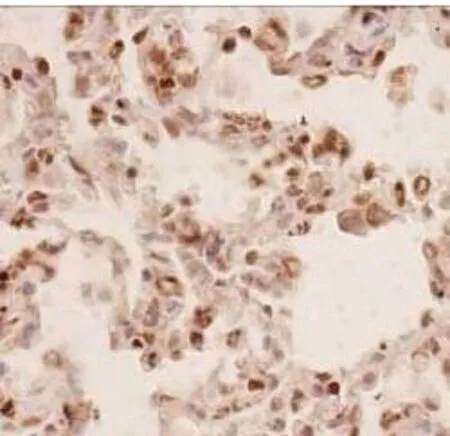
图5 血糖控制C组
注:p-Stat3在各组大鼠肺组织中的免疫组化染色(PV-6001 Two-step法)①血糖控制A组p-Stat3显示在肺组织散在细胞核表达(×400);②血糖控制B组p-Stat3表达较A组略强(×400);③血糖控制C组p-Stat3出现弥漫细胞核强阳性表达(×400);④Sham组p-Stat基本无表达(×400);⑤CLP组p-Stat3出现弥漫细胞核强阳性表达,尤其是炎症较重的区域(×400)。
2.4 各组大鼠肺组织p-Stat3、血清ESM-1及肺组织损伤的相关性分析
肺组织p-Stat3、血清ESM-1与肺组织损伤程度均呈正相关,相关系数分别为0.541和0.946,差异均有统计学意义(均P<0.05)。肺组织p-Stat3与血清ESM-1呈正相关,相关系数为0.541,差异有统计学意义(P<0.05)。
3 讨论
肺脏是发生脓毒症后炎症因子主要攻击的靶器官,患者一旦并发急性肺损伤往往预后不佳,因此早诊断、早治疗具有重要的临床意义。Jak/Stat信号转导通路是脓毒症时细胞因子信号传导的重要途径,把细胞膜上感受到的信号直接传递到细胞核内,启动基因转录。JAKs的JH1的结构域催化STATs上相应部位的酪氨酸残基磷酸化,同时STATs的SH2功能区与受体中磷酸化的酪氨酸残基作用而使STATs活化,STATs进入核内同其他转录因子相互作用进而调控基因转录,包括多种细胞因子(TNF-α,IL-2,IL-6,IL-8,IFN-β等)、趋化因子、黏附分子和诱导NO合酶等的表达,参与炎症反应。目前已有研究[7]表明,Jak2和Stat3参与各种组织的缺氧、缺血再灌注损伤和严重感染的发生和发展过程,过度激活的Jak/Stat通路可诱导大量的磷酸化Jak2和Stat3生成,可能是内毒素导致肺损伤机制的新解释。ESM-1是人体内肺脏和肾脏等血管内皮细胞分泌的稳定表达于血浆中的一种糖蛋白,其影响白细胞的黏附、迁移,并在炎症性疾病中起重要作用。Scherpereel等[8]的研究发现,ESM-1具有较高的敏感性和特异性,受试者工作曲线下面积(AUROC)高达0.923(95%CI:0.851~0.995),明显优于降钙素原、C反应蛋白、IL-10和IL-6等。而且在脓毒症患者的危险分层中,ESM-1同样具有较高的敏感性和特异性,预测10d内死亡的AUROC为0.752(95%CI:0.572~0.933),28d内死亡的 AUROC为0.810(95%CI:0.682~0.937)。在正常情况下,人体血清ESM-1表达于积极增生性或新生组织和细胞,如腺组织、新生血管内皮细胞、支气管上皮细胞和淋巴结生发中心等,表达水平很低[9]。但在脓毒症患者血清中ESM-1的表达水平明显上升,ESM-1的升高可能与机体疾病及其严重程度联系密切[10]。ESM-1的mRNA表达受细胞因子的调控,TNF-α对ESM-1的表达有正调控作用[11]。ESM-1具有非常广泛的生物活性,可能通过多种信号转导途径对人体内的肿瘤等疾病的发生、机体炎症、肿瘤血管的生成产生调控作用[12]。
本研究结果显示,肺组织p-Stat3、血清ESM-1与肺组织损伤程度均呈正相关,随着脓毒症程度的加重,大鼠肺组织p-Stat3的阳性率增加,血清ESM-1的表达升高,同时p-Stat3与血清ESM-1也具有正相关性。脓毒症早期内毒素(脂多糖,LPS)可激活丝裂原活化蛋白激酶通路,诱导TNF-α等多种炎性细胞因子大量生成。TNF-α作为一种重要的早期炎症介质,间接激活Janus激酶/信号转导和转录激活因子(Jak/Stat)通路。STATs活化后直接进入核内参与LPS诱导的基因表达Stat3在细胞内起着重要的信号传递作用,负责将细胞外的信号传递到细胞核,在核内与靶基因的启动子结合,诱导靶基因的转录。随着Stat3剂量的增加,TNF-α基因表达亦随之增强, 同时核内的Stat3蛋白与TNF-α基因启动子结合,诱导基因转录[13]。综上,我们可认为发生脓毒症时,早期炎症介质TNF-α激活Jak/Stat途径使得p-Stat3高表达,并促进TNF-α表达,进而对ESM-1产生正调控作用。
总之,肺组织p-Stat3、血清ESM-1在脓毒症肺损伤中高表达,并随着肺组织损伤程度的增加而增加,其表达水平对脓毒症急性肺损伤的诊断和预后具有很好的生物学价值。但鉴于发病机制及病理生理的复杂性,仍需大样本研究结果进一步验证。

