碳酸氢盐投加对寡枝刚毛藻光合色素及碳酸酐酶活性的影响研究
马淑娟, 孙力平,*, 钟远, 邱春生, 王晨晨, 王少坡
碳酸氢盐投加对寡枝刚毛藻光合色素及碳酸酐酶活性的影响研究
马淑娟1,2, 孙力平1,2,*, 钟远1,2, 邱春生1,2, 王晨晨1,2, 王少坡1,2
1. 天津城建大学环境与市政工程学院, 天津 300384 2. 天津市水质科学与技术重点实验室, 天津 300384
研究了投加碳酸氢盐对寡枝刚毛藻()生长和生理生化特性的影响。结果表明, 初始碱度为11.7 mmol·L–1时藻体生长较好, 12天后, 藻体湿重比对照组增加了47.57%。寡枝刚毛藻对碳酸氢盐碳源有较强的利用能力。与对照组相比, 实验组藻体内叶绿素b/叶绿素a(Chl.b/Chl.a)的值降低, 类胡萝卜素/叶绿素(Caro/TChl)的值升高。实验末期, 高碱度组中藻体内碳酸酐酶活性相比对照组降低了74.6%。
寡枝刚毛藻; 碱度; 光合色素; 碳酸酐酶活性
1 前言
在藻类水华成因与过程研究中,除了氮磷以外,碳源的作用日益引起关注。在富营养化水体中, 藻类的大量繁殖使得水生态系统中溶解性无机碳平衡发生转化, pH值和碱度升高[1–2]。大量研究表明,在氮磷充足时, CO2HCO3–和CO32–成为藻类吸收的重要无机碳源[3-4]。我国北方水体多为微碱性, 天津大多数水体pH值在8.0—9.5的范围内, 碱性水体环境易于吸收大气中的CO2, 有利于藻类的光合作用[5], 在正常淡水中, 藻类对无机碳的利用大约有80%是HCO3–[6], 因此, 能否利用碳酸氢盐或者对其利用程度的高低会影响该种藻类的生长, 进而影响种类的演替。包括铜绿微囊藻在内的大量水华蓝藻在富营养化水中有较大竞争优势是因为其体内存在二氧化碳浓缩机制[7], 即藻细胞可以通过体内的碳酸酐酶将HCO3–转化为CO2。碳源不仅影响藻类的光合作用还与光合色素的含量和组成有关, 有研究[8]表明碳源增加有利于叶绿素含量升高, 进而有助于碳同化时对能量的需求。Gardner[9]和Juneja[10]指出无机碳源浓度的适当增加可以提高光合效率和生长速率, 进而提高细胞内脂类和类胡萝卜素的合成。在海洋微藻的研究中也得到了类似的结论[11-12]。
刚毛藻作为自然界中广泛存在的绿藻, 在污水处理中的应用得到了较大规模的研究和探讨。雷国元[13]指出刚毛藻可有效去除氮磷并抑制微藻的生长。刚毛藻具有强耐污性和易于收获藻类细胞等优势[14]。凡传明[15]指出刚毛藻对藻类群落结构的影响主要来自于营养盐的竞争, 对水华蓝藻的抑制率达到99.63%[16]。寡枝刚毛藻无论在低营养水体环境还是氮磷浓度高的湖泊水中, 都能维持生长并有效净化水质[17]。可见, 刚毛藻在富营养化水体修复中具有潜在的应用前景。然而, 以碳酸氢盐作为外加碳源对刚毛藻生长和生理生化特性的影响研究尚未见报道。因此, 本研究以在天津郊区湖泊中采集的刚毛藻为材料, 深入研究高碱度环境对刚毛藻生理生化特性的影响, 探讨碱度增加的环境下HCO3-作为无机碳源对刚毛藻光合色素和碳酸酐酶活性的影响, 以期为刚毛藻的增殖机理和利用刚毛藻等大型丝状藻类控制水华和净化水质提供数据支持。
2 材料与方法
2.1 实验材料
试验藻种采自以大沽河为水源的天津市西青郊野公园, 显微镜镜检表明, 漂浮藻体以寡枝刚毛藻()为优势藻, 同时存在其他浮游藻类。将寡枝刚毛藻藻丝分离出来后, 用蒸馏水反复清洗藻体, 去除附着藻体表面的杂质和其他浮游藻类, 转移至稀释三倍的 BG11 培养基(模拟藻体原生长水质环境)中培养, 待培养出足够数量新生藻丝后, 置于恒温光照培养箱用蒸馏水“饥饿”培养三天。实验用水为西青郊野公园原湖水(采自水面以下0.5米处), 静置, 滤纸过滤后用于实验。
2.2 实验设计
以湖水自然碱度(6.15 mmol·L–1, 原水组)为对照, 通过向湖水中添加不同剂量的0.1 mmol·L–1的NaHCO3溶液, 调整实验水的初始碱度分别为11.7 mmol·L–1和34.35 mmol·L–1(参照预实验设置), 简记为中碱度组和高碱度组, 每组各设3个平行。取250 mL广口锥形瓶18个, 向每个锥形瓶中各加入200 mL实验用水, 将这些锥形瓶置于灭菌容器内121℃高温下灭菌20 min。称取“饥饿”培养的刚毛藻(湿重)0.5 g, 分别投放到锥形瓶中, 置于光照强度为3500 lx的光照培养箱中培养, 设置温度为(25±1) ℃, 光暗周期比为12 h:12 h。在光照周期内, 每天摇动锥形瓶3—4次, 并随机交换锥形瓶位置, 使光照均匀。藻体接种是在实验开始第一天的早上八点, 取样时间设定在开始光照两小时之后, 即早上十点, 每天准时取样。pH和溶解氧(DO)一天一测, 叶绿体色素在实验开始(即实验第一天)和实验结束(即实验最后一天, 藻体处于衰亡期)时各测一次, 碳酸酐酶活性在实验开始后的第3天(藻体处于指数期)和实验结束时各测一次, 藻体湿重在实验开始、实验中期(即实验开始后的第6天, 藻体处于指数后期)和实验结束时各测一次。
2.3 溶液中相关指标和藻体生长参数的测定
培养液中DO和pH使用WTW Multi 340手持多参数检测仪检测。刚毛藻湿重的测定方法为滤纸吸取水分后称重[18]。刚毛藻相对生长速率的测定参考相关文献[19], 相对生长速率按如下公式计算:
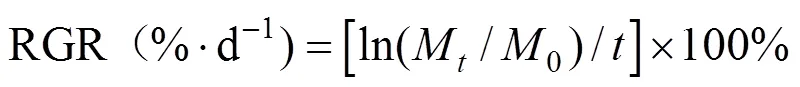
式中, RGR为相对生长速率(%·d–1);M为藻体初始湿重(g);M为天后的藻体湿重(g)
2.4 叶绿素和类胡萝卜素含量的测定[20]
称取0.2 g鲜藻体, 将藻体剪碎放入研钵中, 加入少量石英砂和碳酸钙粉末以及95%的乙醇3 mL, 研磨成匀浆, 再加10 mL95%的乙醇继续研磨提取, 放在4 ℃冰箱中黑暗保存, 12 h后用滤纸过滤, 最后用95%的乙醇定容到25 mL。使用紫外可见分光光度计在665、649和470 nm处测定提取液光密度。通过计算得到叶绿素a(Chla)、叶绿素b(Chlb)、叶绿素(TChl)和类胡萝卜素(Caro)的含量。Tchl的含量由Chla和Chlb含量相加得到。叶绿素a、叶绿素b和类胡萝卜素浓度(mg·L–1)的计算公式如下:
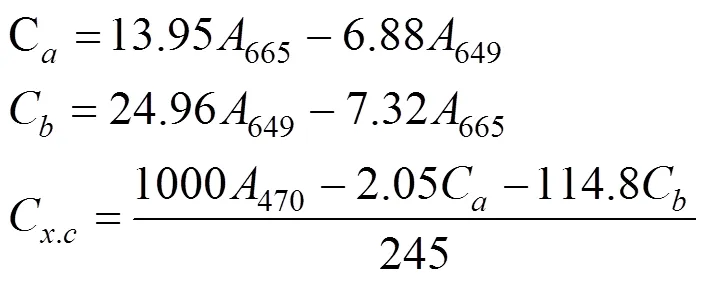
得到色素浓度后再按照下列公式计算色素含量(mg·g–1):
式中:为色素浓度(mg·L–1);为提取液的体积(mL);为稀释倍数;为藻湿重(g)
2.5 总碳酸酐酶(CA)活性的测定[21]
取鲜藻体0.016 g, 放到预冷的研钵中, 加入3 mL巴比妥缓冲液(10 mmol·L–1,含巯基乙醇50 mmol·L–1, pH 8.3)进行研磨, 取研磨液倒入10 mL的离心管中, 定容到9mL, 将离心管置于冰浴中20min后, 在5000 r·min–1下离心10min,取上清液,冷藏待测。
碳酸酐酶(CA)活性的测定采用pH计法[22]。保持反应系统在4℃左右, 取待测上清液1 mL, 加入到含15 mL的巴比妥缓冲液(20 mmol·L–1, pH8.3)的小烧杯中, 然后迅速加入10 mL预冷的0℃饱和CO2蒸馏水(向冰浴的蒸馏水中充60 min CO2气体), 用pH计检测反应体系pH值下降一个单位(例如pH值从8.3—7.3)所需的时间, 记为, 同时记录在不加藻液的条件下pH 值下降一个单位所需的时间, 记为t,酶的活性用下列公式计算:

式中:为藻湿重(g)
2.6 数据处理
选用Excel 2007和Origin 8.6软件进行数据分析与绘图, 并使用Origin 8.6软件计算均值±标准差和单侧T检验进行统计检验。
3 结果与分析
3.1 碱度对刚毛藻pH、DO和生长的影响
由图1a可知, 实验初期, 添加的NaHCO3量不同, 起始pH值不同。第4天时, 各组pH值开始变化, 从第4天到第8天, 中碱度组的pH值基本高于其他两组, 实验前8天, 三组实验组pH值均有上升趋势, 但差异不显著(>0.05)。从第8天起, 原水组和中碱度组pH值开始下降, 高碱度组持续上升, 且高碱度组pH高于其他两组, 差异显著(<0.05)。原水组和中碱度组最大pH值分别为9.44和9.56。在整个实验期间, 高碱度组碳酸氢盐浓度对pH值影响显著(<0.05)。
由图1b可知, 实验前3天, 原水组DO高于其他两组, 高碱度组DO含量最低, 与原水组相比有显著下降(<0.05)。从第4天到第11天, 中碱度组DO明显高于其他两组(<0.05), 3组实验组中DO均呈现大致的先升后降的趋势, 其中中碱度组和高碱度组DO在第8天达到最大值, 在整个实验期间, 中碱度组初始碱度对体系DO影响显著(<0.05)。图2显示的是3组实验组藻湿重在实验中期和后期的变化, 从图中可看出, 中碱度组在实验中期和后期, 藻湿重比其他两组都要高, 但差异不显著(>0.05)。
依据图3分析数据可知, 实验第6天, 原水组、中碱度组和高碱度组藻体湿重增长率分别为: 31.74%、38.65%和20.45%, 中碱度组增长较快; 实验第12天, 即实验末期, 藻体湿重增长率分别为40.39%、47.57%和38.63%, 因此, 中碱度组藻体湿重增长率最大。图4是不同碱度组藻体相对生长率变化。相对生长速率在一定条件下反映藻类潜在增长率。实验前5天, 中碱度组具有最高相对生长速率为: 6.54 %·d–1。实验后5天, 3组相对生长速率都有降低, 原水组和中碱度组降幅较大, 而高碱度组较其他两组反而要高。
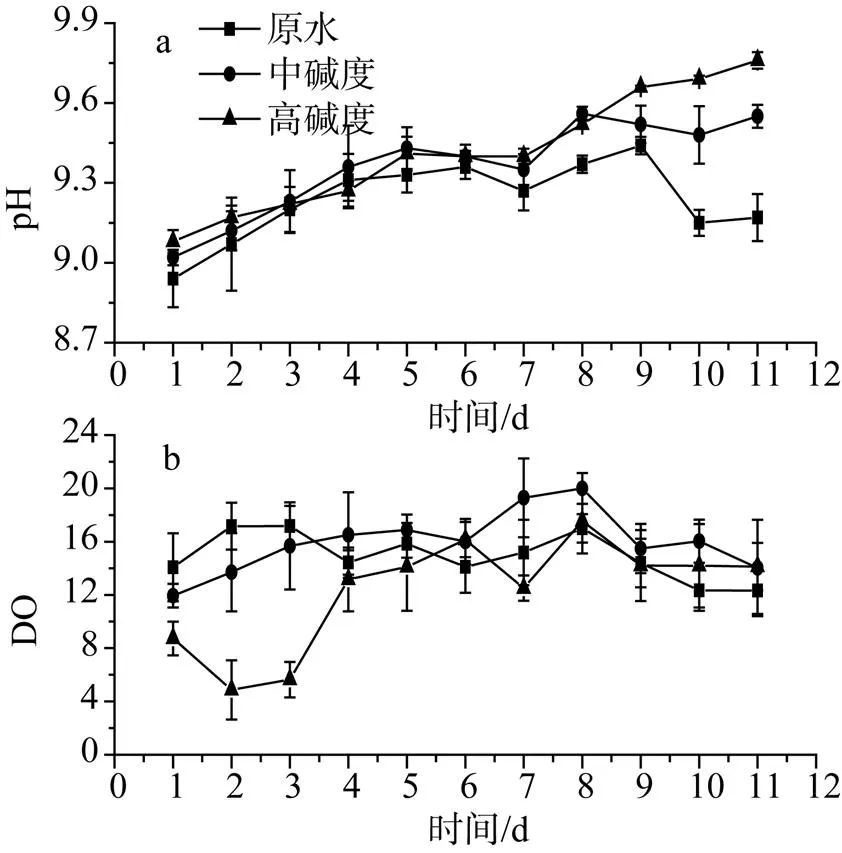
图1 不同碳酸氢钠浓度对pH和DO的影响
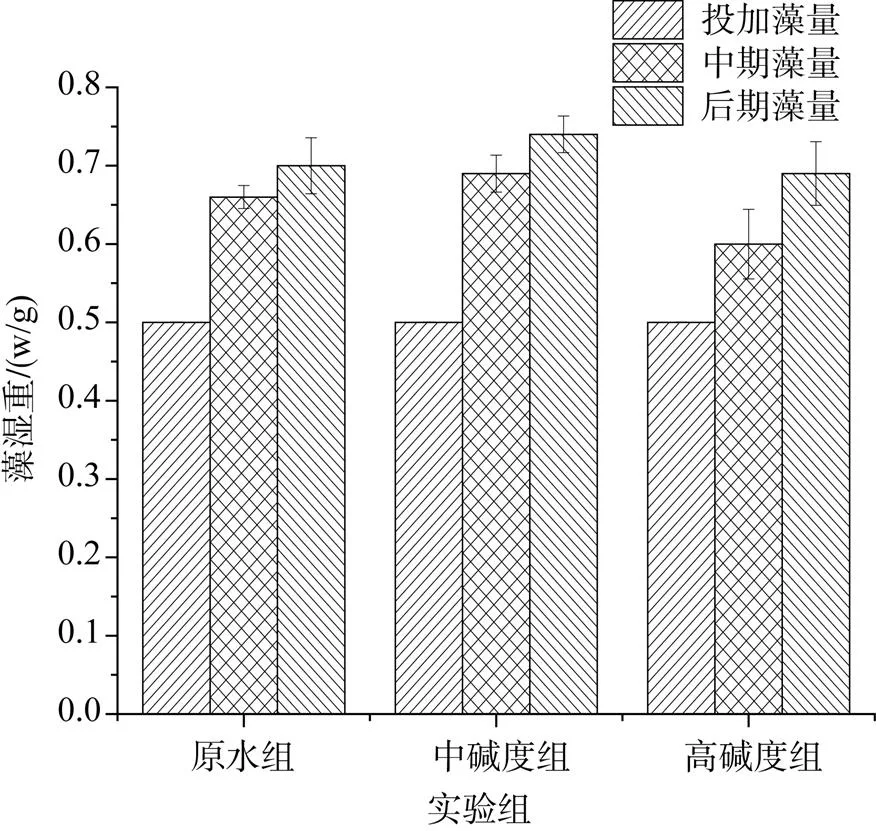
图2 不同碳酸氢钠浓度对藻湿重的影响
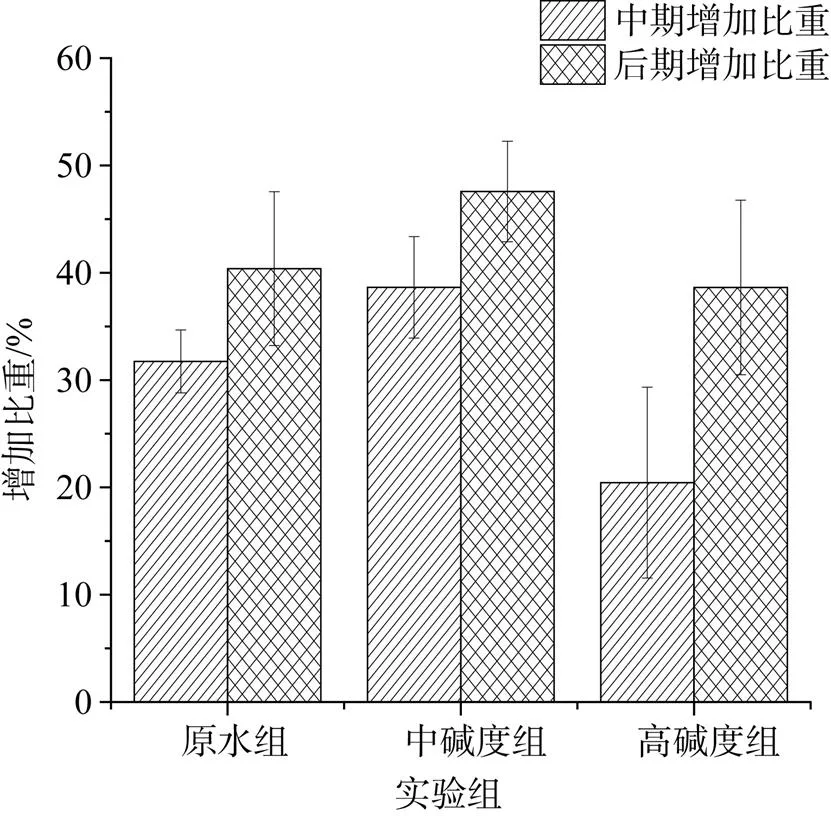
图3 不同碳酸氢钠浓度对藻增加比重的影响
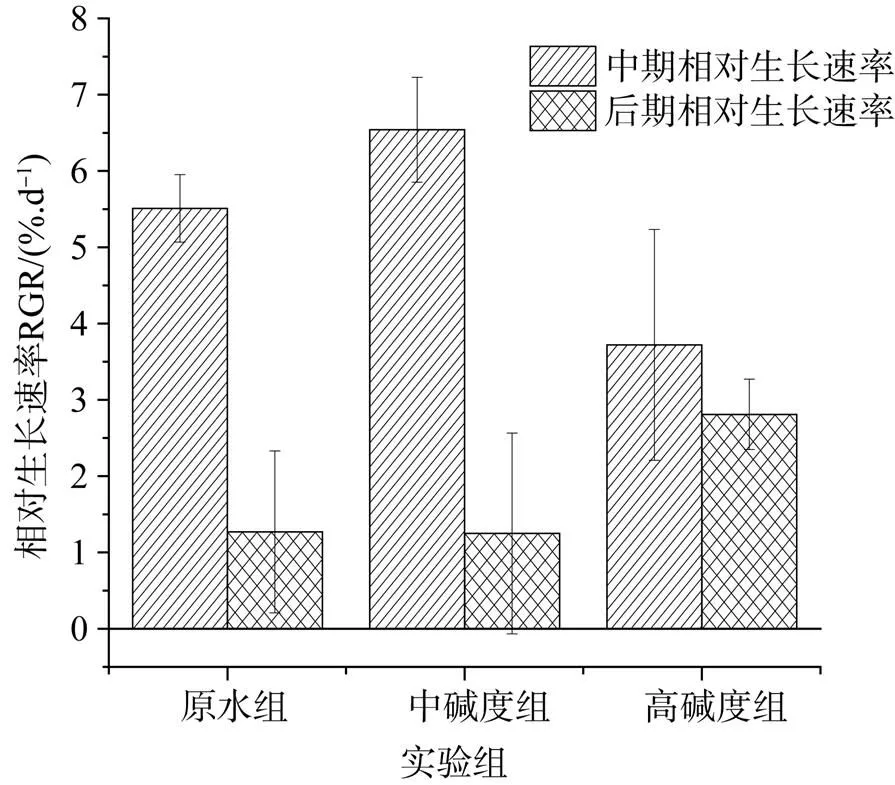
图4 不同碳酸氢钠浓度对相对生长速率的影响
3.2 碱度对刚毛藻光合色素的影响
由图5可知: 实验结束后, 叶绿素a、叶绿素b和类胡萝卜素含量跟实验前相比都有不同幅度的降低, 差异显著(<0.05)。中碱度组叶绿素a含量较其他两组要高, 与高碱度组相比, 有显著差异性(<0.05)。图6显示碱度增加使刚毛藻Chl.b/Chl.a的值显著下降(<0.05), 说明它更有利于叶绿素a形成。图7显示Caro/TChl的值随碱度增加而升高, 但差异不显著(>0.05), 表明碱度增加对类胡萝卜素影响不大。

图5 不同碳酸氢钠浓度对光合色素的影响
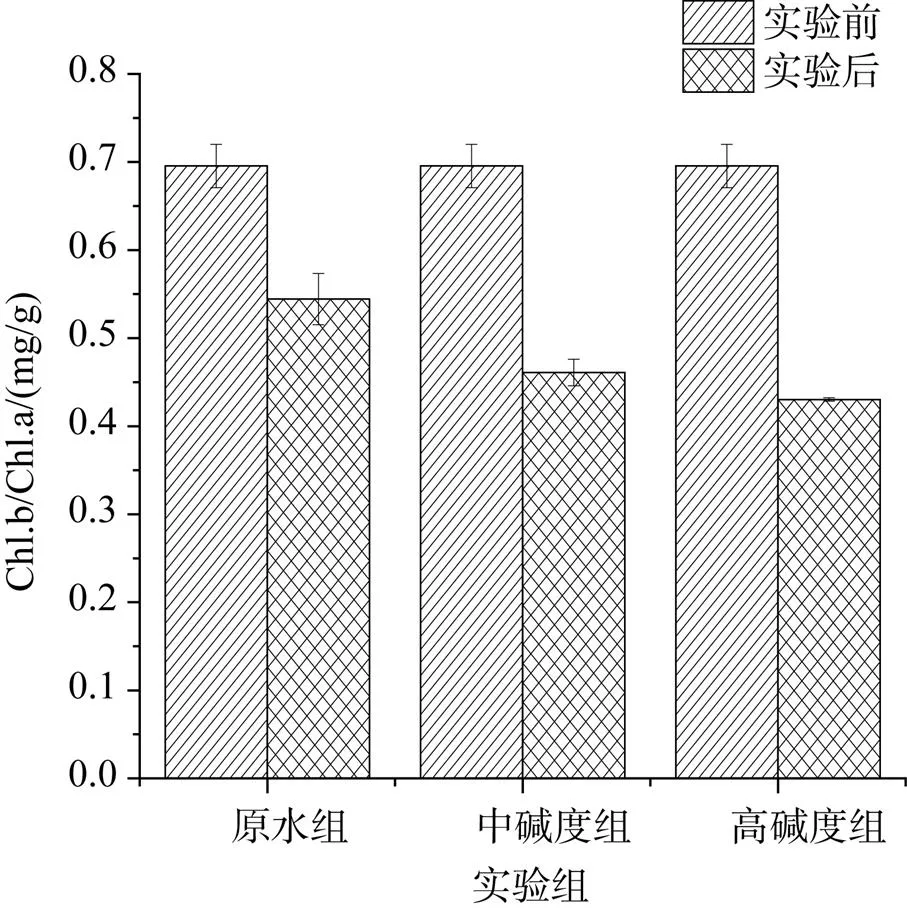
图6 不同碳酸氢钠浓度对Chl.b/Chl.a的影响

图7 不同碳酸氢钠浓度对Caro/TChl的影响
3.3 刚毛藻碳酸酐酶(CA)活性的变化
由图8可知, 实验第3天, 原水组和高碱度组碳酸酐酶活性较中碱度组要高, 高碱度组与中碱度组相比, 有显著差异性(<0.05); 实验结束时, 碳酸酐酶活性随碱度升高而降低, 高碱度组酶活性相对原水组降低了74.6%, 差异极显著(<0.01), 表明高碱度环境对碳酸酐酶活性影响较大。
4 讨论
4.1 碱度对刚毛藻pH、DO和生长的影响
影响pH值变化的因素主要是藻类的光合作用和呼吸作用, 光合作用强, 水体中CO2与HCO3–被利用引起pH值升高, 反之下降。张雪等研究[23]指出水体pH值的升高与藻类生长有关, 生长越好, pH值越高。大量研究表明, HCO3–同样能作为藻类吸收转化的重要无机碳源[24-25]。Chevalier 等[26]、刘明升等[27]也得到类似结论。

图8 不同碳酸氢钠浓度对碳酸酐酶活性的影响
由图1b可知: 实验前3天, 碳酸氢盐投加影响体系酸碱平衡, 进而影响水中CO2含量。高碱度组水中CO2浓度低, 藻没有适应以碳酸氢盐为碳源的水体环境, 光合产氧受影响, 因此第一天测得DO低于原水组。实验前期, 各实验组溶液中养分充足, 藻类生长迅速, 光合作用使DO含量升高, 第8天达到最大值; 实验后3天, DO含量下降, 除了藻类光合作用减弱, 更重要的原因是藻体死亡分解, 微生物活动加剧, 水中DO被迅速消耗。原水组在第4天后, DO就开始持续下降可能与溶液中氮磷营养不足有关, 而高碱度组DO始终处于最低则是因为碱度过高对藻类光合作用产生胁迫, 同时, 高碳酸氢盐浓度和藻类增殖引起的pH值升高对藻类生命活动产生的影响不容忽视。
藻体在实验前期对过高碱度环境需要一定适应时间, 光合作用较弱, 到了实验后期, 高碱度组相对其他两组具有更多的光合作用底物(HCO3–)供藻体利用。图1a显示, 高碱度组在实验末期pH值不断升高, 高达9.8左右, 且本研究在相同实验条件下测得高碱度组体系中碳酸盐碱度在整个实验周期不断上升, 且高于其他两组, 因此, 进一步表明高碱度组在实验后5天相对生长率高于其他两组与对HCO3–的利用程度有关。结合图1—图4可知, 从理论上讲, 碳酸氢盐浓度的升高会加强光合过程的碳固定、运转和碳水化合物的合成, 对藻类的生长和代谢起促进作用, 但是过高的碱度使藻生长受到抑制可能与用于生长的能量被消耗有关, 因为HCO3–的吸收需要消耗能量, 原本用于生长的光合产物被用来进行离子的吸收和运输[28]。
4.2 碱度对刚毛藻光合色素的影响
光合色素是客观反映植物光合生理能力和环境胁迫状况的重要指标[29]。叶绿素a含量变化一定程度上反映藻体合成有机物量的能力[30]。康丽娟等[31]指出叶绿素b是捕光色素蛋白复合体的重要组成部分, 其含量增加有利于增强叶绿体对光能的吸收,从而提高光合活性。
由图5可见, 高碱度组中藻类叶绿素a、叶绿素b和类胡萝卜素的合成受到抑制。一方面碱度过高会降低铁等元素的可利用性, 导致藻类因缺铁使叶绿素等合成受阻, 另一方面高碱逆境下叶绿素和叶绿体蛋白解离,促使叶绿素等色素分解,导致其含量降低[5,32]。此外, 碱度抑制藻类生长、伤害藻体细胞和减少类囊体[28]也可能导致叶绿素a含量降低。中碱度组叶绿素a含量较其他两组要高, 从碳源角度出发, 增加适宜浓度碳酸氢盐有助于促进藻体生长和光合作用, 进而影响光合色素合成。
结合图5和图2—图4可知, HCO3-浓度的增加不仅影响刚毛藻生长, 其与光合色素合成之间也有一定联系。Zhou等人[33]在研究海洋大型红藻时表明添加适量的碳酸氢盐可以加速合成光合色素和加快光合作用, 进而促进藻类的生长。蔡元妃等[34]也指出可以通过藻类膜上的叶绿素含量来表征藻类膜上的生物量。
研究发现, CO2浓度的加倍可以提高蛋白核小球藻类胡萝卜素含量[31], 类胡萝卜素除了起到光保护作用外, 可能还有碳库功能[31], 因此碱度增加不仅提高了碳源浓度, 而且可能有利于刚毛藻类胡萝卜素形成。Srinivasan等人[35]在研究杜氏盐藻时发现碳酸氢盐的浓度在100—150 mmol·L–1的范围内可以提高β-胡萝卜素和脂肪酸的含量。其中, β-胡萝卜素占类胡萝卜素总量的25%到35%。Ben-amotz等人[36]指出在高盐或者营养不足的环境中, 杜氏盐藻体内叶绿素含量会降低, 而类胡萝卜素含量升高, 两者呈反比。康丽娟等[31]指出, 碱度增加提高了蛋白核小球藻Chl.b/Chl.a的值, 降低其Caro/TChl的值, 结合本研究可进一步说明碱度可以作为藻类竞争的控制因素, 寡枝刚毛藻可能更适合本实验的中碱度环境。进一步结合图2—图7可知, 藻类的生长和光合效率不仅与光合色素含量有关, 光合色素的组成也起到不可忽视的作用, Xu等人[37]在研究壳斑藻时就证实了这一点。
4.3 刚毛藻碳酸酐酶(CA)活性的变化
前人总结表明[38], 碳酸酐酶在藻类固碳中起重要作用, 其活性受CO2浓度、光照和pH值等环境因素调控。由图1a可知, 各实验组pH基本都在9左右, 水体中几乎没有游离CO2, HCO3–是主要存在形态, 而寡枝刚毛藻能够正常生长说明其具有CO2浓缩机制, 可以直接利用HCO3–。实验第3天, 原水组和高碱度组碳酸酶活性较中碱度组要高, 与较低HCO3–浓度和较高pH值有关。原水组HCO3–浓度较低, 碳源供应不足, 诱导了碳酸酐酶表达, 这是藻体对低碳环境的响应; 高碱度组碳酸酐酶活性较高是过高HCO3–浓度使pH值升高导致[39]。中碱度组碳酸酐酶活性较低反应了藻体获得了较好的CO2供给, 藻体可以减少为了适应环境改变而生成新蛋白的能量消耗, 有利于生长。
实验结束时, 碳酸酐酶活性呈现下降趋势是因为过量HCO3–对刚毛藻生理状态产生了影响,致使刚毛藻光合活性降低, 消耗的可溶性无机碳减少[40], 也可能与长期在高碱环境下培养,细胞内富含碳酸酐酶的羧体数目比正常条件培养要少有关[41]。类似的, 王铭等[41]对雨生红球藻的研究发现高浓度HCO3–对碳酸酐酶活性有明显抑制作用。刘洪霞等[42]对球等鞭金藻的研究也得到相同的结果: 过碱环境中胞外碳酸酐酶活性和光合放氧降低。夏建荣[43]指出丝藻胞内碳酸酐酶活性随着培养液中CO2浓度的升高而降低。李小梅[44]研究发现CO2体积分数增加到更高的1%—5%会使部分绿藻碳酸酐酶活性受到抑制甚至丧失。张君枝[45]等人则表明在溶液中无机碳浓度受限时, 蓝藻较绿藻更易生长, 因其CO2浓缩机制更有效; 而当无机碳浓度升高时, 绿藻的繁殖能力更强。碳酸氢盐浓度升高会使绿藻在水体中优势扩大并引发水华, 进而降低浮游藻类多样性[46]。总结可知, 过碱环境对藻类碳酸酐酶的活性都会有不同程度的抑制, 只是, 刚毛藻相对水华蓝藻铜绿微囊藻而言, 能适应的碱度更高。高碱度环境对于大型丝状绿藻与水华蓝藻竞争的影响, 值得深入研究。
深入分析图8可知, 原水组和中碱度组在实验后期碳酸酐酶活性较前期要高, 可能是因为实验后期碳源供给较少, 碳酸酐酶活性被进一步诱导。综合图2—图4和图8, 从能量消耗和碳源供给角度分析, 原水组碳酸酐酶活性在实验前期和后期比中碱度组都要高, 表明藻体需要消耗更多能量生成酶蛋白, 不利于藻体生长; 高碱度组在实验后期碳酸酐酶活性过低, 跟中碱度组相比, 没有足够的碳源供给藻体进行光合作用, 生长受到抑制, 所以, 中碱度组所提供的碱度环境更适合刚毛藻生长。
5 结论
(1)刚毛藻对碳酸氢盐碳源有较强的利用能力,适宜浓度的碳酸氢盐能够促进刚毛藻生长。碳酸氢盐碱度的增加会抑制叶绿素合成而促进类胡萝卜素的形成, 提高刚毛藻的抗逆性。碳酸氢盐碱度的增加不仅影响光合色素的含量还与光合色素的组成有关。
(2)碳酸酐酶活性能够作为指示刚毛藻处于高碱逆境的指标。较低HCO3–浓度和较高的pH值都有可能促进碳酸酐酶的生成, 但随着长期高碱环境的胁迫, 碳酸酐酶活性降低。
[1] BREWER P G, GOLDMAN J C. Alkalinity changes generated by phytoplankton growth[J]. Limnology and Oceanography, 1976, 21(1): 108–117.
[2] LÓPEZARCHILLA A L, MOREIRA D, LÓPEZGARCIA P, et al. Phytoplankton diversity and cyanobacterial dominance in a hypereutrophi shallow lake with biologically produced alkaline pH[J]. Extremophiles, 2004, 8(2): 109–115.
[3] JONES J I, YOUNG J O, EATON J W, et al. The influence of nutrient loading dissolved inorganiccarbon and higher trophic level son the interaction between submerged plants and periphyton[J]. Journal of Ecology, 2002, 90(1): 12–24.
[4] 岳国峰, 王金霞, 朱明远, 等. 藻类无机碳营养的研究进展(Ⅱ)—藻类利用无机碳的机理及其调节[J]. 海洋科学, 2003, 27(6): 31–34.
[5] 康丽娟, 潘晓洁, 常锋毅, 李敦海, 沈银武, 刘永定. HCO3-碱度对铜绿微囊藻生长与光合活性的影响[J]. 长江流域资源与环境, 2008, (05): 775–779.
[6] 戴树桂. 环境化学[M]. 北京: 高等教育出版社, 2006, 25(2): 206–206.
[7] 蒋春云, 马秀灵, 沈晓艳, 等. 植物碳酸酐酶的研究进展[J]. 植物生理学报, 2013, 49(6): 545–550.
[8] 张其德. 大气二氧化碳浓度升高对光合作用的影响(下)[J]. 植物杂志, 1999(4): 32–34.
[9] ROBERT G, EGAN L, KEITH C, et al. Cellular cycling, carbon utilization, and photosynthetic oxygen production during bicarbonate-induced triacylglycerol accumulation in asp[J]. Energies, 2013, 6(11): 6060–6076.
[10] ANKITA J, RUBEN C, GANTI M. Effects of environmental factors and nutrient availability on the biochemical composition of algae for biofuels production: a review[J]. Energies, 2013, 6(9): 4607–4638.
[11] PENG Xiaowei, LIU Shuo, ZHANG Wei, et al. Triacylglycerol accumulation ofwith different supply of inorganic carbon[J]. Journal of Applied Phycology, 2014, 26(1): 131–139.
[12] WHITE D A, PAGARETTE A, ROOKS P, et al. The effect of sodium bicarbonate supplementation on growth and biochemical composition of marine microalgae cultures[J]. Journal of Applied Phycology, 2013, 25(1): 153–165.
[13] 雷国元. 大型丝状绿藻去除氮磷和抑制微藻的特性及其作用机制[D]. 哈尔滨: 哈尔滨工业大学, 2009: 36–43.
[14] 马沛明. 利用着生藻类去除N、P营养物质的研究[D]. 武汉: 中国科学院水生生物研究所, 2005: 38–49.
[15] 凡传明. 大型丝状藻类修复水体富营养化的潜能研究[D].湖南: 湖南大学, 2011: 31–36.
[16] 黄新苹, 朱校斌, 刘建国, 等. 几种海藻富集 N、P净化水质的研究[J]. 海洋科学, 2004, 28(12): 39–42.
[17] 凌晓欢. 梁子湖底栖藻类初级生产力及刚毛藻水处理效果研究[D]. 北京: 中国科学院研究生院, 2007.
[18] SCOTT N H, CHRISTOPHER M P, TODD H E, et al. Urban influences on cladophora blooms in Lake Ontario[J]. Journal of Great Lakes Research, 2012, 38(4): 116–123.
[19] 高兵兵, 郑春芳, 徐军田, 等. 缘管浒苔和浒苔对海水盐度胁迫的生理响应[J]. 应用生态学报, 2012, 23(7): 1913– 1920.
[20] 王学奎. 植物生理生化实验原理和技术(第2版)[M]. 北京: 高等教育出版社, 2006: 134–136.
[21] 吴沿友, 李西腾, 郝建朝, 等. 不同植物的碳酸酐酶活力差异研究[J]. 广西植物, 2006, 26(4): 366–369.
[22] WIBUR K M, ANDERSON N G. Electrometric and colorimetric determination of carbonic anhydrase[J]. Journal of Biological Chemistry, 1948, 176(1): 147–154.
[23] 张雪, 周洵, 李琴, 等. 太湖原水pH值季节性变化规律及突变成因探索[J]. 供水技术, 2015, 9(5): 13–17.
[24] JONES J I, YOUNG J O, EATON J W, et al. The influence of nutrient loading, dissolved inorganic carbon and higher trophic levels on the interaction between submerged plants and periphyton[J]. Journal of Ecology, 2002, 90(1): 12–24.
[25] 岳国峰, 王金霞, 朱明远, 等. 藻类无机碳营养的研究进展(Ⅱ)—藻类利用无机碳的机理及其调节[J]. 海洋科学, 2003, 27(6): 31–34.
[26] CHEVALIER P, PROULX D, LESSARD P, et al. Nitrogen and phosphorus removal by high latitude mat-forming cyanobacteria for potential use in tertiary wastewater treatment[J]. Journal of Applied Phycology, 2000, 12(2): 105–112.
[27] 刘明升, 魏群, 蔡元妃, 等. 六种微藻固定CO2实验研究[J]. 广西大学学报: 自然科学版, 2012, 37(3): 544– 548.
[28] 康丽娟, 潘晓洁, 常锋毅, 等. HCO3-碱度增加对铜绿微囊藻光合活性和超微结构的影响[J]. 武汉植物学研究, 2008, 26(1): 70–75.
[29] 王莉, 唐丽雅, 魏晨曦, 等. 邻苯二甲酸二(2-乙基)己酯对斜生栅藻的生态毒性作用[J]. 生态毒理学报, 2009, 4(3): 452–456.
[30] 吴运东, 吴沿友, 李潜, 等. pH与氟对莱茵衣藻和蛋白核小球藻胞外碳酸酐酶活性及光合效率的影响[J]. 农业环境科学学报, 2011, 30(10): 1972–1977.
[31] 康丽娟, 潘晓洁, 常锋毅, 等. 碱度增加对蛋白核小球藻光合活性与胞外多糖的影响[J]. 湖泊科学, 2008, 20(2): 251–256.
[32] 李小伟, 么宗利, 周凯, 等. 高HCO3-浓度对细基江蓠繁枝变型生长及生理生化特征的影响[J]. 中国水产科学, 2013, 20(4): 843–850.
[33] ZHOU W, SUI Z, WANG J, et al. Effects of sodium bicarbonate concentration on growth, photosynthesis, and carbonic anhydrase activity of macroalgae,, and(Gracilariales, Rhodophyta)[J]. Photosynthesis Research, 2016, 128(3): 259.
[34] 蔡元妃, 魏群, 郭莉娜, 等. 六种藻类膜脱氮除磷的实验研究[J]. 广西大学学报: 自然科学版, 2013, 38(3): 668– 672.
[35] SRINIVASAN R, KUMAR VA, KUMAR D, et al. Effect of dissolved inorganic carbon on β-Carotene and fatty acid production insp[J]. Applied Biochemistry & Biotechnology, 2015, 175(6): 2895–2906.
[36] BEN-AMOTZ A, AVRON M. On the factors which determine massive b-carotene accumulation in the halotolerant alga[J]. Plant Physiology, 1983, 72(3): 593–597.
[37] XU D, QIAO HJ, ZHU JY, et al. Assessment of photosynthetic performance ofUeda (Bangiales, Rhodophyta)in conchocelis phase[J]. Journal of Phycology, 2012, 48(2): 467–470.
[38] 黄瑾, 夏建荣, 邹定辉. 微藻碳酸酐酶的特性及其环境调控[J]. 植物生理学报, 2010, 46(7): 631–636.
[39] 王山杉, 刘永定, 邹永东, 等. 微囊藻碳酸酐酶活性在不同环境因素下的调节与适应[J]. 生态学报, 2006, 26(8): 2443–2448.
[40] WU T F, SONG L R, LIU Y D. An inducible CO2concentrating mechanism in cyanobacteriumsp. strain PCC7120[J]. Chinese Science Bulletin, 1999, 44(23): 2177–2181.
[41] 王铭, 桑敏, 李爱芬, 等. 不同理化因子对雨生红球藻CG-11碳酸酐酶活性的影响[J]. 植物生理学通讯, 2010, 46(7): 701–706.
[42] 刘红霞, 孙颖颖, 王长海. pH和氮素对球等鞭金藻胞外碳酸酐酶活性的影响[J]. 烟台大学学报: 自然科学与工程版, 2008, 21(4): 286–290.
[43] 夏建荣, 高坤山. 丝藻光合作用无机碳利用研究[J]. 植物科学学报, 2002, 20(5): 399–402.
[44] 李小梅. 氮磷比与光、二氧化碳对三角褐指藻光合无机碳利用的交互作用[D]. 广州大学, 2012.
[45] 张君枝, 王齐, 马文林, 等. 水体无机碳升高对蓝绿藻生长和种群竞争的影响研究进展[J]. 生态环境学报, 2015(7): 1245–1252.
[46] 孙凌, 阚元卿, 张冬梅, 等. 无机碳对浮游藻类生长和群落结构的影响[J]. 环境污染与防治, 2007, 29(5): 352–356.
Effects ofsodium bicarbonatesupplementationon photosynthetic pigment and carbonic anhydrase activityof
MA Shujuan1, 2, SUN Liping1,2,*, ZHONG Yuan1,2, QIU Chunsheng1,2, WANG Chenchen1,2, WANG Shaopo1,2
1. School of Environmental and Municipal Engineering, Tianjin Chengjian University, Tianjin 300384, China 2. Tianjin Key Laboratory of Aquatic Science and Technology, Tianjin 300384, China
The effect of sodium bicarbonate supplementation on growth and physiological and biochemical characteristicsofwas studied.The results showed that the wet weight ofincreased by 47.57% within 12 daysin comparison to the control group,when theinitialNaHCO3concentration was11.7mmol.L-1. The high ability ofto utilize sodium bicarbonate has been indicated. Compared with the control group, chlorophyll b/chlorophyll a (Chl.b/Chl.a)ofin the experimental groups was decreased,whilecarotenoid/chlorophyll (Caro/TChl) was increased.At the end of theexperiment, thecarbonic anhydrase activityofin high NaHCO3concentrationgroup wasreducedby 74.6 % compared with the control group.
; alkalinity; photosynthetic pigments; carbonic anhydrase activity
10.14108/j.cnki.1008-8873.2018.06.015
X52
A
1008-8873(2018)06-114-08
2017-11-16;
2018-03-23
城市河道水体净化与生态修复技术研究(14ZCDGSF00031); 国家科技重大水专项(2012ZX07308-002)
马淑娟(1989—)女, 硕士研究生, 主要从事污水治理及其资源化研究, Email: 571374791@qq.com
孙力平, 女, 教授, 主要从事污水治理及其资源化研究, E-mail: slpyqs@vip.sina.com
马淑娟, 孙力平, 钟远, 等. 碳酸氢盐投加对寡枝刚毛藻光合色素及碳酸酐酶活性的影响研究[J]. 生态科学, 2018, 37(6): 114-121.
MA Shujuan, SUN Liping, ZHONG Yuan, et al. Effects of sodium bicarbonate supplementation on photosynthetic pigment and carbonic anhydrase activity of[J]. Ecological Science, 2018, 37(6): 114-121.

