光照强度和磷浓度对寡枝刚毛藻生长的影响
郭亮亮,周维成,周起超,李根保(1.中国科学院水生生物研究所,淡水生态与生物技术重点实验室,湖北武汉 40072;2.中国科学院大学,北京 100049;.云南省环境科学研究院,高原湖泊流域污染过程与管理云南省重点实验室,云南 昆明 65004)
光照强度和磷浓度对寡枝刚毛藻生长的影响
郭亮亮1,2,周维成1,2,周起超3,李根保1*(1.中国科学院水生生物研究所,淡水生态与生物技术重点实验室,湖北武汉 430072;2.中国科学院大学,北京 100049;3.云南省环境科学研究院,高原湖泊流域污染过程与管理云南省重点实验室,云南 昆明 650034)
在利用沉水植被对湖泊进行生态修复过程中,当营养盐有所降低,水体透明度增加有利于沉水植物生长时,丝状绿藻——刚毛藻会大量生长,从而影响生态修复效果.为了研究光照强度和磷浓度对寡枝刚毛藻(Cladophora oligoclona)生长的影响,本实验用含有不同磷浓度(0.005,0.02,0.1,0.6mg/L)的BBM培养基,在不同光照强度[10,30,50μmol/(m2·s)]下培养寡枝刚毛藻16d.结果发现,在光照强度为10μmol/(m2·s),初始 P浓度 0.1mg/L以上时,刚毛藻鲜重增加(约 0.05g),其余处理条件下,刚毛藻鲜重均减少,其中光强为 50μmol/(m2·s),初始磷浓度为0.005mg/L时,刚毛藻鲜重减少量最大(约0.49g).叶绿素荧光参数Fv/Fm值的变化表现为光强越大,Fv/Fm的值越低.在光强为10μmol/(m2·s)时,Fv/Fm值在0.75左右.光强为50μmol/(m2·s)时,Fv/Fm值仅为0.3.在相同光强下,不同磷浓度对Fv/Fm值变化无显著影响.相对于磷浓度对刚毛藻生长的影响,光强对刚毛藻的生长影响更大,且高光强不利于刚毛藻的生长.
寡枝刚毛藻;光照强度;磷浓度;叶绿素活性
刚毛藻(Cladophora)是一种丝状绿藻,在全球范围内的淡水水体和咸水水体中均有分布[1-4]. 在20世纪60~80年代,北美五大湖多次暴发刚毛藻水华,不仅影响人们的娱乐用水和工业取水,而且刚毛藻腐烂时还会产生臭味,给人们的生产和生活造成不便[5-6].早期研究认为,刚毛藻的大量生长与磷(P)相关.为控制刚毛藻水华,五大湖进行磷消减,20世纪 80年代早期到 90年代中期,刚毛藻生物量有所减少,刚毛藻水华消失[7].但是随着P消除项目的进行和贻贝的入侵,五大湖的水体透明度有所增加[8-9],刚毛藻水华又再次暴发[2,10-11].这些研究表明,影响刚毛藻生长的因子并非只有磷.
在生态修复实践中,也会遇到上述类似的问题.当水体的生态修复达到一定效果时,水体透明度增加,随之丝状绿藻(如刚毛藻)大量生长,影响水生植被的建群,从而破坏生态修复的效果[12].在一些寡营养的湖泊如抚仙湖,其近岸带水域透明度较高的基底上仍可以看到大量刚毛藻生长.这表明光照对刚毛藻的生长也有重要的作用,但少见有关的研究报道.结合上述的研究,本文作者推测刚毛藻的大量生长可能受到营养元素磷和光照的双重影响.在本课题组对滇池刚毛藻已有研究的基础上[4],选择滇池的优势种-寡枝刚毛藻(C. oligoclona)为研究对象,在室内条件下研究了不同光照和不同磷浓度下刚毛藻的生理特性,探讨刚毛藻大量生长所需的外在条件,以期为控制刚毛藻水华提供数据支撑.
1 材料与方法
1.1实验材料
实验所用刚毛藻为寡枝刚毛藻(C. oligoclona).采样地点位于中国科学院水生生物研究所“十一五”水专项草海生态修复工程示范区(24°58′43.36″N,102°37′58.37″E).刚毛藻采回后,用自来水冲洗若干遍,直至把附着在其表面的泥沙、杂质洗去.
1.2实验处理
将洗好的刚毛藻放入自来水中培养2d,使实验所用刚毛藻的生长状态尽量保持一致.2d后,取出刚毛藻,用蒸馏水冲洗3遍,分装在6个1L的三角瓶中,培养液为不含磷元素的 BBM培养液[13-14],并用0.02mol/L的KCl溶液调整K+浓度.培养液不含磷元素的目的是让用于实验的刚毛藻处于磷饥饿状态.培养光强为25μmol/(m2·s),光暗周期比为12h:12h,温度为25℃,预培养时间为3d.
将预培养过后的刚毛藻用蒸馏水冲洗 3遍,分装入250mL三角瓶,每个三角瓶含有不同磷浓度的BBM培养液180mL.根据湖泊生产力与氮磷浓度的相关关系[15],设置4个P浓度梯度(0.005,0.02,0.1,0.6mg/L),3个光照强度[10,30,50μmol/ (m2·s)],培养温度为 25℃,设置光暗周期比为16h:8h,实验共进行了 12个处理.此外,所有三角瓶中放入刚毛藻的初始鲜重为(2+0.03)g,这种情况下,刚毛藻可以松散的充满整个培养液.每个处理设2个平行,每个平行每次至少监测2次.
监测指标为刚毛藻的叶绿素活性,鲜重,培养液中可溶性正磷酸盐和可溶性总磷浓度的变化.叶绿素荧光的监测采用 Water—Pam(WALZ,德国).刚毛藻的鲜重的获得方式为先用吸水纸吸取刚毛藻表面的水分,之后把刚毛藻放在两张吸水纸之间,均匀按压(尽量保持所有样品按压的力度相同),最后称重[5].本实验只称取实验开始和实验结束时刚毛藻的鲜重,以保证实验期间刚毛藻叶绿素活性以及培养液中磷浓度变化的测定不受影响.培养液中磷浓度测定参照 GB 11893-89[16].
1.3数据分析
利用 origin对快速光响应曲线(Rapid Light Curves,RLC)进行拟合,采用公式 rETR=PAR/ (a*PAR2+b*PAR+c)[17]式中:rETR表示相对电子传递速率; PAR表示有效光合辐射,单位 μmol/ (m2·s);a、b、c为参数.
图形和数据处理所用软件分别为Origin 8.0 和SPSS 16.
2 结果与讨论
2.1实验期间刚毛藻表观状态变化
培养期间,在光强相同,P浓度不同的处理下,刚毛藻表观状态没有观察到明显的差别.但是,在P浓度相同的处理下,光强不同刚毛藻表观状态差别较大.在10μmol/(m2·s)光强下,刚毛藻呈现出生长状态,颜色鲜绿;在 50μmol/(m2·s)光强下,大部分刚毛藻颜色偏黄绿色,刚毛藻由松散的充满整个培养液变为群体主要集中在培养液上部(表1).

表1 不同光照条件下刚毛藻及培养液的表观变化Table 1 The appearance change of C. oligoclona and culture solution under different light intensities
在野外条件下,生长状态良好的刚毛藻是绿色的,当条件不适合生长时,刚毛藻开始自身分解,以漂浮态聚集在水体表层,形成“藻垫”,并继续腐烂分解[18-19].实验现象表明,在50μmol/(m2·s)光强下,刚毛藻的生长受到限制.
2.2刚毛藻鲜重的变化
在不同光照强度和不同初始P浓度下,刚毛藻鲜重变化量是不同的.从图1可以看出,在实验期间,只有在低光强[10μmol/(m2·s)]条件下,磷浓度为0.1mg/L和0.6mg/L时,刚毛藻呈现增长趋势,增重为0.05g左右,其余处理条件下刚毛藻的鲜重均有不同程度减少.在设计的3个光强条件下,刚毛藻在低初始磷浓度(0.005mg/L)下的鲜重减少量最为明显,且随光强的增强,减少量增大(图 1).在高光强[50μmol/(m2·s)],初始 P浓度为0.005mg/L条件下,刚毛藻的鲜重减少是最大,约0.49g.低光强下,对刚毛藻鲜重变化做双因素方差分析,结果显示,初始P浓度和光强对刚毛藻的鲜重变化都有影响,且二者存在交互作用(P<0.05).
有文献记载,野外条件下,刚毛藻可以生长的营养范围是非常大的,在SRP为1.1~150μg/L的范围内刚毛藻均可生长[20-21].在本实验中,低光强,低P浓度下刚毛藻的鲜重是减少的,高P浓度下刚毛藻的鲜重是增加的(P<0.05),而中、高光强,4 种P浓度条件下,刚毛藻的鲜重均减少,且在初始P浓度为0.005mg/L时,减少量是最大的.说明低磷条件下,刚毛藻的生长受到限制.20世纪80年代中期直至贻贝生长起来之前,在北美五大湖实行的 P消除项目也是刚毛藻得到控制的最主要原因[7,22],并且这是目前可行的解决刚毛藻水华问题的方法[23].而本实验的结果也说明了控P对减少刚毛藻生物量的有效性.但是在中光强和高光强下,刚毛藻的鲜重减少,并且与初始 P浓度没有显著相关性(P>0.05).表明相对于初始 P浓度的影响,此时光强对刚毛藻鲜重变化的影响更大,这可能是高光照引起刚毛藻的分解,使得培养液中的P浓度发生变化,因而P浓度不再是限制刚毛藻生长的原因.而由于高光强下,刚毛藻光合活性降低,影响刚毛藻对培养液中磷元素的吸收,使得 50μmol/(m2·s)光强下刚毛藻的鲜重减少量大于30μmol/(m2·s)光强下的鲜重减少量.
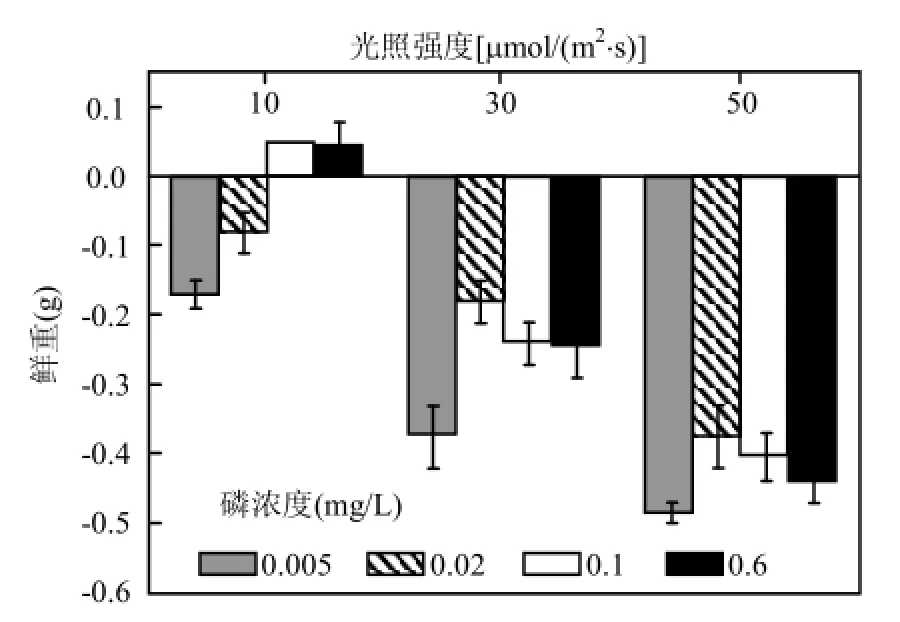
图1 实验期间刚毛藻鲜重的变化Fig.1 The change in fresh weight of C. oligoclona during the experiment
同时,在实验设计光强下,刚毛藻表现出对低光的适应,即刚毛藻可在低光下生长.而低光强下,P浓度满足生长时,刚毛藻的鲜重增加.这很好地解释了水体透明度增加,长在水体深处的刚毛藻就开始大量生长这一现象[11,24].
2.3不同处理下的刚毛藻叶绿素荧光特性
从图2可以看出,在不同光强下刚毛藻的叶绿素荧光展现出不同的特性.在低光强下,刚毛藻的Fv/Fm值保持在相对稳定的状态,其值在0.75左右;中光强下,刚毛藻的 Fv/Fm值均有所下降;高光强下,在实验第12d刚毛藻的Fv/Fm值有明显下降,实验结束时,其值仅为0.3左右.并且,数据分析显示刚毛藻叶绿素荧光的变化趋势只与光照强度有关(P<0.05),并不受初始磷浓度的影响(P>0.05).
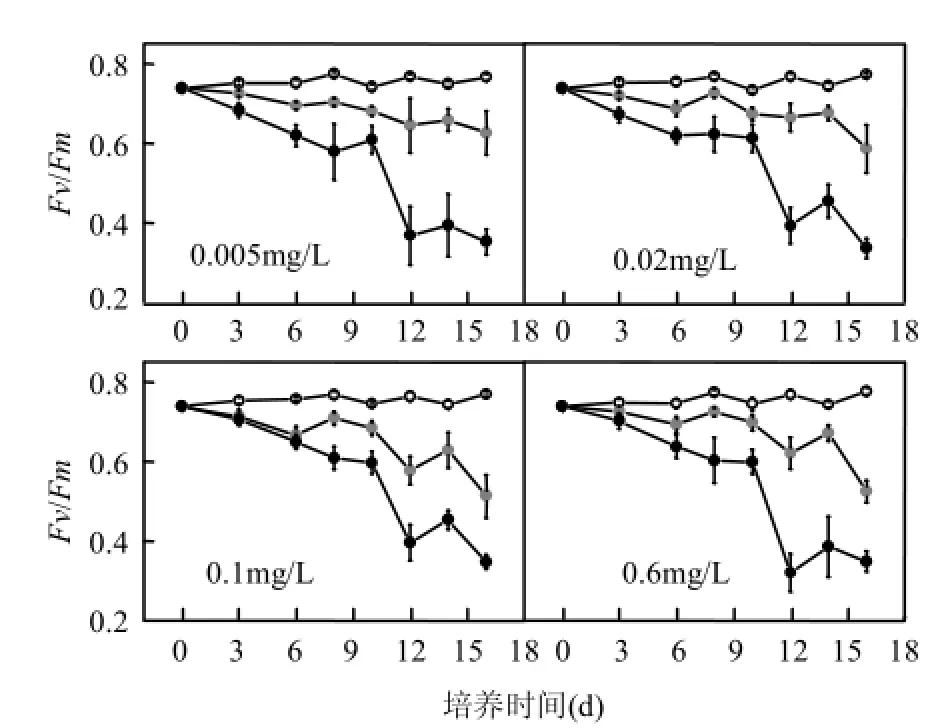
图2 不同处理下刚毛藻最大光量子产量随时间的变化Fig.2 The change in maximum quantum yield of C.oligoclona over time under different conditions

实验结束时,分析了各处理条件下刚毛藻的快速光响应曲线变化,拟合结果如图 3(R2>0.95).从图中可以看出,低光强下,刚毛藻藻细胞的相对电子速率(rETR)随有效光合辐射(PAR)增加的幅度大于中光强下的 rETR,中光强下的大于高光强下的 rETR.且在高光强下,初始磷浓度为0.005mg/L和0.1mg/L时,刚毛藻藻细胞的相对电子传递速率在有效光辐射为738μmol/(m2·s)时有所下降.
表2显示的是培养期间,不同光照强度下,刚毛藻快速光响应曲线中初始斜率(α)在低、中光强下,快速光响应曲线的斜率均在0.2左右,而在高光强下,曲线的斜率仅为 0.164.表明在低光强下,刚毛藻的光能利用率大于高光强下的光能利用率(P<0.05),且随时间的延长,中、高光强处理下的光能利用率均有所下降.但是,不同的初始 P浓度不能影响刚毛藻光能利用率的变化(P>0.05).

图3 实验结束时不同条件下刚毛藻的快速光响应曲线Fig.3 The RLC of C. oligoclona under different conditions


表2 各光强处理下快速光响应曲线初始斜率变化(mean±SD)Table 2 The effects of different light intensities on the initial slope of rapid light curve (mean±SD)
Fv/Fm的值可以反映光合系统Ⅱ(PSⅡ)的活性,从而可以间接的反映出外界胁迫对PSⅡ的影响.正常情况下,Fv/Fm能保持相对稳定,当Fv/Fm值明显下降时,表示植物受到了外界环境的胁迫.实验结果显示,刚毛藻 PSⅡ的最大量子产量随着光强的增大而降低(P<0.05),RLC曲线中的 rETR也随着光强的升高而下降,以及随着培养时间的延长,中、高光强下刚毛藻的光能利用率(α)降低.这些结果表明刚毛藻的 PSⅡ受到了光强的胁迫.高光强下,刚毛藻的光合能力下降,藻细胞的相对电子传递速率受到阻碍,影响量子产量,进而影响刚毛藻进行物质合成的光合作用.而当刚毛藻利用光合作用合成的物质少于由于呼吸作用消耗的物质时,刚毛藻就会分解自身原有的物质,引起鲜重减少,而这一结果会导致刚毛藻的光合活性有很大降低[25].
虽然刚毛藻对光强的胁迫有一定的耐受性,但是,随着胁迫的持续,刚毛藻的光合系统最终受到不可逆损伤,光合活性下降,表现为高光强下,刚毛藻的Fv/Fm值在第12d有明显的下降.而在野外条件下,刚毛藻可以生长的光照强度能达到600μmol/(m2·s)[26],出现这种差别,可能是因为在野外条件下,一天中的光强是不断变化的,刚毛藻对高光强有一定的耐受能力[27],短时间的高光强不会影响其生长.同时,水下实际的光照强度不会达到很高的强度也是原因之一.
2.4刚毛藻培养液中磷浓度的变化
实验中监测了实验开始和结束时的培养液中可溶性磷酸盐(SRP)和可溶性总磷(TDP)的含量.

图4 不同处理下培养液中SRP浓度变化Fig.4 The change in SRP concentration of culture solution under different treatments
由图 4可知,在低、中光强,初始P浓度为0.005mg/L,以及高光强下的四种磷浓度,刚毛藻的培养液中SRP值增加.其余处理下培养液中的SRP值均降低.对SRP值做相关性分析,结果显示SRP值与初始P浓度无相关性(P>0.05),与光照强度有极显著相关性(P<0.01).
由图 5中可知,只有在低光强,P浓度为0.1mg/L和0.6mg/L条件下,以及中光强,P浓度为0.6mg/L条件下,培养液中的DTP是小于初始值的.其余处理下,DTP值均增加.和SRP值变化情况相同,刚毛藻培养液中DTP值变化与光照强度和初始P浓度有显著相关性(P<0.01).
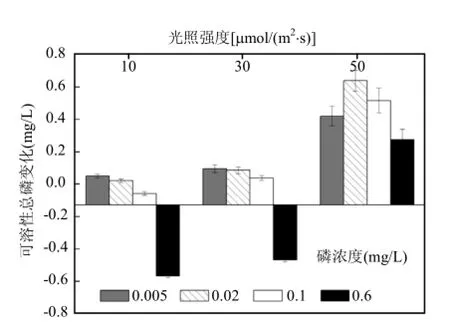
图5 不同处理下培养液中DTP浓度变化Fig.5 The change in DTP concentration of culture solution under different treatments
植物腐烂分解会不同程度的增加系统中的营养[28].实验结束后,各处理下培养液中 SRP值的变化,结合刚毛藻鲜重减少可以得出,在30μmol/(m2·s)光强下,部分刚毛藻分解释放磷元素,可能是由于分解量的限制,其中的可溶解性正磷酸盐含量很少.而在光强为50μmol/(m2·s)时,有部分刚毛藻分解,同时,可能由于高光强影响了刚毛藻的光合活性,进而影响了刚毛藻对培养液中磷元素的吸收,使得培养液中的SRP值高于初始值.而 DTP含量变化知,在 10μmol/(m2·s)光强,P浓度为0.1mg/L和0.6mg/L条件下,培养液中的DTP值小于初始值,是由于刚毛藻鲜重增加,吸收的P元素大于释放的P元素.而在30μmol/(m2·s)光强,P浓度为0.6mg/L条件下,培养液中的DTP值小于初始值,是由于刚毛藻维持自身生长吸收培养液中添加的P元素,而小部分刚毛藻分解又向培养液中释放了P元素,但是释放量小于吸收量.其它初始P浓度条件下,DTP值均大于初始值,表明部分刚毛藻分解后增加了培养液中的 DTP含量.在光强为50μmol/(m2·s)时,由于部分刚毛藻分解以及高光强可能限制刚毛藻对培养液中磷元素的吸收,使得培养液中DTP值增加.
刚毛藻可以吸收利用水体中的营养盐[29-30],但是,刚毛藻腐烂分解时会增加水体中的营养盐,这不利于湖泊富营养化的治理.因此,在利用刚毛藻治理富营养化水体时,要考虑刚毛藻的生长和分解对水体环境的影响.
3 结论
3.1实验结果表明,刚毛藻的生长受光照强度和P浓度的影响.但相对于 P浓度变化对刚毛藻生长的影响,光强的改变对刚毛藻生长的影响更大.
3.2在较低的光强[10μmol/(m2·s)]下,刚毛藻的生物量增长受到P的限制.结果暗示,在进行生态修复时,当水体透明度增加时,要注意观察刚毛藻的生物量变化,以便及时采取物理或化学方法将其除掉.
[1] Higgins S N,Hecky R E,Guildford S J. The collapse of benthic macroalgal blooms in response to self-shading [J]. Freshwater Biology,2008a,53(12):2557-2572.
[2] Higgins S N,Malkin S Y,Howell E T,et al. An ecological review of Cladophora glomerata(Chlorophyta) in the Laurentian Great Lakes [J]. Journal of Phycology,2008b,44(4):839-854.
[3] Sheath R G,Cole K M. Biogeography of stream macroalgae in North-America [J]. Journal of Phycology,1992,28(4):448-460.
[4] 杨凯,董静,郭亮亮,等.滇池岩岸带刚毛藻种群结构及分布特征 [J]. 水生态学杂志,2013,34(3):8-16.
[5] Higgins S N,Pennuto C M,Howell E T,et al. Urban influences on Cladophora blooms in Lake Ontario [J]. Journal of Great Lakes Research,2012,38(4):116-123.
[6] Verthouqstraete M P,Byappanahalli M N,Rose J B,et al. Cladophora in the Great Lakes:impacts on beach water quality and human health [J]. Water Science and Technology,2010,62(1):68-76.
[7] Painter D S,Kamaitis G. Reduction of Cladophora biomass and tissue phosphorus in Lake-Ontario,1972-83 [J]. Canadian Journal of Fish Aquatic Sciences,1987,44(12):2212-2215.
[8] Barbiero R P,Rockwell D C,Warren G J,et al. Changes in spring phytoplankton communities and nutrient dynamics in the eastern basin of Lake Erie since the invasion of Dreissena spp [J]. Canadian Journal of Fish Aquatic Sciences,2006,63(7):1549-63.
[9] Howell E T,Marvin C H,Bilyea R W,et al. Changes in environmental conditions during Dreissena colonization of a monitoring station in eastern Lake Erie [J]. Journal of Great Lakes Research,1996,22(3):744-756.
[10] Higgins S N,Hecky R E,Guildford S J. Environmental controls of Cladophora growth dynamics in eastern Lake Erie: application of the Cladophora growth model (CGM) [J]. Journal of Great Lakes Research,2006,32(3):629-644.
[11] Malkin S Y,Guildford S J,Hecky R E. Modeling the growth response of Cladophora in a Laurentian Great Lake to the exotic invader Dreissena and to lake warming [J]. Limnology and Oceanography,2008,53(3):1111-1124.
[12] 李敦海,史龙新,李根保,等.丝状绿藻腐烂过程对水质和沉水植物黑藻生长的影响实验研究 [J]. 环境科学与管理,2006,31(6):27-30.
[13] Bischoff H W,Bold H C. Phycological studies. IV. Some soil algae from Enchanted Rock and related algal species [M]. University of Texas Publications,1963,6318:1-95.
[14] Deason T R,Bold H C. Phycological Studies [M]. Austin:Univisity of Texas,1960.
[15] 刘光钊(澳).水体富营养及其藻害 [M]. 北京:中国环境科学出版社,2005:216-217.
[16] 国家环保总局.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社,2002.
[17] Eilers P H,Peeters J C.A model for the relationship between light intensity and the rate of photosynthesis in phytoplankton [J]. Ecological Modelling,1988,42(3/4):199-215.
[18] O`lafsson E B. Inhibition of larval settlement to a soft bottom benthic community by drifting algal mats: an experimental test [J]. Marine Biology,1988,97(4):571-574.
[19] O`lafsson E.,K. Aarnio,E. Bonsdorff,et al. Fauna of the green alga Cladophora glomerata in the Baltic Sea: Density,diversity,and algal decomposition stage [J]. Marine Biology,2013,160(9):2353-2362.
[20] Marks J C,Power M E. Nutrient induced changes in the species composition of epiphytes on Cladophora glomerata Kutz. (Chlorophyta) [J]. Hydrobiologia,2001,450(1-3):187-196.
[21] Stevenson R. J,Stoermer E F. Abundance patterns of diatoms on Cladophora in Lake Huron with respect to a point source of wastewater treatment plant effluent [J]. Journal of Great Lakes Research,1982b,8(1):184-195.
[22] Auer M T,Tomlinson L M,Higgins S N,et al. Great LakesCladophora in the 21 st century: same algae-different ecosystem [J]. Journal of Great Lakes Research,2010,36(2):248-255.
[23] Colin Brooks,Amanda Grimm,Robert Shuchman,et al. A satellite-based multi-temporal assessment of the extent of nuisance Cladophora and related submerged aquatic vegetation for the Laurentian Great Lakes [J]. Remote Sensing of Environment,2014,157:58-71.
[24] Higgins S N,Hecky R E,Guildford S J. Modeling the growth,biomass,and of Cladophora glomerata tissue phosphorus concentration in eastern Lake Erie: model description and field testing [J]. Journal of Great Lakes Research,2005a,31(4):439-455.
[25] Paalme T,Kukk H,Kotta J,et al. In vitro and in situ decomposition of nuisance macroalgae Cladophora glomerata and Pilayella littoralis [J]. Hydrobiologia,2002,475(1):469-476.
[26] Parr L B,Perkins R G,Mason C F. Reduction in photosynthetic efficiency of Cladophora glomerata,induced by overlying canopies of Lemna spp [J]. Water Research,2002,36(7):1735-1742.
[27] Choo K S,Snoeijs P,Pedersen M. Oxidative stress tolerance in the filamentous green algae Cladophora glomerata and Enteromorpha ahlneriana [J]. Journal of Experimental Marine Biology and Ecology,2004,298(1):111-123.
[28] 唐金燕,曹培培,徐驰,等.水生植物腐烂分解对水质的影响[J]. 应用生态学报,2013,24(1):83-89.
[29] 况琪军,马沛明,刘国祥,等.大型丝状绿藻对N、P去除效果研究[J]. 水生生物学报,2004,28(3):323-326.
[30] 况琪军,凌晓欢,马沛明,等.着生刚毛藻处理富营养化湖泊水[J]. 武汉大学学报,2007,53(2):213-218.
Effects of light intensity and phosphorus concentration on the growth of Cladophora oligoclona.
GUO Liang-liang1,2,ZHOU Wei-cheng1,2,ZHOU Qi-chao3,LI Gen-bao1(1.State Key Laboratory of Freshwater Ecology and Biotechnology,Institute of Hydrobiology,Chinese Academy of Sciences,Wuhan 430072,China;2.University of Chinese Academy of Sciences,Beijing 100049,China;3.Yunnan Key Laboratory of Pollution Process and Management of Plateau Lake- watershed,Yunnan Institute of Environmental Science,Kunming 650034,China).
China Environmental Science,2015,35(7):2153~2159
In the process of ecological restoration using submerged vegetation,green filamentous algae Cladophora will be blooming with decreased nutrients and increased water transparency. To determine the effects of light intensity and phosphorus concentration on growth of C.oligoclona,the growth and photosynthetic activity of C. oligoclona cultured in BBM medium at different concentrations of phosphorus (0.005,0.02,0.1,0.6mg/L) and light intensities [10,30,50μmol/(m2·s)] for 16 days was examined. The results showed that at the light intensity of 10μmol/(m2·s), the fresh weight of C. oligoclona increased by about 0.05g at the phosphorus concentrations of 0.1mg/L or above. However,the fresh weight of C. oligoclona decreased under other conditions. The greatest fresh weight loss was observed (about 0.49g) at the highest light intensity of 50μmol/(m2·s) and the lowest phosphorus concentration of 0.005mg/L. Chlorophyll fluorescence parameters Fv/Fm values inversely related to light intensity,the value of Fv/Fm decreased as the light intensity increased. Fv/Fm value was 0.75 at 10μmol/(m2·s) whereas Fv/Fm value was only 0.3 at 50μmol/(m2·s). Under the same light intensity,the different concentrations of phosphorus had no significant effects on the Fv/Fm values. These data showed that light intensity exerted more effects on the growth of C. oligoclona than phosphorus concentration. However,higher light intensity was detrimental to the growth of C. oligoclona.
Cladophora oligoclona;light intensity;phosphorus concentration;chlorophyll activity
X172
A
1000-6923(2015)07-2153-07
2014-11-01
国家自然基金(31370472);FEBL项目(2014FBZ01);水专
项滇池项目(2013ZX07102-005)
* 责任作者,副研究员,ligb@ihb.ac.cn
郭亮亮(1989-),女,河南周口人,中国科学院水生生物研究所博士研究生,主要从事藻类环境生物学研究.

