CO2浓度升高对湖泊浮游藻类与浮游细菌耦合关系的影响
陈 姝,郭照冰,方 华,李 汛,邢 鹏(.南京信息工程大学环境科学与工程学院,江苏 南京20044;2.中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室 江苏 南京 20008;.中国科学院南京土壤研究所,江苏 南京 20008)
CO2浓度升高对湖泊浮游藻类与浮游细菌耦合关系的影响
陈姝1,2,郭照冰1,方华1,李汛3,邢鹏2*(1.南京信息工程大学环境科学与工程学院,江苏 南京210044;2.中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室 江苏 南京 210008;3.中国科学院南京土壤研究所,江苏 南京 210008)
采用控制空气CO2浓度的围隔体系(P1: 400×10-6体积分数,下同,P2: 800×10-6,P3: 1200×10-6),在不同空气CO2浓度条件下,分析水华微囊藻对CO2的同化作用和异养细菌对藻源性有机碳的异化作用,以及二者出峰时间耦合关系的变化.结果表明,CO2浓度升高能够促进水华微囊藻的生长,P1、P2和P3条件下藻的数量分别达9.4×106,1.1×107,1.5×107cells/mL.同时高浓度CO2降低了藻细胞内酯酶活性但并未影响藻达到峰值所需时间.在不同 CO2浓度水平下,浮游细菌达到峰值的时间顺序是 P1(12d)<P2(14d)<P3(20d),细菌最高密度分别达到2.10×106cells/mL (P1),1.94×106cells/mL (P2)和1.70×106cells/mL (P3).前7d浮游细菌的生长速度是vP3>vP2>vP1,细菌活性是P3>P2>P1.高CO2浓度条件下,浮游藻类呈现高生物量和低活性的状态,而浮游细菌呈现低生物量和高活性的状态,反映出CO2浓度的改变对同化和异化作用不同的影响机制.因此,CO2浓度升高后导致的浮游藻类生物量的积累可能无法通过促进浮游细菌的生长达到有效转化.
CO2;浮游藻类;浮游细菌;耦合关系;湖泊;全球变化
全球环境变化已经成为影响人类可持续性发展的关键因素,而大气二氧化碳(CO2)浓度升高是驱动全球变化(全球变暖、海洋酸化、水循环异常、海平面升高、上部混合层浅化等)的重要因素.由于化石燃料燃烧和森林采伐,大气CO2浓度现每年仍以0.4%的速度递增,预计21世纪末将达到(600~1000)×10-6(体积分数,下同)[1].大气 CO2浓度的升高会影响海洋、湖泊和河流等水体的CO2水气交换,而水体环境的变化必然会影响水体中浮游植物细胞的新陈代谢过程,进而对水生生态系统和生物地球化学循环产生深远影响[2].与海洋面积相比,虽然湖泊面积只占地球表面积的0.5%,但由于其和大气的碳交换量变化与人类活动有着密切的关系,且具有指示作用,因而受到众多关注.
大气CO2浓度升高能使得湖泊水体中CO2增加、pH值下降,并引起不同形态无机碳比例的变化,在水生态系统中浮游藻类和浮游细菌不可避免地受这些物理化学因素变化的影响.已有研究表明,CO2浓度升高可促进陆生蓝藻、淡水绿藻以及某些海产藻类的生长[3-4],同时对不同藻类也存在着抑制及没有影响等效应[5-6].因此CO2浓度变化导致的湖泊初级生产力的变化,可能通过浮游藻类供给溶解性有机碳(DOC)的变化影响到浮游细菌.本研究采用可控制CO2浓度的围隔体系,模拟大气不同 CO2浓度条件,通过分析CO2浓度改变对浮游藻类和浮游细菌生理特性的影响,揭示浮游藻类对CO2的同化作用和异养细菌对藻源性有机碳异化作用的变化,以及二者动态变化的耦合关系.
蓝藻是一类全球性分布的浮游微生物,目前我国长江中下游湖泊富营养化问题突出,蓝藻水华频繁暴发.特别在春末夏初蓝藻的生物量占浮游藻类生物量的 90%以上,其中微囊藻属[7-8]的水华微囊藻(Microcystis flos-aquae (Wittr). Kirchner)是主要的优势种之一.已有研究表明微囊藻与细菌之间存在代谢偶联[9],但尚未涉及CO2浓度变化对这一耦合关系的影响.本研究以水华微囊藻为代表,研究其在不同大气CO2浓度条件下的生长情况.实验过程中不添加任何外源有机碳,以保证藻源性 DOC是浮游细菌可利用的唯一碳源,从而有利于二者耦合关系的判定.
1 材料与方法
1.1实验设计
实验利用3个CO2浓度控制室[10],设定的空气CO2浓度水平为P1: 400×10-6,P2: 800×10-6,P3:1200×10-6.高 CO2浓度水平(800×10-6,1200×10-6)由 CO2钢瓶经空气压缩机气体配比器(德国WITT) 提供,采用 CO2在线检测仪器(德国SIEMENS)跟踪并及时修正的CO2控制室内的浓度.每个 CO2控制室 2.3m(长)×0.8m(宽)× 1.4m(高),放置 6个圆形有机玻璃柱 40cm(高)× 20cm(直径).通过将控制室内的空气直接通入水体中,实现对水体CO2浓度的长期控制.实验期间每天08:00~22:00每隔1h对各个培养体系曝气10min.
从位于南京市钟山风景区的前湖(32°02′52.06″,118°49′52.60″)采集表层湖水,用25号浮游生物网过滤后加入有机玻璃柱中适应约7d.将实验室培养的水华微囊藻接种至每个体系中,水华微囊藻初始密度均为8.5×105cells/mL左右.CO2控制室设光源,模拟原位的日照强度和周期.于实验开始的 0d采样一次,随后隔天采样一次,取培养体系中的湖水分别用来测定总磷 TP/总氮TN,溶解性N/P,DOC,HCO3-,CO32-,蓝藻数量,酯酶活性,细菌数量及细菌活性等指标,采样时记录水体温度和pH值,实验持续28d.
1.2实验材料
实验所用的藻为水华微囊藻(Microcystis flos-aquae (Wittr). Kirchner),将 纯 藻 种 接 入1000mL BG-11培养液中进行扩大培养,三角瓶置于恒温光照培养箱中,14d左右待水华微囊藻生长达到平台期后,接入CO2控制室内的培养体系中.
1.3测试指标及分析方法
1.3.1培养体系中水体理化参数的测定温度、pH值、总氮(TN)、总磷(TP)的测定方法见文献[11-12].取 50mL水样,经 0.2μm滤膜(Omnipore®)过滤后,15mL用于-浓度的测定(EurVector EA3000);20mL用于水体中的 DOC浓度的测定(TOC Torch TELEDYNE TEKMAR);余下 15mL水样采用元素分析仪(SKALARSAN++ 荷兰)测定溶解性N/P浓度. 1.3.2水华微囊藻数量测定取 3mL水样,将较大悬浮颗粒过滤后,使用基础流式细胞仪(CellAnalyzer)计数水华微囊藻细胞数.根据仪器测定范围,适当调整样品的稀释倍数.
1.3.3水华微囊藻酯酶活性测定本试验选用的流式细胞仪(Flow Cytometry,FCM),按Franklin[13]方法,将PI (Sigma,P-4170)用重蒸馏水稀释到 100μmol/L,4℃保存.FDA(Sigma,F-7378)用丙酮稀释到 1mmol/L,-18℃保存.取细胞密度为1.0×105cells/mL的藻液1mL,300目筛网过滤后,加入适量FDA 染料,25℃暗室温育.染色时间为 0~80min,用流式细胞仪检测 FDA荧光信号.酯酶活性的单位为nmol FDA/(L·h).
1.3.4浮游细菌计数取10mL水样,用终浓度1%(V/V)的戊二醛固定.取 6mL固定的水样,经DAPI(4′-6-diamino-2-phenylindole)染色后(终浓度100 μg/mL),过滤到0.2μm的聚碳酸酯滤膜(Omnipore®)上,避光保存在-20℃,直到在荧光显微镜下计数.每个样品计数 20个视野,求平均值后计算样品中浮游细菌的细胞数量.采用式(1)计算样品中浮游细菌的数量:
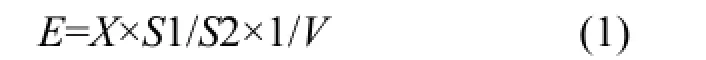
式中:E为样品中细菌总数,cells/mL; X为各计数视野细菌总数的平均值,cell; S1为滤膜面积,mm2;S2为显微镜油镜的视野面积,mm2;V为过滤水样的体积,mL.为避免污染随后的计数,在进行下一次分析前要用试剂洗涤全部过滤仪器.
1.3.5浮游细菌活性的测定采用试剂盒LIVE/DEAD® BacLight™ Bacterial Viability Kit,for microscopy & quantitative assays (life technologies),对样品中浮游细菌的活性进行测定.样品中,细胞膜受损已经或即将死亡的细胞会被染成红色,而细胞膜完好的细胞会染成绿色.通过荧光分光光度计(RF-5301PC,日本岛津,激发波长 470nm,发射 490~700nm)对样品进行扫描,计算各样品中发射波长 510~540nm(EM1,绿色)与 620~650nm(EM2,红色)的峰值的比率[15-16],以反映样品中浮游细菌的活性.
2 结果与讨论
2.1水体中无机碳、氮、磷的变化
在整个实验过程中,培养体系内水温波动在8°C以内,如图1(a)所示.水体pH值呈现CO2浓度P1(400×10-6)高于 P2(800×10-6)和 P3(1200×10-6)的趋势,且实验期间P2和P3体系中pH值保持相对稳定,而P1条件下的pH值随藻的生长出现升高趋势,如图 1(b).由于蓝藻可以利用水中的作为碳源,如 Johnson等[17]文章中公式(2)所示.这是蓝藻较之于其他藻类的优势,代谢弱碱成强碱,提升水体pH值.野外观测显示,中午光合作用强烈的时候,部分藻华水体的 pH值可以达到10甚至更高.P2和P3条件下的水体中持续有高浓度CO2补充,在满足藻类生长需求的同时,多余的溶解性CO2转化为-,以及对pH值起到了较好的缓冲作用.而P1下水华微囊藻大量生长消耗的 CO2未能通过曝气过程获得补充,从而导致体系中pH值升高.
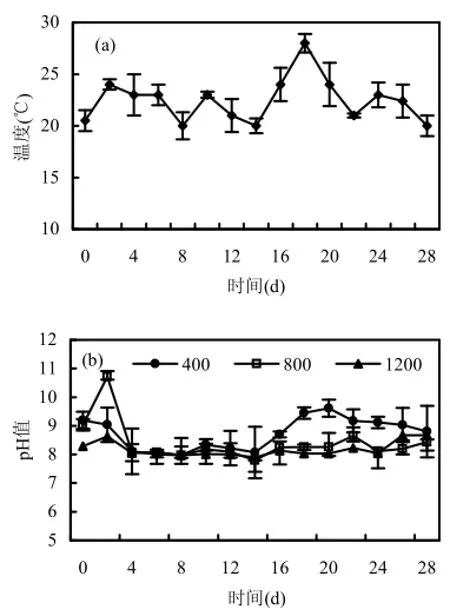
图1 培养体系中温度(a)和pH值(b)随时间的变化情况Fig.1 The changes of temperature (a) and pH (b) with time in the system
一般情况下,微藻可以直接利用 CO2和,而无法利用形态碳分子.从图2(a)中可见,不同CO2条件下HCO3-浓度的动态变化趋势基本一致,实验开始后均呈下降趋势,12d内浓度分别下降到初始值的43.4%(P1)、31.3%(P2)、37.9% (P3),从 12d后浓度基本趋于稳定.这一结果指示,尽管实验期间每天8:00~22:00之间每隔1h对各个培养体系曝气10min,但水体中CO2(g)可能仍无法满足藻细胞对碳源的需求,水华微囊藻大量通过利用获得无机碳源成为微囊藻生长主要碳源,故一直呈下降趋势.根据上述结果,随着 CO2浓度升高很可能影响水体中的碳浓缩机制.如图2(b)所示,800×10-6和1200×10-6下-浓度呈现先略下降,后回升稳定,但 400×10-6下,尽管水体pH值升高,但持续下降.
本实验过程中并未向培养体系中额外加营养盐,因此水体中TN和TP没有发生明显的变化,如图2(c)和(d),而溶解性N,P却随藻数量的增加呈明显的下降趋势如图 2(e)和(f).根据 Redfield的假设,一个典型藻类的分子式应为C106H263O110N16P,换言之临界的氮磷比按元素计应为16:1[18].本实验开始时培养体系内TN/TP以及DIN/DIP都在50左右,表明藻类生长基本上受到P元素的限制.在实验开始后,随着藻类的生长,可以观察到DIP的急速下降,第4d时这一比例就远远超过 150.实验设定的情景与我国富营养湖泊大部分受到磷限制的情况是一致的.夏建荣等[19]研究显示高氮、磷浓度培养下的小新月菱形藻的最大光合作用速率(Vmax)、对 CO2亲和力(K0.5(CO2))和光系统 II最大光化学效率(Fv/Fm)均明显提高,而低氮浓度导致胞外碳酸酐酶活性丧失.
2.2不同CO2浓度对水华微囊藻生长的影响
不同CO2浓度下,水华微囊藻生长情况如图3(a)所示.在实验的前4d CO2浓度对藻密度的影响差异不明显,这表明在培养初期CO2浓度尚未构成藻细胞生长的限制因子.随后不同CO2浓度下藻密度的差异逐渐明显,至第16d时P1条件下的藻细胞密度达到最大值9.4×106cells/mL,P2条件下的藻细胞密度达最大值 1.1×107cells/mL,P3条件下的藻细胞密度达最大值 1.5×107cells/mL.大气CO2浓度的提高导致相应水体表层CO2浓度的增加,藻类利用CO2(gas)作为碳源,可以节省其吸收利用 HCO3-所要消耗的细胞能量,藻体可以把更多的能量用于其生长,导致生长速率的增加[20].此结果与徐军田等[21],邹定辉等[22]提出的CO2浓度升高能促进藻类的生长是一致的.藻类达到峰值的时间几乎没有受到 CO2浓度的影响,P1、P2和P3达到峰值的时间均为第16d.
本研究采用荧光素二乙酸盐(Fluorescein diacetate,FDA)作为代谢探针,评估水华微囊藻代谢活性[23-25].FDA容易被细胞吸收并被酯酶转化,其转化为荧光素的速率与光合作用和营养生长所受的限制有关[26].如图3(b),3种不同CO2水平条件下酯酶衰变周期没有显著性差异,均为5~7d.而在数值上每个衰变周期的峰值却是P1>P2>P3,Sobrino等[27]在海洋的研究中也发现了类似的现象,即酯酶活性在高CO2浓度条件下反而较低.酯酶活性反映了细胞的代谢状态,当细胞处于适宜的环境未受到压力或干扰时,其代谢(酯酶)活性保持在稳定的状态.CO2浓度升高对酯酶活性的影响可能主要来源于酯酶活性与光合作用代谢之间的关系.有研究估计细胞用于CO2浓缩的能量占细胞能量需要的20%左右[28]. 高CO2浓度下,细胞可以节省一部分用于CO2浓缩的能量,而这部分节约的能量可能是细胞光合作用以及代谢活性下降的原因.反之,在低CO2条件下,细胞表现出活跃的CO2浓缩过程,也需要较高的能量付出.
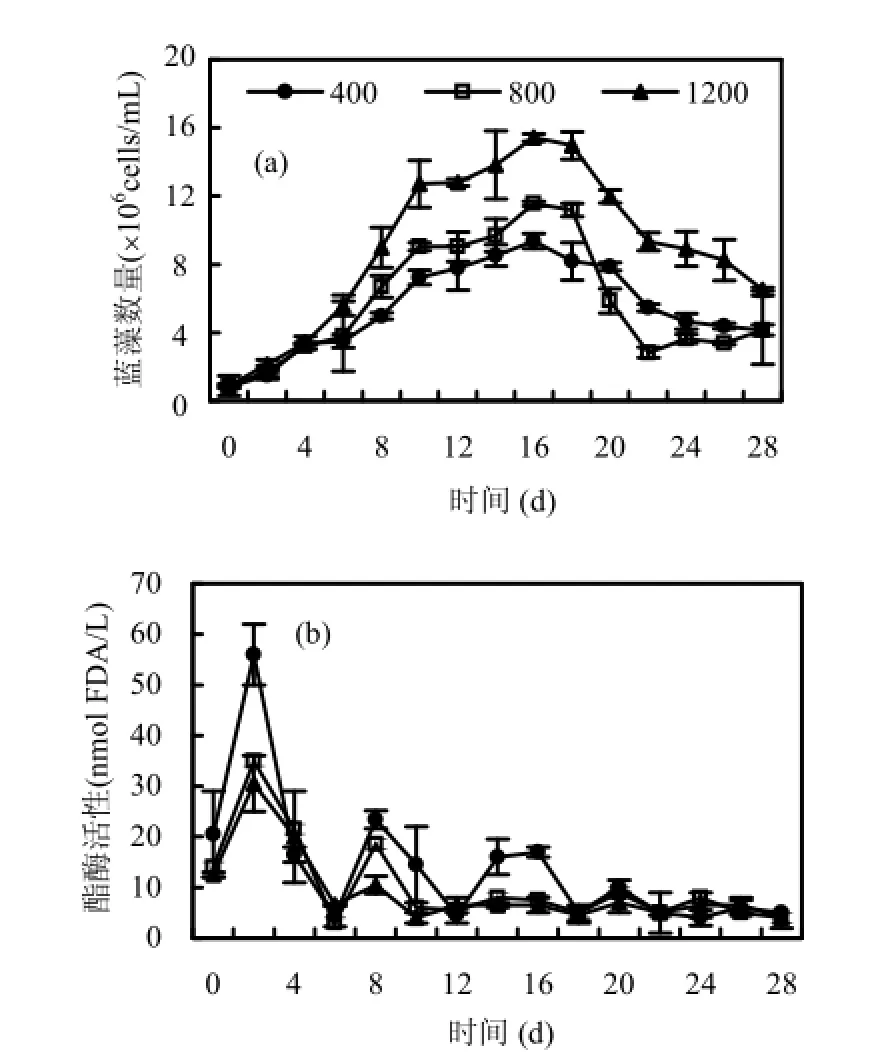
图3 不同CO2浓度对水华微囊藻数量(a)和酯酶活性(b)的影响Fig.3 Effects of CO2concentrations on M. flos-aquae (a)and esterase activity of algal cells (b)
2.3不同CO2水平下浮游细菌数量及活性
如图4(a),在不同CO2浓度水平下,浮游细菌达到峰值的时间是分别是第12d(P1),第14d(P2),第20d(P3),细菌最高密度分别为2.10× 106cells/mL (P1),1.94×106cells/mL (P2)和 1.70× 106cells/mL (P3).前7d时,浮游细菌的生长速度是vP3>vP2>vP1,细菌活性是 P3>P2>P1,如图 4(b).本实验过程中除了不断向培养体系中补充 CO2外,未添加任何N、P等营养盐,所有非CO2物质来自于原位湖水及水华微囊藻培养基.这一设计的目的是使水华微囊藻在有限的N、P条件下可以达到一次细胞浓度的最大值,同时可以保证藻源性DOC是浮游细菌唯一可以利用的有机碳源.随着CO2浓度的提高,水华微囊藻呈现生物量积累的增加[图3(a)]藻类活跃生长过程中向周围水体释放DOC,可以为浮游细菌生长提供有机碳源.但培养体系中,溶解性N、P浓度持续下降,因此细菌的生长还受到可利用 N、P营养盐的限制.随着藻类和细菌的旺盛生长,浮游藻类与异养浮游细菌可能形成对 N、P等无机营养盐的竞争.尽管浮游藻类给异养浮游细菌提供了大量的溶解性有机碳源,但N、P等无机营养盐就可能成为浮游细菌生长的主要限制因子[29].实验后期高浓度CO2下浮游细菌活性下降得更为明显.
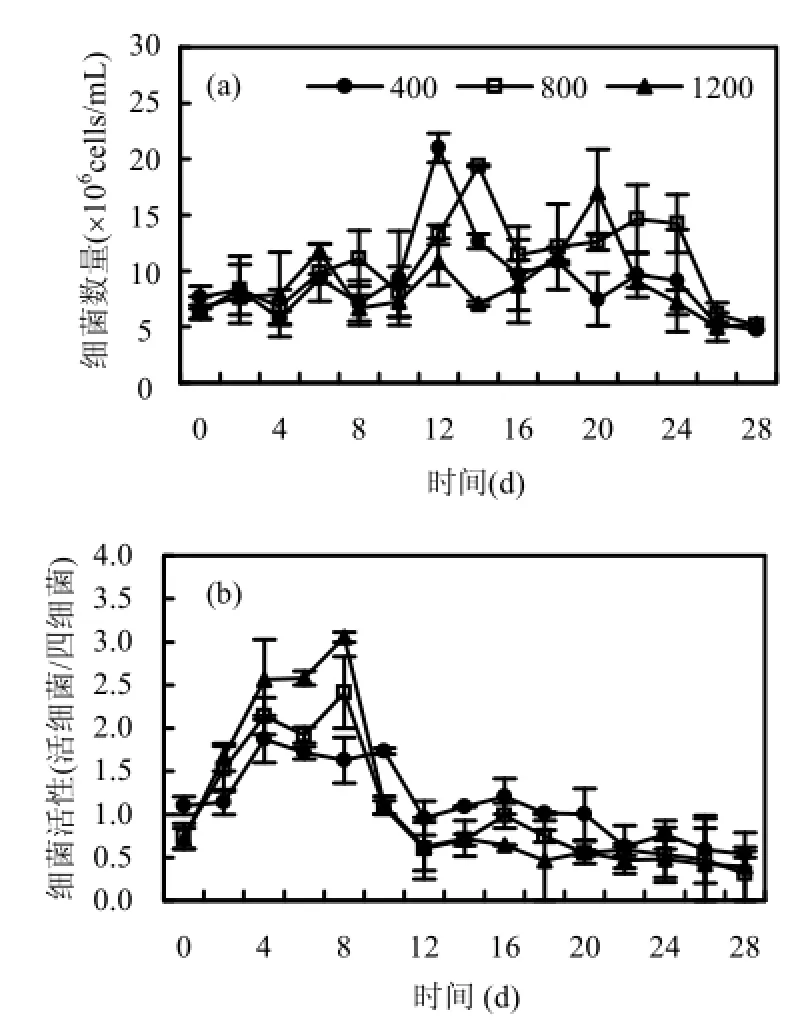
图4 不同CO2浓度条件下浮游细菌数量(a)和活性(b)随时间的动态变化Fig.4 The bacterial number (a) and activity (b) under each CO2concentration
2.4不同CO2浓度下浮游藻类与浮游细菌耦合关系的变化
异养细菌和底物驱动的浮游藻类之间的耦合关系主要是指存在于二者之间的C流动,浮游藻类和异养浮游细菌二者的峰值在时间顺序上的依赖性和重叠程度确定了这种耦合关系,而所研究的因子对于峰值相对量存在直接影响.
CO2浓度的升高促进了藻的生长但却没有影响藻达到峰值的时间,P1、P2和P3达到峰值的时间均为第16d.如图5所示,15d之前水体中DOC浓度随CO2浓度的升高而缓慢增加,除P2外,15d后DOC趋于稳定.不同CO2浓度条件下DOC浓度出现的峰值却随着CO2浓度的升高而延迟,P1、P2和P3条件下DOC浓度出峰时间分别在第16d、第20d和第24d.较高的水华微囊藻生物量使得水体 DOC维持在高浓度的时间较长.P1和P3条件下,水华微囊藻数量与DOC均具有极显著的线性相关关系(P1: R2=0.40,P=0.011,n=14; P3: R2=0.34,P=0.022,n=14),但P2条件下二者不存在显著的相关关系.随着藻类细胞数量的增加,其生长和分解过程中向水体释放的 DOC浓度增加.
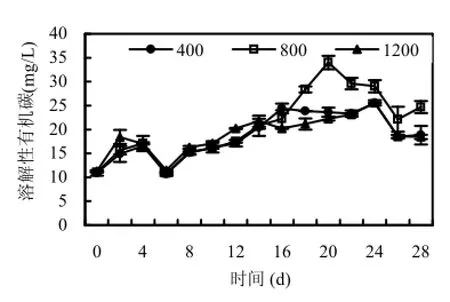
图5 不同CO2浓度下水体中DOC随时间的变化Fig.5 The dynamics of DOC under each CO2concentrations
在不同CO2浓度水平下,浮游细菌达到峰值的时间是P1<P2<P3,分别在第12d、第14d和第20d.这与DOC变化趋于一致,这是因为实验体系中没有外源有机碳,主要的 DOC源是来自藻类光合作用释放的物质,是含碳物质,如碳水化合物、氨基酸、蛋白质、有机酸以及维生素等的混合[30].但是,显著性检验显示3种CO2浓度条件下,细菌数量与DOC浓度之间不存在显著相关关系.细菌对于 DOC的利用主要基于生理需求,但也受到环境因子,如温度、溶解氧和营养盐浓度的影响[31-33].培养体系中,溶解性N、P浓度持续下降,因此细菌的生长可能主要受到可利用 N、P营养盐的限制[34].一方面,细菌等将水体中颗粒有机碳和溶解性有机碳进一步矿化为营养盐供浮游藻类利用的同时,又可吸收 DOC合成自身成分;另一方面,细菌可以通过参与生物竞争、分泌特殊物质等途径抑制浮游藻类的细胞生长,甚至裂解其细胞.所以说藻和细菌之间是相互依存相互影响的.
3 结论
3.1CO2浓度升高导致水华微囊藻数量的增加和酯酶活性的降低,但并未改变其达到最大生物量峰值的时间以及酯酶活性的衰变周期.
3.2高 CO2浓度条件下,浮游细菌峰值细胞数量最低而且达到最大峰值时间的延迟,但高 CO2浓度下浮游细菌的活性较高.
3.3浮游藻类和浮游细菌动态变化的耦合关系表现为:高 CO2浓度条件下,水华微囊藻呈现高生物量和低活性的状态,而浮游细菌呈现低生物量和高活性的状态,且二者细胞数量峰值时间间隔扩大.因此 CO2浓度升高可能引起浮游藻类累积的生物量无法通过浮游细菌的分解获得快速转化.
[1] Lee P A,Riseman S F,Hare C E,et al. Potential impact of increased temperature and CO2on particulate dimethyl sulfoniopropionate in the southeastern Bering Sea [J]. Advances in Oceanography and Limnology,2011,2(1):33-47.
[2] Hargrave C W,Gary K P,Rosado S K. Potential effects of elevated atmospheric carbon dioxide on benthic autotrophs and consumers in stream ecosystems: a test using experimental stream mesocosms [J]. Global Change Biology,2009,15(11):2779-2790.
[3] Qiu B S,Gao K. Daily production and photosynthetic characteristics of Nostoc flagelliforme grown under ambient and elevated CO2conditions [J]. Journal of Applied Phycology,2002,14:77-83.
[4] Zou DH and Gao KS . Progress in studies on photosynthetic inorganic carbon utilization in marine macroalgae [J]. Marine Science Bulletin,2010,20(5):83-90.
[5] Mercado J M ,Javier F,Gordilio L,et al . Effects of different levels of CO2on photosynthesis and cell components of the red alga Porphyral eucosticta [J]. Journal of Applied Phycology,1999,11:455-461.
[6] Bjork M,Haglund K,Rammazanov Z,et al. Inducible mechanisms for HCO3-utilization and repression of photorespiration in protoplasts and thalli of three species of Ulva(Chlorophyta) [J]. Journal of Phycology,1993,29:166-173.
[7] Chen Y,Qin B,Teubner K,et al. Long-term dynamics of phytoplankton assemblages: Microcystis-domination in Lake Taihu,a large shallow lake in China [J]. Journal of Plankton Research,2003,25(4):445-453.
[8] Dokulil M T,Teubner K. Cyanobacterial dominance in lakes [J]. Hydrobiologia,2000,438(1/3):1-12.
[9] Jiang L,Yang L,Xiao L,et al. Quantitative studies on phosphorus transference occurring between Microcystis aeruginosa and its attached bacterium [J]. Hydrobiologia,2007,581:161-165.
[10] Li X,Chu W,Dong L,et al. An improved high-performance liquid chromatographic method for the determination of soluble sugars in root exudates of greenhouse cucumber grown under CO2enrichment [J]. Journal of the American Society for Horticultural Science,2014,139(4):356-363.
[11] 金相灿,屠清瑛.湖泊富营养化调查规范 [M]. 2版.北京:中国环境科学出版社,1990:160-187.
[12] 国家环境保护总局.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社,2002:243-248.
[13] Franklin N M,Adams M S,Stauber J L. Development of an improved rapid enzyme inhibition bioassay with marine and freshwater microalgae using flow cytometry [J]. Archives of Environmental Contamination and Toxicology,2001,40:469-480.
[14] Krause M,Radt B. Localizing and identifying living bacteria in an abiotic environment by a combination of Raman and fluorescence microscopy [J]. US National Library of Medicine National Institute of Health,2008,80(22):8568-75.
[15] Yoon S S,Krarabulut A C. Two-pronged survival strategy for the major cystic fibrosis pathogen,Pseudomonas aeruginosa,lacking the capacity to degrade nitric oxide during anaerobic respiration [J]. US National Library of Medicine National Institute of Health,2007,26(15):3662-72.
[16] Burkhardt S,Amoroso G,Riebesell U,et al. CO2and HCO3-uptake in marine diatoms acclimated to different CO2concentrations [J]. Limnology and Oceanography,2001,46(6):1378-1391.
[17] Johnson D B,Hallberg K B. Acid mine drainage remediation options: a review [J]. Science of the Total Environment,2005,338(1/2):3-14.
[18] Vollenweider R A. Elemental and biochemical composition of plankton biomass,some comments and explorations [J]. Archiv fur Hydrobiologie,1985,105:11-29.
[19] 夏建荣,黄瑾.氮、磷对小新月菱形藻无机碳利用与碳酸酐酶活性的影响 [J]. 生态学报,2010,30(15):4085-4092.
[20] Michler T,Agutlear J,Hanelt D,et al. Long-term effects of ultraviolet radiation on growth and photosynthetic performance of polar and cold-temperate macroalgae [J]. Marine Biology,2002,140(6):1117-1127.
[21] 徐军田,高坤山.二氧化碳和阳光紫外辐射对龙须菜生长和光合生理的影响 [J]. 海洋学报,2010,32(5):41-53.
[22] 邹定辉,高坤山,阮祚禧.高 CO2浓度对石莼光合作用及营养盐吸收的影响 [J]. 青岛海洋大学学报,2001,31(6):877-882.
[23] Tanaka Y,Yamaguchi N,Nasu M. Viability of Escherichia coli O157: H7in natural river water determined by the use of flow cytometry [J]. Journal of Applied Microbiology,2000,88(2):228-236.
[24] Lage O M,Sansonetty F,O'Connor J E. Flow cytometric analysis of chronic and acute toxicity of copper (II) on the marine dinoflagellate Amphidinium carterae [J]. Cytometry,2001,44(3):226-235.
[25] Regel R H,Ferris M J,Ganf G G,et al. Algal esterase activity as a biomeasure of environmental degradation in a freshwater creek [J]. Aquatic Toxicology,2002,59:209-223.
[26] Brookes J D,Geary S M,Ganf G G,et al. The use of FDA and flow cytometry to assess metabolic activity as an indicator of nutrient status in phytoplankton [J]. Marine and Freshwater Research,2000,51:817-823.
[27] Sobrino C,Segovia M,Neale P J,et al. Effect of CO2,nutrients and light on coastal plankton. IV. Physiological responses [J]. Aquatic Biology,2014,22:77-93.
[28] Raven JA. Physiology of inorganic C acquisition and implications for resource use efficiency by marine phytoplankton: relation to increased CO2and temperature [J]. Plant Cell and Environment,1991,14:779-794.
[29] Garte-Lizarrag I,Lopez-Cortes D J. Blooms of Cochlodinium polykrikoides (Gymnodiniaceae) in the Gulf of California,Mexico [J]. Revista de Biologia Tropical,2004,52:51-581.
[30] Myklestad S. Dissolved organic carbon from phytoplankton [J]. Marine Chemistry,2000,5:111-148.
[31] De Wever A,Muylaert K,Van der Gucht K,et al. Bacterial community composition in Lake Tanganyika: vertical and horizontal heterogeneity [J]. Applied and Environmental Microbiology,2005,71(9):5029-5037.
[32] Apple J K,Del Giorgio P A,Kemp W M. Temperature regulation of bacterial production,respiration and growth efficiency in a temperate salt-marsh estuary [J]. Aquatic Microbial Ecology,2006,43(3):243-254.
[33] Kan JJ,Wang K,Chen F. Temporal variation and detection limit of an estuarine bacterioplankton community analyzed by denaturing gradient gel electrophoresis (DGGE) [J]. Aquatic Microbial Ecology,2006,42(1):7-18.
[34] Rubin M A,Leff L G. Nutrients and other abiotic factors affecting bacterial communities in an Ohio River (USA) [J]. Microbial Ecology,2007,54(2):374-383.
致谢:本实验的采集水样工作得到南京信息工程大学杨伟宗、葛鑫、魏英、祝胜男等的帮助,指标测试得到南京地理与湖泊研究所刘一兰、龚伊等协助,在此表示感谢.
Effects of elevated CO2concentration on the coupling relationship between planktonic algae-planktonic bacteria.
CHEN Shu1,2,GUO Zhao-bing1,FANG Hua1,LI Xun3,XING Peng2*(1.Nanjing University of Information Science and Technology,Nanjing 210044,China;2.State Key Laboratory of Lake Science and Environment,Nanjing institute of Geography and Limnology Chinese Academy of Sciences,Nanjing 210008,China;3.Institute of Soil Science Chinese Academy of Sciences,Nanjing 210008,China).
China Environmental Science,2015,35(7):2209~2216
CO2fixation by planktonic algae and subsequent assimilation of algae-derived organics by planktonic bacteria,and the coupling relationship between them were studied at elevated CO2levels. The elevated CO2levels were achieved in three sets of mesocoms,each having a volume faction of 400×10-6(P1),800×10-6(P2),and 1200×10-6(P3),respectively. Results showed that elevated CO2supplies promoted algal growth,leading to biomass of 9.4×106cells/mL,1.1×107cells/mL,and 1.5×107cells/mL at P1,P2,and P3 levels. Algal esterase activity was also reduced at these CO2levels,but the time to reach peak biomass was not affected. For planktonic bacteria in the same mesocoms,they reached peak biomass on day 12 (P1),14 (P2),and 20 (P3),leading to cell density of 2.10×106cells/mL (P1),1.94×106cells/mL (P2),and 1.70×106cells/mL (P3). In the first seven days,the growth rate of planktonic bacteria correlated with increasing CO2levels: vP3>vP2>vP1,as was the bacterial activity. At elevated CO2levels,algae showed high biomass with low metabolic activity,while bacterial showed relative low biomass with high metabolic activity; this contrast reflected differences in the response mechanism of algae and bacteria to changes in CO2levels. Therefore,the high biomass resulting from elevated CO2under global change may not effectively transform into bacterial biomass.
CO2;phytoplankton;bacterioplankton;coupling relationship;lake;global change
X17
A
1000-6923(2015)07-2209-08
2015-12-10
国家自然科学基金项目(31370508);太湖“湖泛”与水华灾害应急处置技术研究及工程示范(2012ZX07101-010);湖泊与环境国家重点实验室开放研究基金(2012SKL005);中国科学院南京地理与湖泊研究所135规划前沿交叉项目(NIGLAS2012135011)
* 责任作者,副研究员,pxing@nigalas.ac.cn
陈姝(1989-)女,江苏淮安人,硕士,主要从事水污染控制与工程研究.

