miR-23b转染宫颈癌干细胞顺铂化疗敏感性变化及其机制
凌芳,沈慧玲
(1 江苏大学附属医院,江苏镇江212001;2 江苏大学附属人民医院)
宫颈癌是威胁女性生命健康的重大疾病,据统计,全球每年约有53万新发病例[1]。近年来,宫颈癌在手术、放化疗等方面取得了较好的临床疗效,但仍有超过半数的宫颈癌患者处于疾病晚期,放化疗耐药是制约临床疗效、导致宫颈癌晚期患者不良预后的重要原因。肿瘤组织中存在能够自我更新并分化为肿瘤细胞的肿瘤干细胞,与其他肿瘤干细胞类似,宫颈癌干细胞对放化疗具有原发耐药性,是导致宫颈癌化疗耐药、术后复发的主要原因[2]。乙醛脱氢酶1A1(ALDH1A1)是新近发现的肿瘤干细胞标志分子,与多种实体肿瘤的发生发展密切相关[3]。越来越多的证据表明,微小RNA(microRNAs)异常表达在疾病或肿瘤的发病过程中发挥重要作用,如microRNA-187(miR-187)通过抑制FGF9基因表达进而抑制宫颈癌细胞增殖[4],miR-494参与调节SOCS6基因表达,调控宫颈癌细胞增殖过程[5]。有报道[6]称,在宫颈癌中,miR-23b具有抑癌基因功能,而关于miR-23b在宫颈癌干细胞中的表达及作用机制,鲜见文献报道。2015年7月~2018年2月,本研究观察了miR-23b转染对宫颈癌干细胞顺铂(CDDP)化疗敏感性的影响,并探究其作用机制。
1 材料与方法
1.1 miR-23b、细胞及试剂 miR-23b模拟物(miR-23b mimics)、miR-23b阴性对照物(miR-23b NC)由上海吉玛制药技术有限公司合成。人宫颈癌细胞系CaSki和人胚胎肾细胞系HEK-293T均购于中国科学院典型培养物保藏委员会细胞库。DMEM培养基、胎牛血清、0.25%胰蛋白酶和DMSO试剂均购于美国Invitrogen生命技术有限公司,CD133抗体(ab19898)购于美国Abcam公司,RNA提取试剂盒、real-time PCR试剂盒均购自北京天根生化科技有限公司,定量引物序列由上海生工生物工程股份有限公司合成,顺铂(CDDP,国药准字H37021358)购于山东齐鲁制药有限公司,CCK-8试剂盒购自上海翊圣生物科技有限公司,Lipofectamine®3000脂质体试剂盒购自美国Invitrogen公司,RIPA裂解液购自上海碧云天生物技术有限公司。兔抗人ALDH1A1单抗体、兔抗人GAPDH多克隆抗体购于美国Abcam公司,HRP标记二抗、ECL发光液购自北京诺特莱斯生物科技有限公司。内参质粒SV40、pmirGLO-ALDH1A1-3′-UTR wt(野生型)荧光素酶质粒、pmirGLO-ALDH1A1-3′-UTR mut(突变型)荧光素酶质粒和pmirGLO空载体质粒由上海吉玛制药技术有限公司合成,双荧光素酶检测试剂盒购于北京威格拉斯生物技术有限公司。
1.2 细胞培养和宫颈癌干细胞(CDl33+CaSki细胞)的分选[7]人宫颈癌CaSki细胞和HEK-293T细胞均培养于DMEM培养基(含10% 胎牛血清),置于37 ℃、5% CO2、饱和湿度的培养箱中,采用0.25%胰蛋白酶消化传代培养,DMSO试剂进行细胞冻存,遵循缓冻速融原则,维持细胞状态良好。取处于对数生长期的CaSki细胞,胰蛋白酶消化后,用PBS缓冲液调整细胞浓度为1×106/mL,加入CD133抗体,避光孵育20 min,流式细胞仪进行分选。采用流式细胞术检测CD133+CaSki细胞比例,分选前后CaSki细胞中CD133+CaSki细胞占比分别为3.02%±0.63%和95.88%±5.35%,提示分选成功。
1.3 CaSki细胞中miR-23b的检测及其靶基因预测 TRIzol法分别提取CD133+CaSki细胞和宫颈癌非干细胞(CD133-CaSki细胞)总RNA,测定浓度及纯度后,取1 μg RNA逆转为cDNA,产物置于-80 ℃保存。参照real-time PCR试剂盒的反应条件和反应体系进行PCR扩增,引物序列如下:miR-23b正向引物为5′-TGTTAGCTGATGCCGACTTG-3′, miR-23b反向引物为5′-TTC TTAGCCCGCTCAACACT-3′;内参β-Actin正向引物为5′-GCTATCCTGTACGCCTCTG-3′,内参β-Actin反向引物为5′-ACATCTGCTGGAAGGTGGAC-3′。miR-23b相对表达量以2-ΔΔCt表示。采用TargetScan和PITA等miRNA靶基因预测分析数据库,预测miR-23b的靶基因。
1.4 miR-23b的转染及CDDP对CD133+CaSki细胞的半数抑制浓度(IC50)检测 将CD133+CaSki细胞按6×103个/孔的密度接种于96孔板,孵育过夜,严格参照Lipofectamine®3000脂质体试剂盒说明书进行操作。将CD133+CaSki细胞分为mimics组、NC组、空白对照组,mimics组转染miR-23b mimics,NC组转染miR-23b NC,空白对照组不做任何处理。转染6 h之后,无血清DMEM培养液稀释CDDP至不同浓度(0、1、2、4、8、16、32 μg/mL)后加入各组,药物处理48 h后,每孔加入10 μL CCK-8溶液,每组设置3个复孔,培养箱中继续培养4 h,450 nm波长下测定OD值,计算CDDP对各组细胞的IC50。
1.5 CD133+CaSki、CD133-CaSki、转染miR-23b mimics的CD133+CaSki细胞中ALDH1A1蛋白检测 采用Western blotting法。RIPA裂解液分别提取CD133+CaSki细胞、CD133-CaSki细胞和转染miR-23b mimics的CD133+CaSki细胞总蛋白,SDS-PAGE胶分离蛋白后,转移蛋白至PVDF膜,封闭缓冲液室温孵育1 h后,分别加入ALDH1A1和GAPDH一抗,室温孵育1 h,PBST缓冲液洗涤3次后分别加入HRP标记的二抗,室温孵育1 h,PBST缓冲液洗涤3次后ECL发光液显色,进行灰度分析,计算ALDH1A1蛋白相对表达量。ALDH1A1蛋白相对表达量=(ALDH1A1蛋白灰度值/GAPDH蛋白灰度值)×100%。
1.6 HEK-293T细胞miR-23b mimics、野生型和突变型pmirGLO-ALDH1A1-3′-UTR的转染、转染质粒编码蛋白的荧光强度检测 将HEK-293T细胞按5×106个/孔的密度接种于6孔板中,孵育过夜。将HEK-293T细胞分为wt 组、mut组、空载体组,每组设置3个复孔,wt 组转染miR-23b mimics、内参质粒SV40、pmirGLO-ALDH1A1-3′-UTR wt(野生型)荧光素酶质粒,mut组转染miR-23b mimics、内参质粒SV40、pmirGLO-ALDH1A1-3′-UTR mut(突变型)荧光素酶质粒,空载体组转染miR-23b mimics、内参质粒SV40、pmirGLO空载体质粒。转染24 h后,采用双荧光素酶试验检测各组细胞转染质粒编码蛋白的荧光强度,计算各组细胞内转染质粒编码蛋白的相对荧光强度。各组细胞内转染质粒编码蛋白的相对荧光强度=(各组目的转染质粒编码蛋白的荧光强度/内参转染质粒编码蛋白的荧光强度)×100%。
2 结果
2.1 CD133+CaSki、CD133-CaSki细胞中miR-23b的表达比较及miR-23b靶基因预测结果 CD133+CaSki、CD133-CaSki细胞中miR-23b的相对表达量分别为0.29±0.05、1.09±0.14,两者相比,P<0.01。miRNA靶点预测公共数据库TargetScan的分析结果显示,ALDH1A1基因可能是miR-23b的靶基因,见图1。
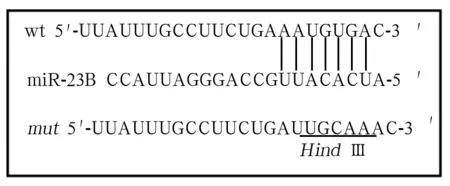
图1 野生与突变ALDH1A1基因3′-UTR与miR-23b序列配对示意图
2.2 CDDP对各组CD133+CaSki细胞的IC50比较 CDDP对mimics组、NC组、空白对照组细胞的IC50分别为(8.18±1.02)、(13.98±1.48)、(14.15±1.27)μg/mL;mimics组与NC组和空白对照组相比,P均<0.05;NC组与空白对照组相比,P>0.05。
2.3 CD133+CaSki、CD133-CaSki、转染miR-23b mimics的CD133+CaSki细胞中ALDH1A1蛋白表达比较 CD133+CaSki、CD133-CaSki、转染miR-23b mimics的CD133+CaSki细胞中ALDH1A1蛋白相对表达量分别为0.29±0.06、0.12±0.03、0.13±0.04,ALDH1A1蛋白在CD133+CaSki细胞中的相对表达量与CD133-CaSki细胞和转染miR-23b mimics的CD133+CaSki细胞相比,P均<0.05;ALDH1A1蛋白在CD133-CaSki细胞中的相对表达量与转染miR-23b mimics的CD133+CaSki细胞相比,P>0.05。
2.4 HEK-293T细胞转染质粒编码蛋白的相对荧光强度比较 HEK-293T细胞中,wt组、mut组、空载体组转染质粒编码蛋白的相对荧光强度分别为0.41±0.06、1.12±0.15、1.02±0.15。其中,wt 组转染质粒编码蛋白的相对荧光强度与mut组和空载体组相比,P均<0.05;mut组转染质粒编码蛋白的相对荧光强度与空载体组相比,P>0.05。
3 讨论
肿瘤干细胞对化疗药物具有原发耐药性,在肿瘤化疗耐药中发挥关键性作用。近年来的研究[8]证实,microRNAs表达异常与肿瘤干细胞化疗耐药密切相关,如在恶性胶质瘤干细胞中,miR-125b通过靶向Bcl-2和Bak1基因,调控细胞对化疗药物的敏感性。miR-23b是新近发现的一种具有抑癌基因功能的microRNAs,在肿瘤的多种生理过程中发挥作用,如肿瘤生长、血管形成和侵袭转移等[9],且与多种实体肿瘤的不良预后密切相关[10]。此外,miR-23b在维持肿瘤干细胞特性和分化中,也占有重要地位[11, 12]。本研究采用流式细胞术成功分选出宫颈癌干细胞CD133+CaSki,发现在CD133+CaSki细胞中miR-23b表达水平降低,且CDDP对CD133+CaSki细胞IC50升高,由此推测miR-23b低表达可能导致了CD133+CaSki细胞对CDDP产生耐药性。紧接着,我们将CD133+CaSki细胞转染miR-23b后,IC50降低,提示miR-23b表达增加能够部分逆转细胞对CDDP的耐药性。
microRNAs能够与靶基因信使RNA 3′-UTR特异性结合,导致翻译抑制或者信使RNA降解。此外,研究[13]发现,microRNAs可影响基因启动子区的CpG岛甲基化作用,在转录水平直接对靶基因进行调控。本研究借助于TargetScan数据库,推测miR-23b的潜在靶基因,并对靶基因功能进行初步筛选,选择其中与肿瘤细胞化疗耐药相关的基因进行验证。
药物代谢酶可通过对化疗药物进行代谢解毒,进而影响细胞的化疗敏感性。目前已经发现多个microRNAs通过调节药物代谢酶基因表达,参与肿瘤干细胞的化疗耐药,如miR-24可与二氢叶酸还原酶(DHFR)信使mRNA 3′-UTR结合,抑制DHFR基因表达,而当DHFR信使RNA 3′-UTR发生自发突变时,miR-24无法与之结合,引起DHFR基因过表达,进而导致肿瘤干细胞对甲氨蝶呤产生耐药性[14]。乙醛脱氢酶(ALDHs)是一类NA(D)P+依赖酶,ALDH1A1是ALDHs超家族成员之一。ALDH1A1能够催化醛类物质氧化为羧基,在正常干细胞及肿瘤干细胞中均高表达,参与细胞的自我保护、增殖和分化等[15]。本研究结果显示,ALDH1A1蛋白在CD133+CaSki细胞中表达增加,而CD133+CaSki细胞对CDDP具有耐药性,提示ALDH1A1可能与CD133+CaSki细胞化疗耐药有关。
有研究[16]证实,ALDH1可促进环磷酰胺、CDDP等化疗药物代谢,降低其细胞毒性,导致肿瘤细胞的化疗耐药。本研究选择常用于表达外源基因且容易转染的HEK-293T细胞,检测miR-23b与ALDH1A1 3′-UTR的结合情况,结果证实miR-23b能够与ALDH1A1 3′-UTR结合,抑制ALDH1A1基因表达,由此,我们推测在CD133+CaSki细胞中,miR-23b低表达引起ALDH1A1基因表达增加,进而导致细胞对CDDP产生耐药,这可能是miR-23b介导CD133+CaSki细胞化疗耐药的内在机制之一。
综上所述,在宫颈癌干细胞中,miR-23b通过抑制ALDH1A1基因表达,增强CDDP化疗敏感性。miR-23b具有作为宫颈癌治疗靶分子的潜能。

