卡托普利灌胃后百草枯中毒急性肾损伤大鼠肾组织病理、TNF-α和NF-κB表达及血清IL-6水平变化
李霁,张剑锋,卢俊宇,叶喆,周志兵,罗毅沣,李帅
(1 广西医科大学第二附属医院,南宁530021;2 广西医科大学研究生院)
百草枯是一种广泛应用在农业活动中的快速灭生性除草剂。百草枯对人体的毒性较强,急性中毒可以导致肺、肾、肝等多器官功能损害,尚无特效解毒剂,是临床上常见的致死率较高的急危重症之一,其致死率高达60%~70%[1]。研究[2]显示,百草枯中毒致急性肾损伤患者比例>50%,合并急性肾损伤时患者死亡率>80%。因此,研究百草枯中毒导致的急性肾损伤治疗是当下救治此类中毒患者的思路之一。我们课题组在前期研究[3]中发现,百草枯中毒导致急性肾损伤时会出现IL-6、NF-κB升高,证实炎症反应是白草枯中毒导致急性肾损伤的机制之一。此外,血管紧张素Ⅱ(Ang Ⅱ)被认为是一种重要的炎症介质,介导炎症的反应过程,急性肾损伤的发生与肾素——血管紧张素系统(RAS)的过度活动密切相关[4]。有研究[5]指出,血管紧张素转化酶抑制剂(ACEI)可减少炎症因子的表达,而卡托普利是临床上常用的ACEI,其是否对白草枯中毒致急性肾损伤有治疗作用,目前尚无相关报道。2017年3月~2018年4月,我们采用百草枯灌胃法建立大鼠急性肾损伤模型,在此基础上给予卡托普利灌胃治疗,并观察大鼠肾组织病理变化和肾组织中TNF-α、NF-κB表达及血清IL-6水平变化,探讨卡托普利对百草枯中毒导致的大鼠急性肾损伤可能的治疗机制。
1 材料与方法
1.1 实验动物、主要试剂及仪器 SPF级雄性SD大鼠54只,体质量200 g左右,购自广西医科大学动物实验中心。所有大鼠在室温(20±2)℃下普通饲料饲养,自由进水。二氯百草枯结晶体购自美国Sigma公司,卡托普利粉剂购自美国Solarbio公司。TNF-α、NF-κB一抗分别购于GeneTeX公司和CST公司,IgG二抗购于美国Milipore公司。逆转录试剂盒购于TaKaRa公司,ELISA试剂盒购于华美公司。目的基因引物序列设计合成由南宁科迪公司完成,目的基因碱基序列:β-actin上游引物为5′-GGAGATTACTGCCCTGGCTCCTA-3′,下游引物为5′-GACTCATCGTACTCCTGCTTGCTG-3′;NF-κB上游引物为5′-CAATCAGCCAGCCAACCA-3′,下游引物为5′-CCTTTCCTTTCCTCCCCATC-3′;TNF-α上游引物为5′-GGCGTGTTCATCCGTTCTC-3′,下游引物为5′-CTTCAGCGTCTCGTGTGTTTCT-3′。
1.2 急性肾损伤大鼠模型的建立与卡托普利给予方法 将54只雄性SD大鼠按随机数字法平均分成卡托普利组(Cap组)、染毒组(PQ组)及对照组(NS组),每组18只。实验首日Cap组和PQ组利用百草枯溶液(100 mg/kg)灌胃法建立急性肾损伤模型,NS组利用等量生理盐水建立空白对照;急性肾损伤模型建立后,Cap组大鼠立即使用卡托普利溶液(2 mL/kg)灌胃,PQ组和NS组大鼠立即使用生理盐水(2 mL/kg)灌胃。每间隔24 h Cap组给予卡托普利溶液(2 mL/kg)灌胃、PQ组和NS组给予生理盐水(2 mL/kg)灌胃,常规饲养,观察大鼠一般情况。于模型建立后第1、3、7天分三批次处置大鼠,每批次6只:麻醉后打开大鼠腹腔,取左侧肾脏在4%多聚甲醛中浸泡24 h固定,用于肾组织病理学观察;取右侧肾脏组织用于TNF-α、NF-κB检测;于腹主动脉处用一次性静脉采血针取血,静置至分层后离心,取上清液用于血清IL-6水平检测。
1.3 各组大鼠肾组织病理学检查方法 固定后的左肾组织常规石蜡包埋、切片,待经过脱蜡处理后,行HE染色,应用病理图像分析系统,使用光学显微镜对肾组织的病理变化进行观察。根据刘芙蓉等[6]报道的评级方法,对大鼠肾组织损伤情况进行评级:正常肾组织评定为0级,肾组织轻度损伤评定为I级,肾组织中度损伤评定为Ⅱ级,肾组织重度损伤评定为Ⅲ级。
1.4 各组大鼠肾组织中TNF-α、NF-κB蛋白的检测 采用免疫组化法。取各组肾组织切片,高压修复,血清封闭,分别滴加TNF-α一抗(1∶400)、NF-κB一抗(1∶800)孵育过夜,次日冲洗后加二抗孵育、显色、封片,使用光学显微镜检测TNF-α、NF-κB蛋白的表达情况。每张切片使用400倍光学显微镜取5个不同的视野,统计每个视野中阳性细胞个数,计算阳性细胞率。阳性细胞判定标准:胞浆内可见棕黄色颗粒。
1.5 各组大鼠肾组织中TNF-α、NF-κB mRNA的检测 采用qRT-PCR法。使用TRIzol试剂对肾组织总RNA进行提取,用逆转录试剂盒逆转录RNA成cDNA。内参选用β-actin,选择20 μL体系进行qRT-PCR扩增。反应条件:95 ℃预变性10 min,40个循环(95 ℃变性10 s,60 ℃退火、延伸30 s)。用2-△△Ct表示受检组织中TNF-α、NF-κB mRNA的相对表达量。
1.6 各组大鼠血清IL-6检测 血清解冻后离心,使用ELISA试剂盒对血清IL-6进行检测,严格按照说明书的具体操作要求进行实验。
2 结果
实验开始后,NS组大鼠进食正常,毛发良好,精神状态良好,行动灵活,口鼻无分泌物。PQ组大鼠进食、饮水量较NS组减少,毛发蓬松稀疏,精神疲、行动缓慢,易激惹,口唇及鼻部偶见血性分泌物。Cap组大鼠可见与PQ组类似的中毒症状,但症状较PQ组轻。
2.1 各组大鼠肾组织病理学变化 光镜下NS组可见清晰完整的肾单位结构,肾间质未见水肿、充血及炎性细胞,评级0级。PQ组染毒第1天即可见肿大的肾小管上皮细胞,偶见浸润的炎性细胞及空泡变性,同时伴有管腔狭窄;染毒后第3、7天肾小管上皮细胞可见大片空泡变性、坏死,肾间质可见明显充血水肿,伴有大量浸润的炎性细胞,评级Ⅲ级。Cap组在卡托普利干预后第1天与PQ组病理改变类似,第3天与第1天相比仍存在坏死及空泡变性的肾小管上皮细胞,同时伴有管腔狭窄,肾间质可见浸润的炎性细胞及大量的充血水肿,但情况稍有改善;第7天与第3天比较,肾间质水肿减轻,炎性细胞浸润减少,管腔呈现轻度狭窄,同时肾小管上皮细胞情况改善,可见坏死、空泡变性减少,评级Ⅱ级。上述各组各时间点病理结果如图1所示。
2.2 各组大鼠肾组织中TNF-α、NF-κB蛋白和mRNA的表达比较 Cap组和PQ组大鼠在各时间点肾组织中TNF-α、NF-κB蛋白和mRNA的表达量均高于NS组(P均<0.05);Cap组第3、7天大鼠肾组织中TNF-α、NF-κB蛋白和mRNA的表达量明显低于PQ组(P均<0.05)。Cap组第7天大鼠肾组织中TNF-α、NF-κB 蛋白和mRNA的表达量较第1、3天明显降低(P均<0.05),总体呈现出一定的下降趋势;PQ组第3天大鼠肾组织中TNF-α、NF-κB蛋白和mRNA的表达量较第1、7天明显升高(P均<0.05),达峰值;详见表1。
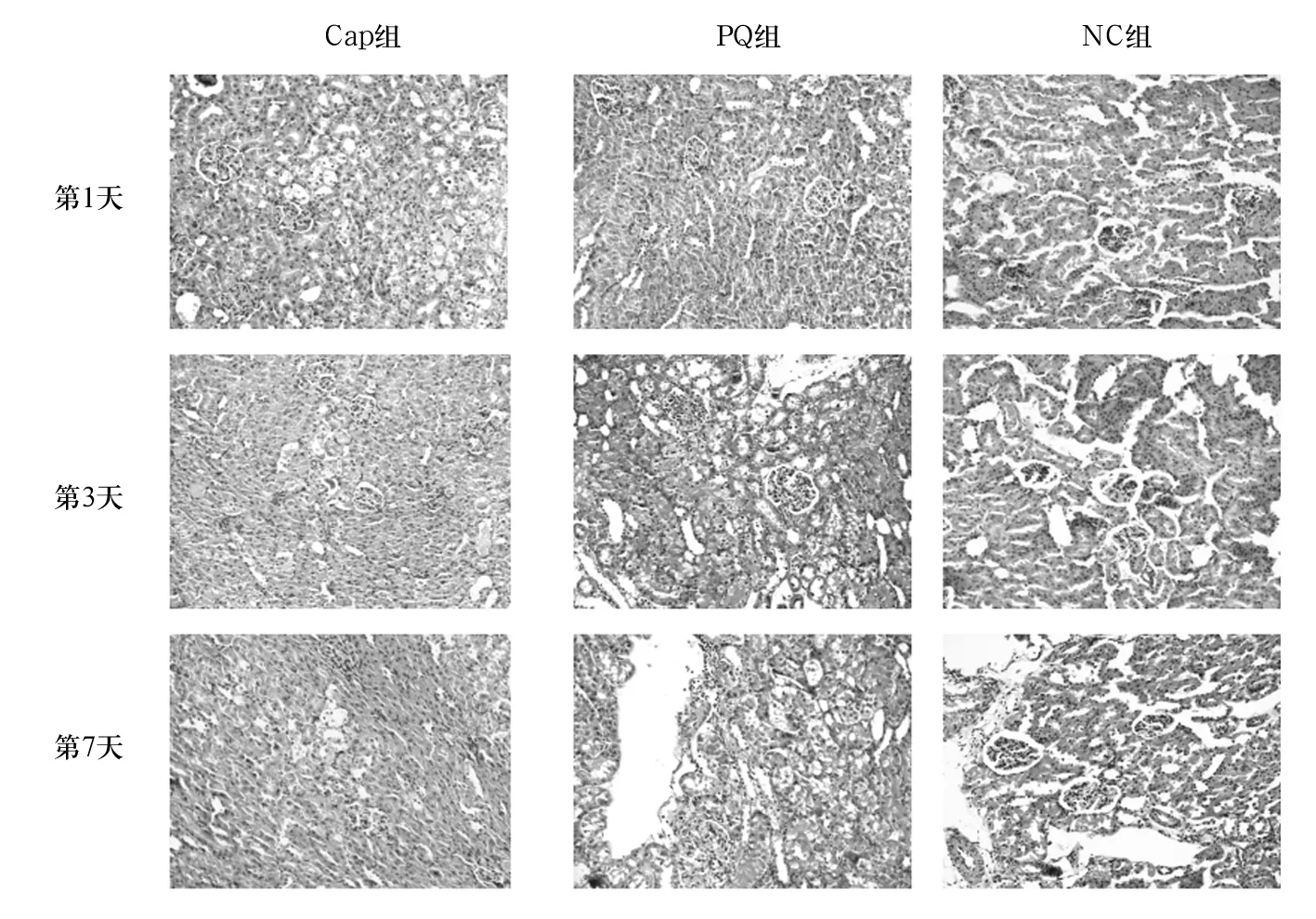
图1 大鼠肾组织病理学变化
2.3 各组大鼠血清IL-6水平比较 Cap组和PQ组在各时间点大鼠血清IL-6水平均高于NS组(P均<0.05);Cap组第3、7天大鼠血清IL-6水平明显低于PQ组(P均<0.05)。Cap组第7天大鼠血清IL-6水平较第1、3 d明显降低(P均<0.05),总体呈现出一定的下降趋势;PQ组第3天大鼠血清IL-6水平较第1、7天明显升高(P均<0.05),达峰值;详见表2。
表1 第1、3、7天各组大鼠肾组织中TNF-α、NF-κB蛋白和mRNA的表达比较
注:与NS组相比,﹡P<0.05;与PQ组相比,﹟P<0.05;与同组第1天相比,△P<0.05;与同组第3天相比,☆P<0.05。
注:与NS组相比,﹡P<0.05;与PQ组相比,﹟P<0.05;与同组第1天相比,△P<0.05;与同组第3天相比,☆P<0.05。
3 讨论
本实验采用百草枯灌胃法构建大鼠急性肾损伤模型,病理形态学可见各时间点肾组织细胞损伤程度不同,肾小管上皮细胞可见大片空泡变性、坏死,肾间质可见明显水肿充血,伴有大量浸润的炎症细胞;肾组织中NF-κB、TNF-α蛋白和mRNA表达量及血清IL-6水平显著升高,表明百草枯中毒大鼠急性肾损伤模型建立成功。
炎症反应是百草枯中毒的主要机制之一。Xu等[7]发现,百草枯中毒导致急性肾损伤通过激活多种炎症因子参与到肾脏炎症的发生,如TNF-α、IL-6等。IL-6能上调内皮细胞黏附分子,诱导淋巴细胞活化、分化,同时刺激B细胞表达抗体,激活急性期炎症反应[8]。IL-6循环水平的升高是炎症反应的可靠标志。单核巨噬细胞可以表达TNF-α,TNF-α对细胞增殖及分化存在一定的促进作用,同时,它能够刺激并启动NF-κB相关信号通路的传导,因此,TNF-α被认为是调控百草枯中毒导致的炎症反应的重要因子[9]。活化的NF-κB可通过对其下游相关的炎症因子进行调控及其他可以激活炎症反应的信号传导通路形成复杂的信号传导网络[10],通过NF-κB刺激TNF-α、IL-1β、IL-6、IL-18等炎症细胞因子的合成和释放,进而推动炎症级联反应,引起全身炎症反应综合征。肾脏是百草枯中毒损伤的主要靶器官之一,同样存在潜在的损害[11]。NF-κB可在多种细胞内被激活,对协调炎症趋化因子和细胞因子基因的表达起关键性调控作用,是激活并介导炎症反应较为关键的信号通路[12]。而炎症细胞因子的释放会对炎症级联反应产生正反馈效应,进一步激活NF-κB,同时触发局部炎症,激活中性粒细胞,加快炎症反应的进展,造成肾小管细胞的坏死[13]。本研究结果显示,各时间点PQ组肾组织中NF-κB、TNF-α蛋白和mRNA的表达量、血清IL-6水平较NS组均明显升高,这与上述研究所描述的结果一致,证实百草枯中毒导致急性肾损伤有炎症反应的参与。
Ang Ⅱ作为RAS中的主要活性物质之一,主要作用于血管紧张素Ⅱ 1型受体(AT1R),与其结合发挥作用。被Ang Ⅱ激活的AT1R可以直接活化NF-κB进而激活炎症反应[14]。同时,Ang Ⅱ还可以调控其他能够参与炎症反应的信号通路,激活NF-κB,刺激IL-6、TNF-α等炎症因子的释放[15]。因此,Ang Ⅱ被认为是一种重要的炎症因子。卡托普利是第一类ACEI药物,在临床上广泛使用,它能有效阻止血管紧张素Ⅰ(Ang Ⅰ)转换为Ang Ⅱ,降低Ang Ⅱ水平。研究[16~18]指出,应用卡托普利可以抑制NF-κB的信号传导,降低IL-6、TNF-α等炎症因子的表达。本研究Cap组结果显示,与PQ组大鼠相比,卡托普利可以明显降低第3、7天肾组织中NF-κB、TNF-α蛋白和mRNA的表达量以及血清IL-6的水平,这与上述研究报道的结果相符。此外,Cap组大鼠NF-κB、TNF-α、IL-6的含量呈逐渐下降趋势,第3天减低不明显,但第7天明显减低,可以认为卡托普利在逐渐缓解肾脏炎症,延缓急性肾损伤病程,对百草枯中毒导致的急性肾损伤存在一定程度的保护作用。
综上所述,百草枯致急性肾损伤时,卡托普利可以抑制肾组织中NF-κB、TNF-α蛋白和mRNA的表达并降低血清IL-6的水平,改善肾脏炎症反应,从而减轻肾脏损伤,这可能是卡托普利治疗百草枯中毒导致急性肾损伤的作用机制之一。

