胸腺五肽对黑色素瘤细胞诱导的肿瘤浸润树突状细胞激活作用观察
王立慈,王海生,方增军,张斌,张婕,李娟
(山东大学第二医院,济南250033)
研究[1]显示,黑色素瘤的发病率和病死率呈逐年上升趋势。目前,黑色素瘤的治疗方法有放疗、化疗、手术治疗及免疫疗法[2, 3],但是这些治疗方法还存在治疗效果差、不良反应大等不足[4~6]。树突状细胞(DCs)是专职抗原递呈细胞,具有捕获、加工和递呈抗原的能力,成熟的DCs能够诱导T细胞活化为肿瘤特异性细胞毒性T细胞(CTL),能分泌共刺激分子(CD80、CD86)、主要组织相容性复合体Ⅱ(MHCⅡ)和细胞因子IL-12等,发挥免疫调节作用[7]。因CD80、CD86、MHCⅡ、IL-12等细胞因子只能在成熟DCs中高表达,又被称为DCs的成熟标志分子。肿瘤组织中浸润有大量的DCs,即肿瘤浸润树突状细胞(TIDCs),然而,肿瘤细胞及肿瘤微环境释放因子会抑制或逆转DCs的成熟及正常功能,导致黑色素瘤组织中的TIDCs处于未成熟状态,只能表达低水平的CD80、CD86[8]、IL-12[9]和跨膜糖蛋白CD11c[10]。DCs也能分泌具有免疫抑制作用的细胞因子IL-10。肿瘤发生免疫逃逸主要归因于肿瘤特异性MHC-Ⅰ限制性CTL的活化不足,而不成熟TIDCs上低表达的共刺激分子可能是CTL激活失败的主要原因。因此,TIDCs已成为控制肿瘤逃逸最有希望的靶标之一。胸腺五肽(Thymopentin,TP5)是由5个氨基酸组成的短肽,能增强化疗或放疗患者受抑制的免疫功能,已被作为一种重要的免疫调节剂成功用于恶性肿瘤的临床辅助治疗。报道[11]显示,TP5能诱导骨髓来源树突状细胞(BMDCs)的成熟,促进BMDCs表面成熟标志分子的表达。然而,TP5能否诱导TIDCs的成熟还未有报道。2017年9月10日~2018年7月15日,我们观察了不同浓度的TP5对黑色素瘤细胞诱导的TIDCs的激活作用,现报告如下。
1 材料与方法
1.1 细胞、实验动物、TP5、试剂及仪器 黑色素瘤细胞B16为本实验室保存。BALB/c小鼠购自北京维通利华实验动物有限公司,在室温以及安静的环境下进行喂养,日照时间为每天7:00~19:00,由专业动物饲养人员每日给小鼠提供足够的食物和水。TP5购自上海强耀生物科技有限公司。DMSO及胰蛋白酶购自碧云天生物技术有限公司。血清购自GIBCO公司,培养基购自BI公司。ELISA试剂盒购自江苏科晶生物科技有限公司。PE-CD86、APC-MHCⅡ、FITC-CD11c购自美国Biolegend公司。IL-4、重组鼠粒细胞/巨噬细胞集落刺激因子(GM-CSF)购自美国Proteintech公司。小鼠IL-12及IL-10 ELISA试剂盒购自上海恒远生物科技有限公司。二氧化碳培养箱购自美国Thermo公司。超净工作台购自苏州净化设备厂。台式高速离心机购自美国Eppendorf公司。倒置相差显微镜购自日本olympus公司。电子天平购自上海天平仪器厂。流式细胞仪购自美国Becton-Dickinson FACS Calibur公司。
1.2 TIDCs的诱导培养及鉴定 将对数生长期的黑色素瘤细胞B16在无血清培养基中培养24 h,收集上清即得B16细胞条件培养基,经过0.22 μm滤膜过滤后分装并于-80 ℃保存备用[12]。BALB/c小鼠脱颈处死,剥离出完整的股骨,从股骨中收集细胞悬液培养于RPMI1640培养基中,加入IL-4和重组鼠GM-CSF,37 ℃培养48 h后去除非贴壁细胞,重新加入含有IL-4及重组鼠GM-CSF的RPMI1640培养基,隔天换液,诱导培养至第5天时,加入50% B16细胞条件培养基继续诱导培养2 d,用倒置相差显微镜拍照鉴定TIDCs。
1.3 TIDCs中CD11c、CD86、MHCⅡ和IL-12、IL-10的检测方法 将培养鉴定后的TIDCs接种于96孔板中,分别将0、10、20、40 μmol/L的TP5加入TIDCs中,记为0 μmol/L组、10 μmol/L组、20 μmol/L组、40 μmol/L组,37 ℃共同孵育48 h,分离出TIDCs细胞和上清液。取收集到的TIDCs细胞,PBS洗涤2遍后加入冰预冷的PBS 100 μL与大鼠血清10 μL,4 ℃封闭30 min,加入荧光标记的CD11c、CD86及MHCⅡ抗体,4 ℃孵育45 min,PBS洗涤2遍,用流式细胞仪进行检测,以平均荧光强度值表示TIDCs表面CD11c、CD86、MHCⅡ的表达量。取TIDCs细胞上清液,按ELISA试剂盒说明书测定TIDCs中IL-2和IL-10。
1.4 TP5 与TIDCs的结合情况观察 向TIDCs细胞培养皿中加入FITC 标记的1μg/mL TP5溶液200 μL,37 ℃孵育2 h,PBS洗涤后用4%中性多聚甲醛溶液固定,然后加入细胞核染料Hoechst 33342,室温染色10 min,PBS洗涤后加入抗荧光淬灭剂200 μL,激光共聚焦显微镜下观察TP5与TIDCs的结合情况。
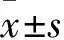
2 结果
2.1 TIDCs的诱导培养结果 倒置相差显微镜低倍镜下可见细胞聚集成集落的细胞群,呈半贴壁状态(图1A);高倍镜下可见细胞已经呈现典型的树突状形态(图1B),有的细胞出现短的出芽状突起,有的细胞已经出现长长的突起,提示TIDCs诱导培养成功。
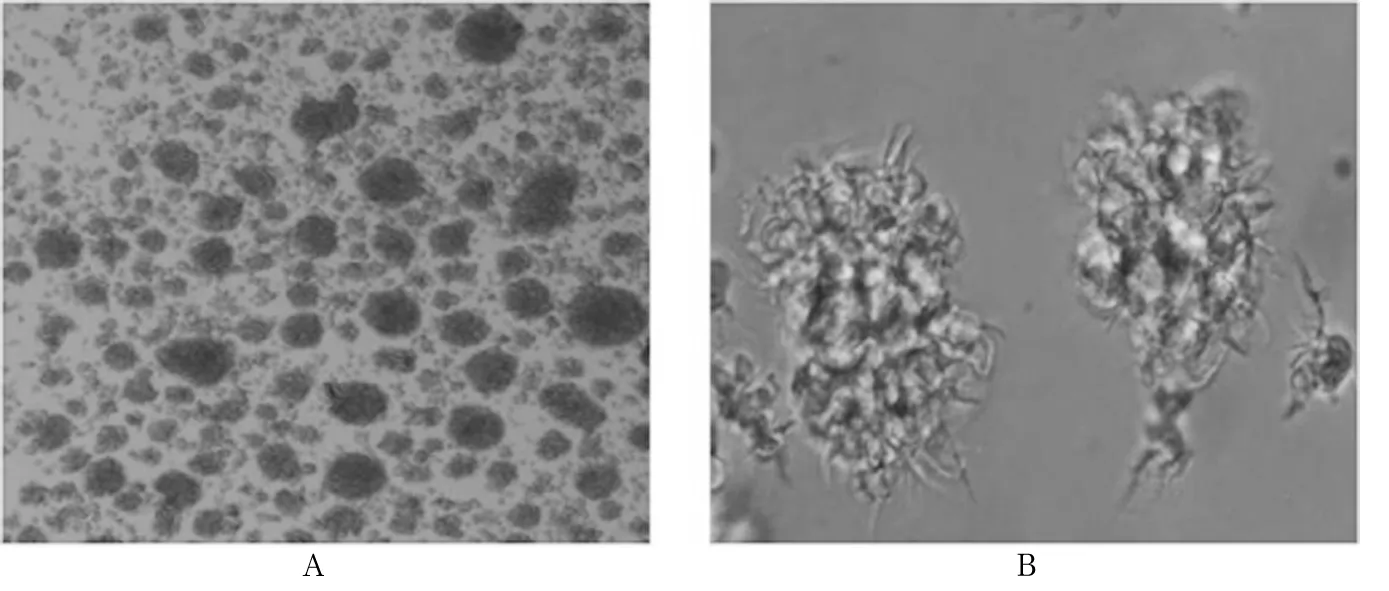
注:A为低倍镜下(×40)的TIDCs细胞;B为高倍镜下(×100)的TIDCs细胞。
图1倒置相差显微镜下B16细胞诱导培养的TIDCs细胞形态
2.2 TIDCs中CD11c、CD86、MHCⅡ和IL-12、IL-10的表达量比较 结果见表1。
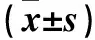
表1 TIDCs中CD11c、CD86、MHCⅡ和IL-12、IL-10的表达量比较
注:与0 μmol/L组相比,﹡P<0.05;与10 μmol/L组相比,﹟P<0.05;与20 μmol/L相比,△P<0.05。
2.3 TP5 与TIDCs的结合情况 激光共聚焦显微镜下可见,TIDCs的细胞核呈椭圆形,FITC标记的TP5分布在细胞核周围,提示TP5结合在TIDCs的细胞膜上及胞质中。
3 讨论
肿瘤的治疗是世界性的难题,这主要与肿瘤细胞所处的复杂的肿瘤微环境有关。肿瘤微环境中不仅有肿瘤细胞,还有很多免疫细胞,如效应T细胞、TIDCs、肿瘤相关巨噬细胞等。研究[13]发现,肿瘤病灶中的TIDCs并不能产生有效的免疫反应而影响肿瘤的生长,说明肿瘤组织中的TIDCs 出现功能受损。TIDCs 的功能受损是多方面的,如表达于TIDCs上的共刺激分子B7-H3能够抑制CD4+T 淋巴细胞活化以及IFN-γ、IL-4等细胞因子的产生发挥抑制作用[14];γδTreg 细胞可以诱导DC细胞衰老,从而影响其功能[15];肿瘤细胞可以通过释放IL-10、IL-6、GM-CSF、转化生长因子-β1(TGF-β1)、VEGF等细胞因子阻碍DCs的分化和抗原提呈功能。此外,肿瘤细胞一方面可以直接激活髓样抑制细胞(MDSC)使肿瘤细胞逃逸免疫监视[16],另一方面能通过分泌吲哚-2, 3-双加氧酶等多种因子促使DCs分化成高分泌IL-6、TNF-α的细胞,促进2型辅助性T细胞(Th2)分化,影响细胞免疫在抗肿瘤中的作用。因此,应用免疫调节剂来促进TIDCs的成熟与活化在抵抗肿瘤生长方面具有重要意义。TP5保留了胸腺生成素Ⅱ的生物活性,具有双向调节免疫系统的功能,能使过强或受到抑制的免疫反应趋向于正常,同时其对机体免疫功能低下、自身免疫疾病具有很好的调节作用。对于癌症或感染性疾病患者而言,TP5是有效的细胞因子,体外和体内的早期研究[17]结果已证明其在宿主和适应性细胞免疫应答中具有免疫调节的作用。
DCs能够分泌多种细胞因子,这些细胞因子在促进DCs发挥免疫调节作用方面具有重要作用。CD11c是高表达于DCs上的跨膜糖蛋白,其作为靶向受体,参与肿瘤抗原的捕捉和呈递,并能有效刺激 CD4+T细胞增殖、活化,分泌 IL-2。研究[18]显示,CD11c还可诱导 CD8+T细胞活化,分泌高水平的干扰素 IFN-γ,从而增强 T 细胞的细胞毒功能,抑制肿瘤的形成和进展。CD86是表达于DCs、单核细胞及激活的T细胞上的分子,能提供T细胞活化所需的共刺激信号,在诱导CTLs的产生及功能的发挥方面具有重要作用。MHCⅡ表达于B细胞、单核-巨噬细胞和DCs等抗原递呈细胞上,其功能主要是在免疫应答的始动阶段将经过处理的抗原片段递呈给CD4+T细胞,MHCⅡ的表达量体现了细胞抗原递呈能力的强弱。IL-12主要由DCs、巨噬细胞、单核细胞和B细胞等抗原递呈细胞分泌,是连接固有免疫和适应性免疫的纽带[19]。IL-10是一种Th2型细胞因子,是目前发现的一个重要的免疫抑制性下调因子,能直接抑制T细胞的功能,还能抑制CD86、CD80等共刺激分子的表达,从而抑制抗原递呈的功能。在本研究中,TIDCs经TP5作用后表达共刺激分子的能力显著提高,IL-12分泌量逐渐提高,说明TIDCs被TP5活化。相反,IL-10的分泌量却随TP5浓度的升高而逐渐减少,可能原因是TP5促进了IL-12的分泌,增加的IL-12进而抑制了IL-10的分泌。
本研究结果显示,TP5可促进TIDCs表面成熟标志分子CD11c、CD86及MHCⅡ的表达,促进TIDCs分泌IL-12及抑制IL-10的分泌,表明TP5能够激活免疫活性受抑制的TIDCs的抗原递呈功能,在特异性免疫应答中发挥重要作用。

