培哚普利联合氢氯噻嗪对原发性高血压患者血清内皮活性因子及炎症因子的影响
申文宇
(南阳市中心医院,河南南阳473000)
血管内皮细胞结构和功能的改变是多种心血管疾病的共同病理基础。而血管内皮功能障碍会导致血管紧张性调节功能障碍,抗血栓及抑制血管壁炎症反应的能力下降,加速动脉粥样硬化的进程。研究表明,原发性高血压患者血管内皮结构和功能严重损伤[1]。血管内皮功能障碍后炎症因子如IL-1、IL-6和超敏C反应蛋白(hs-CRP)等参与了机体的炎症反应,与原发性高血压的发生密切相关[2,3]。氢氯噻嗪是临床常用的降压药物,但降压作用有限,常需要联合其他降压药物,而血管紧张素转化酶抑制剂(ACEI)是临床上常用的联合降压药物之一,培哚普利是一种组织亲和力较高的长效ACEI,在抑制
血管紧张素Ⅱ(AngⅡ)的同时,还可以恢复内皮功能、抗动脉粥样硬化、改善高血压[4]。本研究旨在探讨培哚普利联合氢氯噻嗪对原发性高血压患者血管内皮活性因子及血清炎症因子的影响。现报告如下。
1 资料与方法
1.1 临床资料 选取2013年3月~2014年12月我院心血管内科收治的原发性高血压患者108例,其中男68例、女40例,年龄37~75(52.42±7.63)岁,入选患者均符合《中国高血压防治指南2010》的参考标准[5],为1级或2级高血压,其中1级原发性高血压56例、2级原发性高血压52例。随机分为观察组和对照组各54例。纳入标准:收缩压>140 mmHg和(或)舒张压>90 mmHg;既往已服用降压药控制血压。排除标准:继发性高血压;心、脑、肝、肾功能异常或器质性病变;有严重心、肝、肺、肾急慢性病史;有严重感染和恶性肿瘤史等。两组年龄、性别、疾病严重程度等一般资料比较差异无统计学意义。本研究经医院医学伦理委员会批准,所有患者及家属均签署知情同意书。
1.2 治疗方法 两组均给予限盐、低钠饮食、运动锻炼、减轻体质量等基础治疗。对照组给予氢氯噻嗪12.5 mg、1次/d,观察组除口服氢氯噻嗪外给予培哚普利4 mg、1次/d,均清晨空腹口服,持续治疗8周。两组服药4周后若血压<140/90 mmHg,则继续原方案治疗至研究结束,否则培哚普利的剂量倍增。观察期间,除治疗药物外禁用其他影响血压的药物。
1.3 检测指标 ①血压:采用台式血压计,治疗前后取卧位测其右上臂肱动脉收缩压、舒张压,连续测3次,每次间隔0.5 min,取3次平均值。②血清内皮活性因子水平:采用发射免疫法和硝酸还原酶法检测血清内皮活性因子内皮素1(ET-1)、一氧化氮(NO)水平。③血清炎症因子水平:治疗前后分别采清晨空腹静脉血3 mL,采用ELISA法测定血清炎症因子IL-1、IL-6及hs-CRP水平,用全自动生化分析仪测定。④不良反应:比较两组治疗后不良反应情况。

2 结果
2.1 两组治疗前后血压比较 治疗后观察组收缩压、舒张压均低于对照组(P均<0.05)。见表1。
2.2 两组治疗前后血清内皮活性因子比较 治疗后两组血清NO水平均升高,ET-1水平均降低(P均<0.05);治疗后观察组血清NO水平高于对照组,ET-1水平低于对照组(P均<0.05)。见表1。
2.3 两组治疗前后血清炎症因子水平比较 治疗后观察组血清IL-1、IL-6及hs-CRP水平均低于治疗前(P均<0.05);观察组治疗后血清IL-1、IL-6及hs-CRP水平均低于对照组(P均<0.05)。见表1。
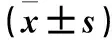
表1 两组治疗前后血压、血清内皮活性因子及炎症指标水平比较
2.4 两组不良反应比较 观察组干咳2例、乏力1例,对照组出现乏力1例,均能耐受。两组不良反应发生率比较差异无统计学意义(P>0.05)。
3 讨论
研究显示,原发性高血压患者在缺氧和血流切应力改变等因素的影响下,血管内皮功能失调,使机体正常情况下维持血管张力的平衡状态被打破,以NO为主的血管舒张因子分泌减少,而以ET-1为主的血管收缩调节因子分泌增加,使得血管急剧收缩,外周阻力显著增大[6],临床上主要表现为内皮依赖性舒张功能减退。而这样的失衡状态可使原发性高血压患者的病情加重[7]。因此,降低原发性高血压患者血压的同时,还应修复内皮细胞、改善内皮功能障碍。培哚普利是一种长效的ACEI,可以抑制血管紧张素转化为AngⅡ,减轻AngⅡ的缩血管作用,不灭活缓激肽,达到降压作用,还可减少前列环素、NO等舒血管因子释放,改善内皮细胞功能并减少其凋亡,抑制平滑肌细胞的生长、增殖和迁移,减少血小板聚集,从而达到稳定斑块、减少血栓形成、恢复血管内皮功能的作用[8]。本研究发现,治疗后观察组收缩压、舒张压均低于对照组,提示培哚普利与氢氯噻嗪的联合使用可使患者血压降低,降压效果显著优于单用氢氯噻嗪。
ET-1和NO是由血管内皮细胞合成和释放的血管活性物质,可维持血管内膜结构,调节血管正常收缩功能,在心血管功能调节中起重要作用[9]。ET-1主要由血管内皮细胞合成和释放,是迄今所知最强的缩血管物质,亦是一种内源性长效血管收缩调节因子。在组织缺氧、氧化代谢增强及儿茶酚胺水平增高等内皮功能受损的情况下,都会使得ET-1的水平升高[10]。NO也称内皮依赖的血管舒张因子,对血管有舒张作用,可调节血压抑制血细胞黏附,抑制内皮下细胞增殖[11]。二者在原发性高血压的发生发展中都起着至关重要的作用。研究发现,培哚普利可以减少AngⅡ,从而减少AngⅡ介导的ET-1分泌;抑制血管加压素系统,减少加压素介导的ET-1分泌;还可以抑制血小板凝集,抑制血栓的形成,减轻内皮细胞的损伤,从而使得血液中ET-1分泌减少和NO释放增加,既保护了内皮功能还减轻患者的高血压症状[12,13]。本研究发现,治疗后观察组血清NO水平高于对照组、ET-1水平低于对照组,提示培哚普利可以通过抑制ET-1分泌及促进NO释放达到保护内皮功能及降压作用。
研究显示,除了内皮功能障碍,血管壁炎症反应亦是原发性高血压的发病机制,在原发性高血压中,由于血流切应力改变等因素导致内皮功能的失调或损伤,而内皮功能的失调或损伤,使得机体抗血栓及抑制血管壁炎症反应的能力下降,从而导致炎症反应的发生[14]。IL-1、IL-6和hs-CRP等炎症因子的大量释放,将会加重原发性高血压的进展[15]。研究发现,炎症介质IL-1、IL-6和hs-CRP大量释放,可产生细胞毒作用,进一步破坏血管内皮细胞和功能[16];可激活其他炎症细胞,产生更为严重的炎症反应,损伤内皮细胞;亦可促进血栓形成和激活血管收缩调节因子ET-1,增加血管阻力,加重病情。因此,减轻原发性高血压患者炎症反应的发生亦尤为重要[17]。本研究发现,观察组治疗后血清IL-1、IL-6及hs-CRP水平均低于对照组,考虑其原因可能是由于培哚普利联合氢氯噻嗪可以更好地改善内皮功能障碍,使血管内皮抗血栓及抑制血管壁炎症反应的能力得以恢复,故炎症细胞因子产生和释放减少,由其介导的炎症反应减轻。
综上所述,培哚普利联合氢氯噻嗪可以显著降低原发性高血压患者的血压,改善患者血管内皮功能、抑制炎症反应,值得临床应用。

