补体因子H、补体因子H相关蛋白在IgA肾病诊断中的应用价值
郑笑,谢大星,郭广凤,杨淑芬,陆晨
(1安徽医科大学新疆临床学院,乌鲁木齐830001;2新疆维吾尔自治区人民医院)
IgA肾病(IgAN)是全球范围内最为常见的一种原发性肾小球疾病,临床表现为反复发作性的肉眼血尿或镜下血尿,可伴有不同程度蛋白尿,部分患者亦可出现高血压或肾功能不全,但大部分患者并没有典型的临床症状,故易造成漏诊[1]。早期准确的诊断对于IgAN的临床治疗和预后具有重要意义。血浆补体因子H(CFH)和补体因子H相关蛋白(CFHRP)1、CFHRP5是一类在补体激活途径中起调节作用的血浆蛋白,其中CFH在补体活化过程中发挥抑制作用,而CHFRP1和CFHRP5则通过竞争性结合CFH表面配体,影响CFH的抑制功能,这种相互作用的平衡度决定了补体系统激活的程度。对于大多数的IgAN患者,病程为慢性炎症过程,大量的炎症介质可导致补体系统过度激活,产生过多的补体活化产物会加重细胞与组织损伤[2,3]。目前少有与CFH及CFHRP1、CFHRP5对IgAN诊断价值的相关报道。本研究分析了血浆CFH、CFHRP1、CFHRP5在IgAN诊断中的价值,为IgAN的诊断寻找新的生物学指标提供依据。
1 资料与方法
1.1 临床资料 选取2017年1月~2018年5月新疆维吾尔自治区人民医院肾病科收治的疑似IgAN患者157例,男97例、女60例,年龄(42.32±13.55)岁,汉族82例、维吾尔族61例、其他少数民族14例。另选取60例健康体检者做健康对照组,男39例、女21例,年龄(41.6±12.30)岁,汉族36例、维吾尔族20例、其他少数民族4例。收集受试者肾功能相关指标包括血肌酐、尿素氮、血清IgA、血清C3、肾小球滤过率(eGFR,采用改良简化的MRDR方程[9]估算)、24 h尿蛋白定量等资料。疑似IgAN患者与健康体检者年龄、性别及民族差异均无统计学意义(P均>0.05)。本研究经医院伦理委员会批准,所有入组对象均签署知情同意书。
1.2 肾组织病理检查 以肾组织病理检查结果为确诊IgAN的金标准。157例疑似IgAN患者均在B超引导下行肾活检术,取肾脏组织2或3条,所取肾脏组织肾小球总数≥10个,肾活检标本行HE、PAS、PASM及Masson染色,光镜观察肾小球、小管-间质病变性质及程度;冰冻切片行免疫荧光染色于荧光显微镜观察各种免疫球蛋白及补体在肾脏中的沉积部位、分布特点及强度;电镜检查对所取肾组织用3.75%的冷戊二醛固定,1%四氧化锇后固定,超薄切片厚度70~90 nm,醋酸铀、柠檬酸铅双染色,置于Hitachi 7500透射电镜下观察。IgAN诊断由肾病科专科医师和肾脏病理医师商讨后作出,诊断依据为邹万忠编著的《肾活检病理学(第2版)》[4]和1995年WHO发布的第2版肾小球疾病病理学分类[5]。
1.3 血浆CFH、CFHRP1、CFHRP5水平检测 收集受试者晨血2 mL,于EDTA抗凝管内离心,收集上清液于冻存管内,-80 ℃保存备用。采用酶联免疫吸附(ELISA)法检测血浆CFH、CFHRP1、CFHRP5水平。在酶标包被板上设置标准品孔,加入标准品,并按要求稀释成不同浓度梯度。分别在酶标包被板剩余孔里设置空白孔和待测样品孔,在待测样品孔中分别依次加入样品稀释液和待测血浆样本,轻轻晃动均匀。除空白孔外,每孔加入酶标试剂,在37 ℃温箱中温育30 min后用自动洗板机冲洗5次。在酶标包被板各孔中分别依次加入显色剂A和显色剂B,混匀后放入37 ℃恒温箱内避光显色10 min。每孔加入终止液,终止反应。用酶标仪以空白孔调零,在450 nm波长下读取各孔光密度(OD)值并做记录。以标准物的浓度为横坐标,OD值为纵坐标,绘制标准曲线,根据血浆样本的OD值计算出相应的浓度。

2 结果
2.1 IgAN确诊结果 经肾组织病理检查,确诊IgAN(IgAN组)89例、其他肾脏疾病(其他肾脏疾病组)68例。
2.2 各组肾功能相关指标比较 IgAN组尿素氮、血清IgA、血清C3、24 h尿蛋白定量水平高于健康对照组及其他肾脏疾病组,eGFR低于健康对照组及其他肾脏疾病组(P均<0.05)。见表1。
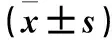
表1 各组肾功能相关指标比较
2.3 各组血浆CFH、CFHRP1、CFHRP5水平比较 IgAN组血浆CFH水平均低于其他两组,而血浆CFHRP1、CFHRP5水平均高于其他两组(P均<0.05)。见表2。
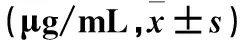
表2 各组血浆CFH、CFHRP1、CFHRP5水平比较
2.4 血浆CFH、CFHRP1、CFHRP5对IgAN的诊断价值 血浆CFH、CFHRP1、CFHRP5诊断IgAN的灵敏度分别为85%、69%、60%,特异度分别为71%、77%、71%;ROC曲线显示上述三种指标的AUC均大于0.7,其中CFH的AUC最大(0.862)。见表3。
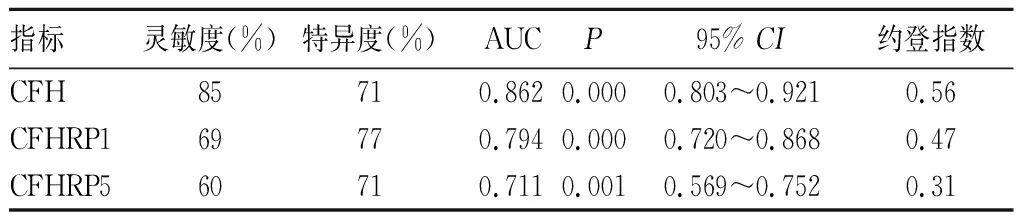
表3 血浆CFH、CFHRP1、CFHRP5对IgAN的诊断价值
3 讨论
在我国,IgAN占原发性肾小球疾病的40.0%~47.2%,是导致慢性肾脏病(CKD)的重要原因,尤其多见于年轻人,30%~40%的IgAN患者在确诊后10~20年内将发展成终末期肾病(ESRD)[6],病死率约是正常人群死亡率的2倍[7]。IgAN发病较为隐匿,常无典型临床症状,诊断依赖于肾活检术和术后组织病理学免疫病理分析,但肾活检为一项有创性检查,价格昂贵且并发症多(如血尿、肾周血肿、动静脉瘘等),在一定程度上影响了临床早期诊断和治疗。故研究血浆指标在IgAN中的诊断价值,不仅有助于患者的早期诊断,无并发症且价格低廉。
近年研究表明,IgAN是由抗甘聚糖抗体结合的半乳糖缺陷型IgA1组成的致病性免疫复合物介导的自身免疫性疾病[1],系膜区沉积的多聚体IgA1能活化系膜细胞,可诱导细胞外基质增生及细胞因子分泌而导致肾脏组织的损伤[8],补体替代途径和凝集素途径在IgAN的发病机制中发挥重要作用,其中补体活化是IgAN发生及发展的重要机制[9]。
Medjeral-Thomas等[10]研究发现,IgAN患者血浆CFHRP1、CFHRP5水平高于健康对照组,并且高CFHRP1/CFH比值与较高的CFHRP5水平及疾病快速进展相关,认为CFHRP1和CFHRP5在IgAN进程中均起一定作用。研究发现,IgAN患者的血浆CFHRP1水平相对较高而CFH相对较低,由IgAN导致的CKD患者的血浆CFHRP1水平及CFHRP1/CFH比值均升高[11]。而另一项小样本的研究表明,IgAN患者血浆中的CFHRP1的水平是显著升高的,并与其疾病的进展有关,表明CFHRP1的水平高低有助于判断疾病进展是否存在高风险[12]。目前已有学者认识到,在补体激活途径中相关调节蛋白的基因多态性可能影响IgAN的进程及临床转归[13]。近年来全基因组关联研究鉴定已确认1q32为IgAN易感性位点,并发现此位点位于补体激活途径的调控区域,表明IgAN中可能存在CFH和(或)CFHRP基因的遗传改变,而该区域恰好就包含了CFH、CFHRP1、CFHRP5[14]。CFH、CFHRP1、CFHRP5基因的变异会影响补体系统的激活,从而导致IgAN的发生[15]。进一步的研究表明,CFH、CFHRP1、CFHRP5基因的缺失是补体调控区域的致病性遗传变异,并且与IgAN患者的间质损伤密切相关[16]。对CFHRP5基因与IgAN遗传易感性的研究发现,IgAN患者的CFHRP5基因中稀有变体的分布与健康对照组相比有显著差异,而且CFHRP5与其基因的罕见变异体有着明显的遗传关联性,并且也进一步证实了CFHRP5基因中一些稀有变体使其蛋白与C3b结合能力受损而导致C3的沉积,这表明CFHRP5基因是IgAN的易感基因[17]。
本研究发现,IgAN组尿素氮、血清IgA、血清C3、24 h尿蛋白定量水平高于健康对照组及其他肾脏疾病组,eGFR低于健康对照组及其他肾脏疾病组,提示IgAN患者的病情程度较重、肾脏病变较重;IgAN组血浆CFH水平低于其他两组,血浆CFHRP1、CFHRP5水平均高于其他两组,提示CFH、CFHRP1、CFHRP5与IgAN之间存在一定的关联,可能与IgAN病情程度有一定关系;ROC曲线显示CFH、CFHRP1、CFHRP5诊断IgAN的AUC均大于0.7,其中CFH的面积最大(0.862),CFH和CFHRP1、CFHRP5诊断的灵敏度分别为85%、69%、60%,特异度分别为71%、77%、71%,可见CFH在IgAN的诊断上更具优势。这可能与IgAN患者本身的某种致病基因的表达有关,表明CFH在IgAN的诊断中具有一定的意义。
综上所述,血浆CFH、CFHRP1、CFHRP5与IgAN的诊断存在一定的关联性,对诊断IgA肾病均具有一定价值,其中CFH的诊断价值较高,但具体的作用机制尚不明确,需要后续进一步的研究来阐明。

