美拉德反应对南极磷虾酶解液中非挥发性物质的影响
许丹,方益,何鹏飞,严忠雍,黄丽英,张小军
(浙江省海洋水产研究所,农业部重点渔场渔业资源科学观测实验站,浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江舟山316021)
南极磷虾(Euphausia superba)主要分布于南极洲水域,属于高纬度低温条件下生长的冷水虾类,储量巨大,全球资源的总量预估6.5亿吨~10亿吨,每年捕捞量达到4 500万吨~1亿吨,是全球重要的蛋白质资源之一[1-2]。南极磷虾营养丰富,具有低脂肪、高蛋白的特点,蛋白含量可占全虾鲜重的16.04%~17.81%,含有人体所需的全部氨基酸,8种必需氨基酸含量较高[3],其中赖氨酸含量远远高于金枪鱼、南美白对虾和牛肉的含量[4]。此外,其富含多种不饱和脂肪酸,约占总脂类含量的49.1%~67.6%,其中DHA和EPA所占比例为89.2%和79.1%[5];全虾中钙、钾、镁等多种矿物质元素含量为3.37%,磷虾肌肉中含量为2.36%[3],除上述营养物质外,南极磷虾体内的类胡萝卜素量较高,尤其是眼球部,约占总量的25%[6]。由于南极磷虾所含营养价值较高,在加工上存在着巨大潜力,近年来受到越来越多研究人员的关注[3,7]。
对于食品而言,风味质量包括挥发性成分和非挥发性成分两个方面。挥发性成分决定了食品的气味特征,而非挥发性成分不仅影响食品的滋味,还是绝大多数挥发性成分的前体物质,对食品风味的产生有着十分重要的作用,主要包括含氮化合物(游离氨基酸、呈味核苷酸及其关联化合物、甜菜碱、短肽)和不含氮化合物(有机酸、糖原、无机离子)等[8]。
目前南极磷虾资源的研究多集中于酶解工艺、酶解液美拉德反应工艺及挥发性物质分析等方面,而南极磷虾酶解液美拉德反应产物中非挥发性物质的相关研究很少。因此,本试验以南极磷虾酶解液为原料,与木糖进行美拉德反应,利用理化分析法对美拉德反应前后的呈味成分,包括含氮化合物和不含氮化合物进行分析,研究美拉德反应对南极磷虾酶解液中非挥发性物质的影响。
1 材料与方法
1.1 材料与仪器
南极磷虾:由作业船在南极海域捕捞,捕捞后迅速保存在-30℃冰柜中,冷冻方式运到实验室,贮藏于超低温冰箱中备用。
动物蛋白水解酶(2×105U/g)、风味蛋白酶(1×105U/g):食品级,诺维信(中国)生物技术有限公司;D-木糖:国药集团化学试剂有限公司。
DF-101S集热式恒温加热磁力搅拌器:邦西仪器科技(上海)有限公司;AL204电子天平:瑞士梅特勒-托利多公司;DHG-9123A电热恒温鼓风干燥箱:上海精宏实验设备有限公司;PT-10 pH计:美国Sartorious公司;LG10-2.4A高速离心机:北京医用离心机厂;W205B电热恒温水浴锅:上海申胜生物技术有限公司;UV-3100紫外-可见分光光度计:上海美普达仪器有限公司;SYKAM S-433D全自动氨基酸分析仪:德国SYKAM公司;SC-80C全自动色差计:北京康光光学仪器有限公司;7900ICP-MS等离子体电感耦合质谱仪:美国安捷伦公司;ACQUITY UPLC I-Class-XEVOTQS超高效液相色谱-串联质谱仪:美国waters公司;CP3380气相色谱仪:美国瓦里安公司。
1.2 方法
1.2.1 南极磷虾酶解液的制备
称取一定量的南极磷虾,加入1∶3(料液比,g/mL)水匀浆,于50℃和自然pH值下进行复合酶酶解,其中复合酶为动物蛋白水解酶和风味蛋白酶(1∶1,质量比),添加量为1 000 U/g,酶解3 h后于100℃下灭酶15 min,冷却,离心去沉淀,乙酸钙脱氟后即为南极磷虾酶解液(Euphausia superba hydrolysate,EsH)。
1.2.2 南极磷虾酶解液的美拉德反应
取EsH 60 mL,加入20 g/L木糖,于100℃反应60 min,即为南极磷虾酶解液的美拉德反应产物(Euphausia superba hydrolysate-Maillard,EsH-M)。
1.2.3 褐变程度的测定
将EsH稀释5倍,EsH-M稀释20倍,于420 nm处测定吸光值。
1.2.4 色差的测定
用色差计分别测定EsH、EsH-M的L、a、b值。以EsH为对照,计算其色差ΔE,结果用平均值±标准偏差表示。
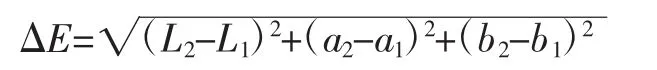
1.2.5 游离氨基酸的分析
各取5 mL EsH和EsH-M,分别加入等体积10%三氯乙酸,沉淀过滤,取滤液各稀释20倍,采用SYKAM S-433D全自动氨基酸分析仪进行分析。
1.2.6 肽分子量分布的分析
将EsH、EsH-M各稀释20倍后,0.22 μm滤膜过滤。采用超高效液相色谱仪测定。色谱柱:CSH C18 130A(2.1 mm× 100 mm,1.7 μm);柱温:40℃;流动相 A为水,B 为乙腈;进样体积 10 μL;检测波长:214 nm。分子量校正曲线所用标准品为细胞色素C、抑酚酶、杆菌酶、乙氨酸-乙氨酸-酪氨酸-精氨酸、乙氨酸-乙氨酸-乙氨酸。
1.2.7 无机离子含量的测定
Na+和K+含量采用火焰原子吸收分光光度法(GB 5009.91-2017《食品安全国家标准食品中钾、钠的测定》);Ca2+含量采用火焰原子吸收分光光度法(GB 5009.92-2016《食品安全国家标准食品中钙的测定》);Mg2+含量采用火焰原子吸收分光光度法(GB 5009.241-2017《食品安全国家标准食品中镁的测定》)。
1.2.8 脂肪酸组成的测定
样品前处理:采用酸水解-提取法,各取EsH、EsH-M 5 mL,加入焦性没食子酸0.1 g,95%乙醇2 mL,蒸馏水4 mL,8.3 mol/L 盐酸 10 mL,于 80℃水浴 40 min,水解完成后,取出冷却至室温。脂肪提取及之后步骤,参照GB 5009.168-2016《食品安全国家标准食品中脂肪酸的测定》操作。
色谱条件:DB-WAX 柱(30 m×0.32 mm,0.5 μm);检测器温度:240 ℃;进样体积 1 μL;分流比 20 ∶1;流速1.5 mL/min;升温程序:80℃保持3 min,然后以5℃/min的速度升至120℃,保持5min,接着以2℃/min的速度升至180℃,保持50 min,再以1℃/min的速度升至240℃,保持60 min。
1.2.9 数据分析
试验数据采用SPSS18.0软件中Duncan法进行各组之间的显著性分析,采用Origin8.0对数据进行绘图。样品中脂肪酸、肽分子量结果分析采用峰面积归一化法计算出各个脂肪酸的相对百分含量。
2 结果与分析
2.1 美拉德反应对酶解液褐变程度和色差的影响
褐变程度是检测美拉德反应进程的一个重要指标,常用420 nm处的吸光值来表示,A420nm值增加表明美拉德反应最后阶段类黑素的产生。
美拉德反应对酶解液褐变程度和色差的影响见表1。

表1 美拉德反应对酶解液褐变程度和色差的影响Table 1 Changes in browning and chromatic aberration before and after Maillard reaction
由表1可知,EsH-M中A420nm明显大于EsH,增加了0.57倍。有研究表明[9],美拉德反应高级阶段,糖类物质裂解生成酮、醛类等无色小分子中间产物,该类产物自身或相互间会聚合生成类黑精等大分子褐色物质,使体系呈现出显著的颜色特征。此外,颜色是美拉德反应一个非常重要而又直观的反映指标,褐变反应开始为浅黄色,最终变为深褐色[10],从表1中还可以看出,美拉德反应的发生,使L值下降,向黑度方向偏移;a值和b值都显著性升高,a值向红色方向偏移,b值向黄色方向偏移,尤其以b值变化最为明显。这说明加热使体系发生了美拉德反应并生成了有色物质,导致颜色加深,并且a值和b值偏移的方向符合美拉德反应产物的颜色,此结果与程恒等[11]的研究结果相一致。
2.2 美拉德反应对酶解液中氨基酸组成的影响
氨基酸(尤其是游离氨基酸)是美拉德反应的重要底物,美拉德反应前后酶解液中游离氨基酸含量如表2所示。
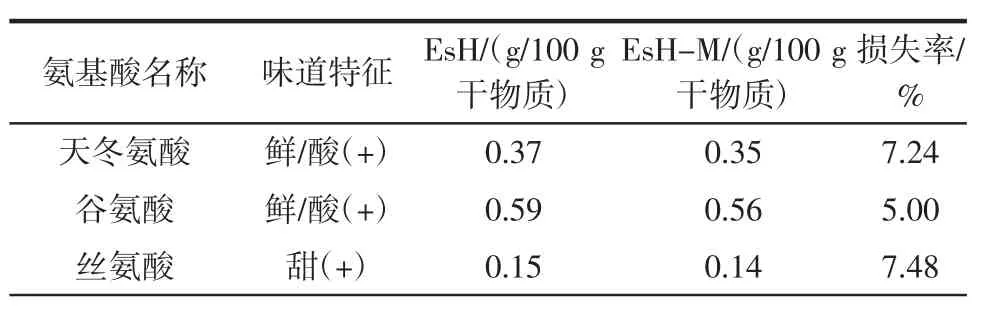
表2 美拉德反应对氨基酸组成的影响Table 2 Changes in free amino acid before and after Maillard reaction
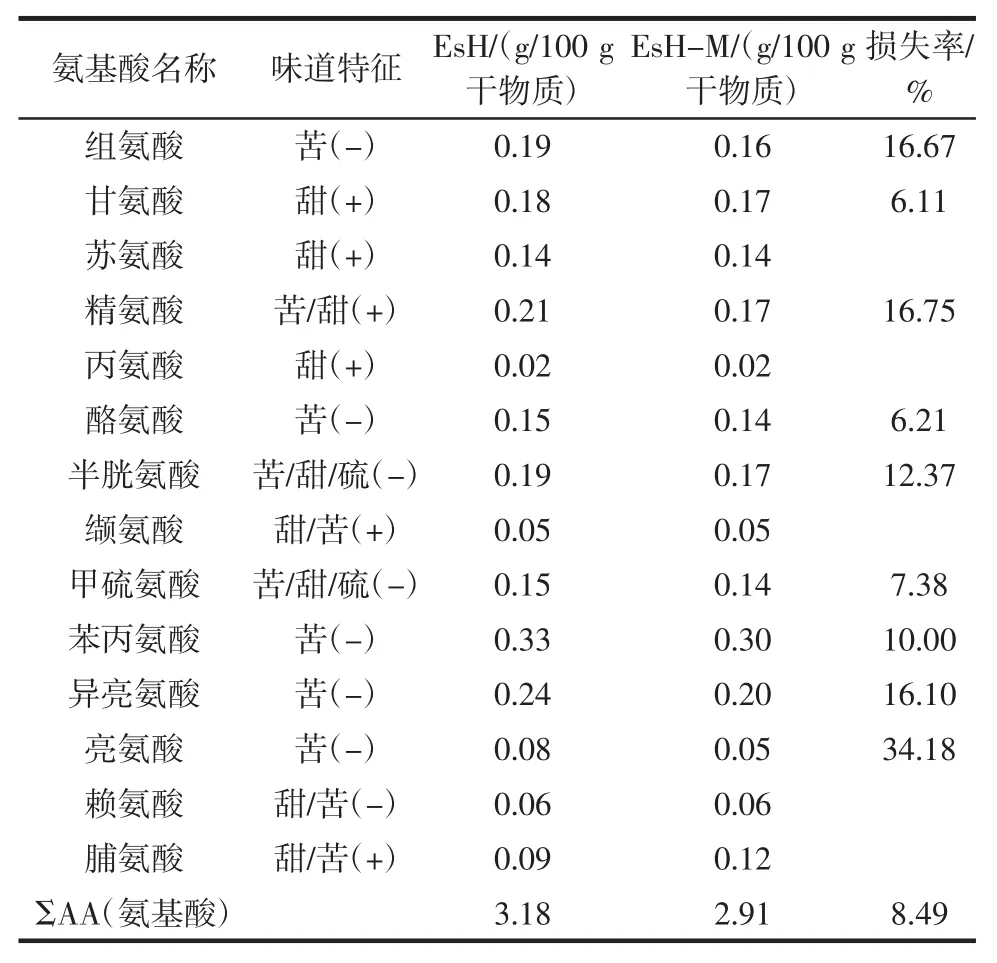
续表2 美拉德反应对氨基酸组成的影响Continue table 2 Changes in free amino acid before and after Maillard reaction
由表2可知,EsH中共检测出17种游离氨基酸,总量为3.18 g/100 g干物质,美拉德反应后,游离氨基酸总量损失8.49%。EsH游离氨基酸中含量较高的5种氨基酸为谷氨酸、天冬氨酸、苯丙氨酸、异亮氨酸和精氨酸,其中谷氨酸的含量最为丰富,约占游离氨基酸总量的18.52%;呈鲜味氨基酸主要为天冬氨酸和谷氨酸,分别占游离氨基酸总量的11.73%和18.52%;组氨酸、酪氨酸、苯丙氨酸、异亮氨酸、亮氨酸为苦味氨基酸,约占游离氨基酸总量的30.69%;精氨酸、半胱氨酸、甲硫氨酸、赖氨酸和脯氨酸既带有苦味,又带有甜味,约占游离氨基酸总量的22.07%。经美拉德反应后,EsH-M损失最多的6种氨基酸分别为亮氨酸、精氨酸、组氨酸、异亮氨酸、半胱氨酸,损失率分别为34.18%、16.75%、16.67%、16.10%、12.37%,发现此5种氨基酸多为苦味氨基酸,表明美拉德反应能改良酶解液的苦味。此外,脯氨酸含量增加了25.00%,这可能是反应过程中,其他氨基酸经过转化而来[12]。游离氨基酸不仅是食品中重要的营养物质,也是重要的滋味成分和气味前体物质,同时还能与食品体系中的其他成分协同,影响其整体风味。美拉德反应后,氨基酸有所减少,是因为这部分氨基酸转变为其他风味物质,成为重要的呈味物质[13-14]。
2.3 美拉德反应对酶解液肽分子量分布的影响
蛋白酶解液中存在着不同的分子量肽段,不仅发生热降解产生美拉德反应的中间产物,而且直接参与美拉德反应[15]。美拉德反应对肽分子量分布的影响见表3。
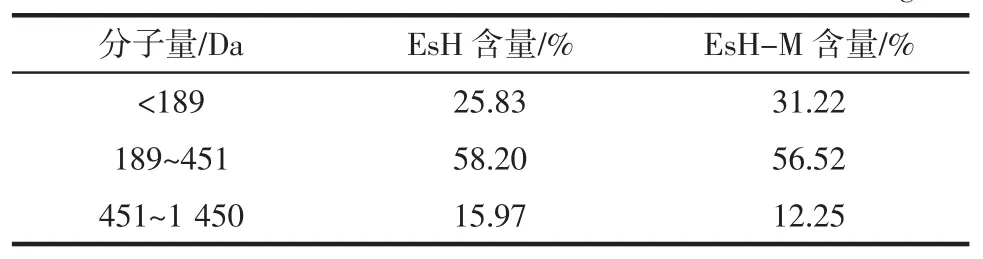
表3 美拉德反应对肽分子量分布的影响Table 3 Changes in peptides before and after Maillard reaction mg/L
由表3可知,EsH-M中分子量大于189 Da的2个组分含量均发生显著下降,同时伴随着小于189 Da的组分含量明显增加。据此推测,在此条件下南极磷虾酶解液-木糖美拉德反应体系中肽段的热降解作用远大于交联作用。郑晓杰等[16]亦研究发现鸡骨酶解液在弱酸条件下和木糖发生反应后,美拉德体系中分子量小于500 Da的组分含量显著增加,大于500 Da的组分含量均发生显著下降。赵谋明、刘平等[17-18]也报道了不同分子量肽段在美拉德反应过程中存在着热降解情况。南极磷虾酶解液各肽段与木糖发生美拉德反应的能力不同,其中451 Da~1 450 Da组分具有较高的美拉德反应活性,推测该肽段可能含有较高反应活性的末端氨基酸。
2.4 美拉德反应对酶解液中无机离子含量的影响
水产品中的咸味主要由Na+、K+、Mg2+等无机盐产生,另外还包括氯化钠、氯化钾及钠、钾的磷酸盐[19]。无机盐的呈味作用不仅在于呈现出咸味,更重要的是某些离子成分会促进水产品中的有机成分的风味特性得以发挥[12]。据文献报道[20],Na+、K+是雪蟹、扇贝和短颈文蛤中共同的呈味活性物质。缺少Na+会使雪蟹、扇贝和短颈文蛤提取物中的甜味、咸味显著下降;缺少K+会使雪蟹、扇贝和短颈文蛤提取物味道变淡,仅保留一点鲜味和特征风味。
美拉德反应对无机离子含量的影响见表4。
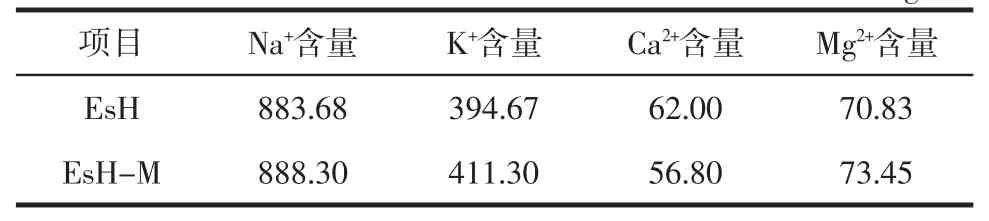
表4 美拉德反应对无机离子含量的影响Table 4 The content of inorganic ions in system before and after Maillard reaction mg/L
由表4可知,反应前后体系中的无机离子,均以Na+的含量为最高,对美拉德反应前后体系的呈味有极重要的贡献。经过美拉德反应,Na+、K+、Mg2+含量分别增加了0.53%、4.21%、3.70%,但离子总含量无明显变化。
2.5 美拉德反应对酶解液中脂肪酸组成的影响
美拉德反应对脂肪酸组成的影响见表5。
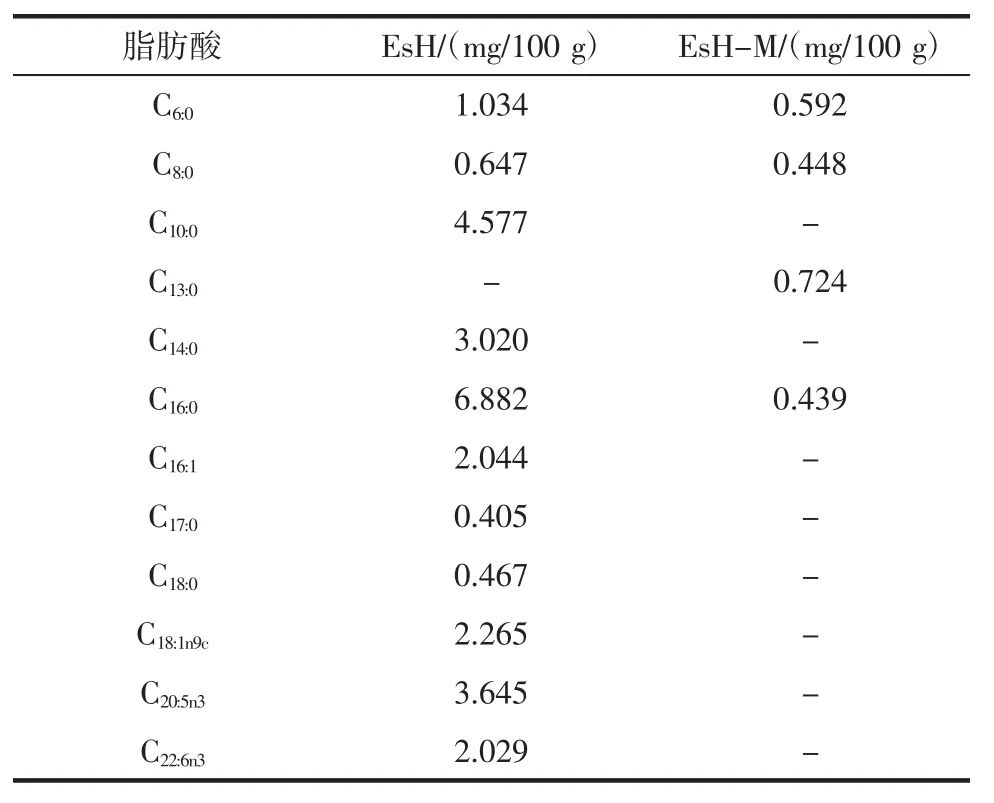
表5 美拉德反应对脂肪酸组成的影响Table 5 Fatty acid compositions of total lipids before and after Maillard reaction
由表5可知,采用气相色谱-质谱法分别从EsH和EsH-M中鉴定出11种和4种脂肪酸。EsH脂肪酸总量为27.02 mg/100 g,其中含有饱和脂肪酸17.03 mg/100 g,且以 C16:0和 C10:0为主;还富含多不饱和脂肪酸C22:6n3和 C20:5n3共 5.67 mg/100 g,其中 C20:5n3含量较高。经过美拉德反应后,EsH-M中脂肪酸含量为2.20 mg/100 g,减少了91.86%的脂肪酸,减少组分以多不饱和脂肪酸为主,此外,还伴有饱和脂肪酸C13:0的增加。曹荣等[21]研究发现南极磷虾中饱和脂肪酸含量占总量的32.31%,且以 C16:0和 C14:0为主,多不饱和脂肪酸占38.78%,以 C22:6n-3和 C20:5n-3为主,说明将南极磷虾酶解并没有破坏脂肪酸的组成。而美拉德反应由于酶解液在高温下和木糖反应,导致不饱和脂肪酸呈现递减趋势,直至消失,此结果与肖作兵等[22]的研究结果一致,不饱和脂肪酸含量会随着温度的升高而呈现递减趋势,特别是多不饱和脂肪酸,含量随温度变化差异显著。
3 结论
美拉德反应后,南极磷虾中酶解液中多数游离氨基酸含量显著降低,其中亮氨酸、精氨酸、组氨酸、异亮氨酸、半胱氨酸损失率较大,说明这些氨基酸可能是参与美拉德反应以及对反应产物风味起主要作用的氨基酸;酶解液肽段中451 Da~1 450 Da组分具有较高的美拉德反应活性;无机离子含量以Na+含量最高;脂肪酸组成呈现减少趋势,减少组分以多不饱和脂肪酸为主。

