高糖环境下TLR7/MyD88/NF-κB在HK-2细胞缺氧复氧损伤中的作用机制
黄亚医,黄 婷,王雅枫,赵 博,周 芳,肖业达
(武汉大学人民医院麻醉科,武汉 430060;*通讯作者,E-mail:xiaoyeda008@126.com)
缺血再灌注损伤是围手术期急性肾损伤的主要病因,而糖尿病状态下机体处于高氧化应激和强炎症反应状态,导致大量氧自由基和炎症因子的生成与释放,从而诱发脏器产生更为严重的缺血再灌注损伤[1,2]。
Toll样受体家族(TLRs)是近年来识别病原微生物、启动免疫防御反应的重要受体蛋白。其下游的髓样分化因子88(MyD88),可触发除TLR3以外所有Toll样受体对NF-κB的激活[3-5]。Assmann等[6]学者推测TLRs可能是触发1型糖尿病的机制之一。TLRs作为识别模式家族重要成员,促进树突状细胞和巨噬细胞识别不同病原菌影响促炎细胞因子和趋化因子的产生[7]。TLRs过度激活可能导致自发免疫反应过度反应[8]。最近研究发现呼吸道合胞病毒感染A549细胞后,TLR7及其下游蛋白表达增强,使炎性细胞因子释放增加,也加剧氧化应激[9]。本研究拟评价高糖环境下TLR7/MyD88/NF-κB信号通路在HK-2细胞缺氧复氧损伤中的作用,为临床降低糖尿病患者围术期肾缺血再灌注损伤的发病率提供理论基础,为糖尿病急性肾损伤提供新的治疗靶点。
1 材料与方法
1.1 材料
人肾小管上皮细胞HK-2(ATCC,美国),DMEM低糖培养基(Hyclone,美国),CCK-8细胞增殖及细胞毒性检测试剂盒(碧云天生物技术研究所),LDH测试试剂盒(南京建成生物工程研究所),SOD测试试剂盒(南京建成生物工程研究所)及MDA测试试剂盒(南京建成生物工程研究所),IL-6、TNF-α酶联免疫吸附测定试剂盒(伊莱瑞特,中国),兔抗TLR7抗体(Novus Biologicals,美国),兔抗MyD88抗体(Abcam,英国),兔抗NF-κB抗体(CST,美国)。
1.2 细胞培养及分组
高糖模型的建立:当HK-2细胞生长到70%-80%,用含乙二胺四乙酸(EDTA)的胰酶消化细胞,吹打并传代。铺板用无血清低糖DMEM培养基同步化24 h加入高糖(葡萄糖终质量浓度30 mmol/L)置于37 ℃、5%CO2培养72 h。采用随机数字表法将HK-2细胞分为:高糖组(HG组),高糖缺氧复氧组(HH/R组),高糖缺氧复氧+TLR7基因沉默组(HH/R-siRNA组)。HH/R组进行缺氧4 h,复氧2 h处理建立缺氧复氧模型。HH/R-siRNA组在siRNA转染成功后48 h高糖缺氧复氧模型操作[10]。
1.3 细胞转染
将HK-2细胞接种于6孔板中,并于37 ℃、5% CO2培养箱中培养过夜,铺板;转染前2 h,换成无血清的DMEM培养基;将100 μl无血清opti-DMEM稀释10 μl siRNA,用枪头轻轻混匀,室温下静置5 min待用;使用前轻轻混匀LipofectamineTM2000,然后取5 μl的LipofectamineTM2000稀释在100 μl opti-DMEM中,室温下静置5 min;将LipofectamineTM2000和siRNA的稀释液[TLR7 siRNA(h):sc-40266,Santa Cruz Biotechnology, Inc.; TLR7-sense(S):5′-GAGGAAUUAGACAU CUCUAdTdT-3′;TLR7-antisense(AS):5′-UAGAGAUGUCUAAUU CCUCdTdT-3′]轻轻混匀,充分混匀后,于室温(15-25 ℃)下放置3 min,使转染复合物形成。室温下6 h内不会失效;每个培养孔加混合液200 μl,小心摇动培养板以确保转染复合物均匀地分布于单层细胞表面;细胞送返培养箱中培养,6 h后吸出混合液换入完全培养基37 ℃、5% CO2培养箱中培养48 h。采用Western blotting法测定TLR7蛋白含量,计算质粒转染率,转染成功后进行下一步操作。
1.4 指标检测
根据试剂说明书,酶标仪测定细胞CCK-8,LDH。分别按照SOD和MDA试剂盒说明书检测SOD和MDA。ELISA法检测IL-6和TNF-α。流式细胞仪检测细胞凋亡,收集细胞1 000 r/min离心5 min,弃上清。沉淀用500 μl缓冲液重悬,加入5 μl Annexin Ⅴ-异硫氰酸荧光素和10 μl碘化丙锭,室温避光孵育5 min后用流式细胞仪上机检测。采用Western blotting法测定目的蛋白浓度:采用SDS聚丙烯酰胺凝胶上样凝胶电泳。蛋白冰浴转膜后,脱脂奶粉室温封闭1-2 h。加入抗TLR7(1 ∶500)、抗MyD88(1 ∶600)和NF-κB(1 ∶1 000),4 ℃孵育过夜。次日用辣根过氧化氢酶标记的二抗(抗兔,1 ∶5 000)孵育1 h后用TBST清洗,显色曝光,以目的蛋白条带灰度值/GAPDH条带灰度值反映目的蛋白表达水平。
1.5 统计学分析
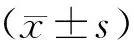
2 结果
2.1 转染效率检测
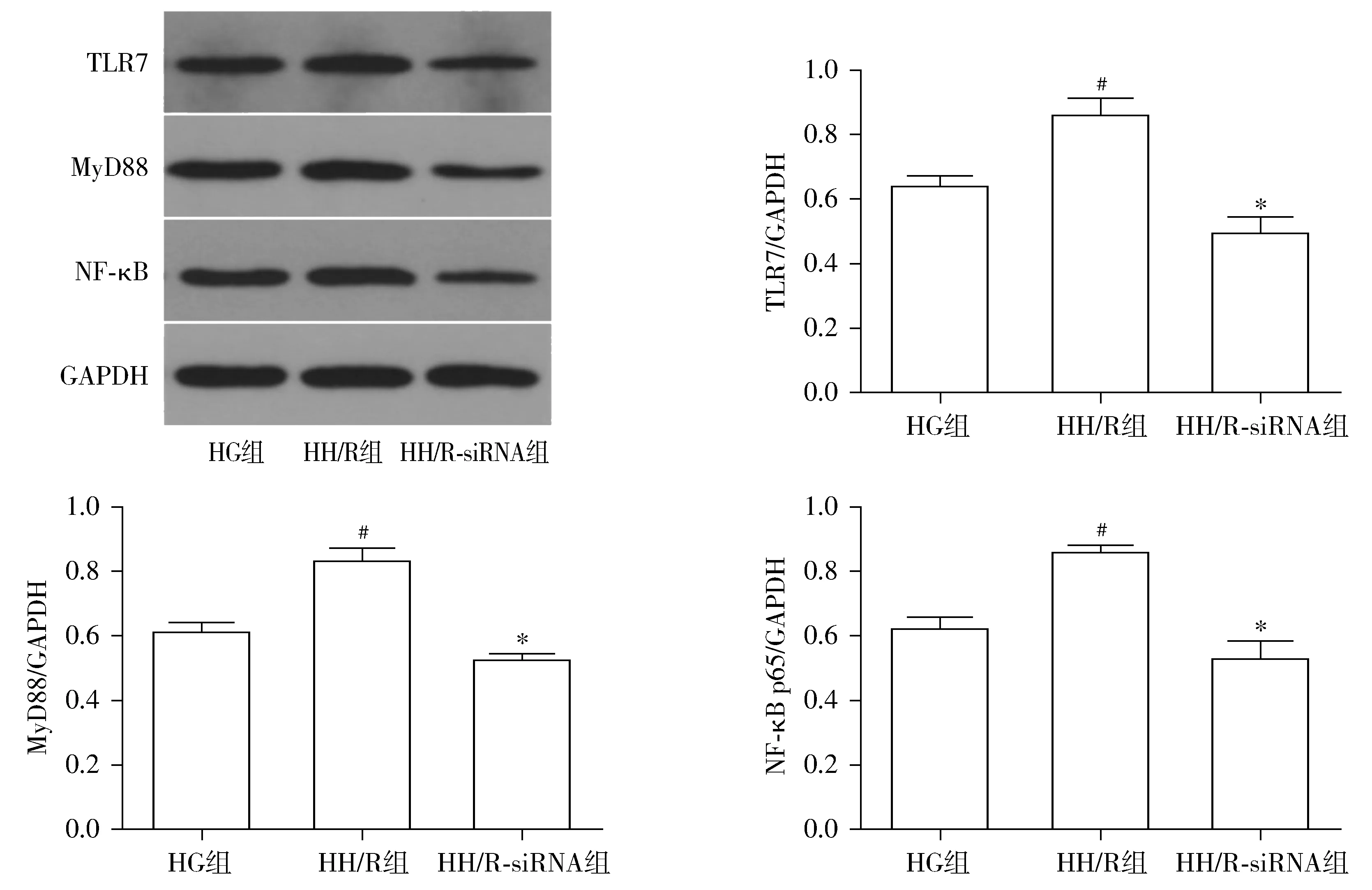
TLR7-siRNA组和空白对照组分别转染HK-2细胞48 h后对TLR7蛋白进行Western blotting检测,结果显示,TLR7-siRNA组与空白对照组比较,TLR7表达被有效抑制(P<0.05,见图1),TLR7-siRNA转染率为72.56%。
2.2 不同组别CCK-8、LDH、SOD、MDA、IL-6和TNF-α的变化
与HG组相比,HH/R组CCK-8和SOD活性下降,LDH、MDA、IL-6和TNF-α表达增多(P<0.05);与HH/R组相比,HH/R-siRNA组CCK-8和SOD活性上升,LDH、MDA、IL-6和TNF-α表达减少(P<0.05,见表1)。
2.3 HK-2细胞的凋亡情况比较
与HG组相比,HH/R组细胞凋亡率增多(P<0.05);与HH/R组相比,HH/R-siRNA组细胞凋亡率减少(P<0.05,见图2,3)。

与空白对照组相比,*P<0.05
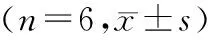
表1 三组HK-2细胞CCK-8、LDH、SOD、MDA、IL-6和TNF-α比较Table 1 Comparison of CCK-8, LDH, SOD, MDA, IL-6 and TNF-α in HK-2 cells among three
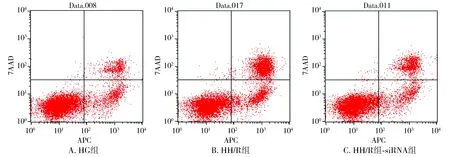
图2 三组HK-2细胞的凋亡情况 (n=6)Figure 2 Apoptosis of HK-2 cells in three groups by flow cytometry (n=6)

与HG组比较,#P<0.05;与HH/R组比较,*P<0.05
2.4 Western blotting分析HK-2细胞中TLR7、MyD88及NF-κB蛋白表达
与HG组相比,HH/R组TLR7、MyD88及NF-κB蛋白表达增多(P<0.05);与HH/R组相比,HH/R-siRNA组TLR7、MyD88及NF-κB蛋白表达减少(P<0.05,见图4)。
3 讨论
糖尿病是一种器官特异性自身免疫性疾病,其中大部分β细胞被细胞毒性T细胞所破坏[11]。TLRs作为一类重要的传感器,在天然性免疫和获得性免疫中都发挥极其重要作用[12]。因此有学者认为Toll样受体的激活在导致机体炎症反应的同时也可能是触发糖尿病的机制之一。
与HG组比较,#P<0.05;与HH/R组比较,*P<0.05
研究认为TLRs参与MyD88依赖的信号通路,激活NF-κB,从而导致炎性因子的大量释放。糖尿病状态下机体处于高氧化应激和强炎症反应状态,导致大量氧自由基和炎症因子的生成与释放,从而诱发脏器产生更严重的缺血再灌注损伤[16,17]。本研究结果表明:高糖状态下,HK-2细胞缺氧复氧后CCK-8和SOD活性下降,LDH、MDA、IL-6和TNF-α表达增多,导致细胞活性下降,氧化应激增强,炎症反应的爆发,细胞凋亡增多;而给与TLR7基因沉默后,部分氧化应激和炎症反应被抑制,凋亡减少,与信号通路的变化趋势相一致。
TLRs作为先天性免疫系统的重要组成部分,在糖尿病的发病机制中起到触发作用。数据表明,TLRs介导的信号通路与糖尿病、心血管系统、神经系统、肝脏、肾脏的疾病密切相关。同时TLRs参与了肾病的发病机制,可能与肾缺血再灌注损伤有关[13,14]。TLRs可协同其相关信号分子,激活细胞因子表达,从而参与免疫应答引起的肾损伤。过度激活TLRs后会诱导机体损伤[15]。
TLR7蛋白通过活化MyD88依赖性途径激活NF-κB,触发炎性细胞因子和趋化因子的产生,导致IL-1受体相关激酶(IRAK)、TNF受体关联因子6(TRAF6)和TGF-β活化激酶1(TAK1)的激活[18]。本研究结果表明:高糖状态下,HK-2细胞缺氧复氧后TLR7、MyD88及NF-κB蛋白表达增多,细胞损伤加重;同样条件下,TLR7-siRNA转染细胞后,MyD88及NF-κB蛋白表达均下降,细胞凋亡减轻,细胞活性增加。由此推测,高糖状态下,缺氧复氧使HK-2细胞TLR7蛋白上调,启动TLR7/MyD88/NF-κB信号通路,加重HK-2细胞损伤。过度活化TLR7/MyD88/NF-κB信号通路也许是加重HK-2细胞损伤机制之一。抑制TLR7表达后,阻断TLR7/MyD88/NF-κB信号通路,使MyD88和NF-κB的蛋白表达下调,细胞损伤减轻。由此得出,TLR7在HK-2细胞高糖缺氧复氧损伤机制中发挥了重要作用。
TLR7在糖尿病急性肾损伤中发挥的作用正逐渐被人们所认识。我们的研究证明在高糖环境下,TLR7/MyD88/NF-κB信号通路参与HK-2细胞缺氧复氧损伤。抑制TLR7表达可以减轻缺氧复氧引起的细胞毒性损伤,降低氧化应激和炎症反应,减少细胞凋亡,减轻缺氧复氧损伤,从而为糖尿病急性肾损伤的临床治疗提供新的切入点。

