低分子肝素钠对阿霉素肾病综合征大鼠糖萼及血浆TNF-α、IL-6的影响※
舒丽霞,罗朋立
(1.青海大学医学院,青海 西宁 810001;2.青海大学附属医院肾病科,青海 西宁 810001)
肾病综合征(nephrotic syndrome,NS)是以大量蛋白尿为特征的一组疾病。蛋白尿的产生与肾小球滤过膜的三层结构(内皮细胞、基底膜、足细胞)密切相关。近年来有学者发现内皮细胞表面有一层蛋白质多糖复合物(也叫糖萼,Glycocalyx,GCX),其与尿蛋白的产生密切相关[1]。GCX是血管内皮表面的一层蛋白质多糖复合物,其核心分子是蛋白多糖和糖蛋白(主要包括syndecans、glypicans等);由核心蛋白通过O-糖基键与无支链糖胺聚糖(Glycosaminoglycan,GAG)侧链相连接;NS时GCX层结构被严重破坏,加之血浆TNF-α水平升高使内皮GCX孔径增加,致出现大量蛋白尿和严重的低白蛋白血症[2];由于白蛋白有助于GCX的修复,NS时大量的蛋白尿导致血浆白蛋白的流失,加重了肾小球内皮GCX的损伤[3]。GAG中含量最多的是硫酸乙酰肝素(Heparan sulfate,HS),超过体积的50%,还有透明质烷(Hyaluronan,HA)、硫酸皮肤素(Dermatan sulfate,DS)[4]。主要的功能GAG是HS,HS作为电荷屏障阻止血液中带负电荷的蛋白质从尿液中损失,而乙酰肝素酶(Heparanase,HPSE)能在特定的位点切割HS链内的糖苷键,从而断开硫酸乙酰肝素-糖蛋白(Heparin sulfate proteoglycans,HSPG)的链接[5]。HPSE在实验性肾小球疾病如阿霉素肾病、嘌呤毒素肾病及其他肾小球疾病等导致蛋白尿的疾病中表达上调,并伴随着HS的减少[5-7]。另外,多种炎性因子参与NS的发病,如肿瘤坏死因子(TNF)和白细胞介素-6(IL-6)等参与细胞免疫和体液免疫,介导肾脏损伤[8-9],可直接损伤肾小球和足细胞,导致大量蛋白尿[10-11]。
NS患者全身血管系统处于高凝状态;NS的治疗药物如皮质固醇类激素、利尿剂等可加重NS患者的高凝状态。抗凝治疗是NS的一个重要辅助治疗手段,LMWH因具有生物利用度高、副作用少等特点在临床上被广泛应用。随着研究的深入,发现LMWH在多种疾病中通过非抗凝机制发挥脏器保护作用,包括对肾脏功能的保护。
本研究拟观察LMWH对原发性肾病模型大鼠的治疗作用及其对肾脏GCX,血浆TNF-α、IL-6的影响,探讨其对阿霉素NS大鼠的治疗作用及可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级健康雄性SD大鼠30只,8周龄,体重(200±20)g,购于西安交通大学医学院实验动物中心,合格证号:SCXK(陕)2017-003;适应性饲养一周,自由进食、饮水。实验室环境:12小时明暗交替。
1.1.2 主要试剂及仪器
盐酸阿霉素(北京索莱宝科技有限公司;货号:D8740,25mg/支);LMWH(齐鲁制药有限公司;国药准字:H20030428,0.2mL/2500IU)。兔抗大鼠Syndecan-1一抗[abcam;货号:ab128936,100μL(1.123mg/mL)];兔抗大鼠Glypican-1一抗[abcam;货号:ab106003,100μg(2.1mg/mL)];α-Tublin、山羊抗兔二抗(索莱宝公司);RIPA蛋白裂解液(索莱宝公司)。白蛋白检测试剂盒(南京建成公司;货号:A028-2;96T);BCA蛋白定量试剂盒(赛默飞公司);2×蛋白上样缓冲液(索莱宝公司);ELISA试剂盒(TNF-α、IL-6、HS、HPSE、Syndecan-1均购自武汉华美生物工程有限公司);总胆固醇(T-CHO)测试盒(南京建成生物工程研究所,货号:A111-1;96T)。电泳仪、转膜仪(Bio Rad公司);酶标仪(Bio Rad公司;MPM6);KD-BMⅡ电脑生物组织包埋机(浙江省金华市科迪仪器设备有限公司);大鼠代谢笼(江苏塞昂斯生物科技)。
1.1.3 NS模型
适应性饲养一周后,参照文献[12]造模。注射阿霉素3周后用代谢笼收集24小时尿液,收集尿液期间禁食,自由饮水;造模成功后于皮下注射LMWH。
1.2 方法
1.2.1 动物分组及处理
6只大鼠设为正常对照组,24只经尾静脉注射阿霉素(共6.0mg/kg)制备NS模型设为模型组和治疗组。注射阿霉素20天后用代谢笼收集大鼠24小时尿液,记录尿量并检测尿蛋白含量,24小时尿蛋白大于等于200 mg的大鼠视为造模成功[12],最后大鼠被分为正常对照组(6只),模型组(6只),LMWH治疗5、7、9天组(其中两组各有1只造模不成功,另一组有一只大鼠产生大量腹水并死亡);正常对照组和模型组经皮下注射生理盐水(0.1mL/d/只),各LMWH治疗组经皮下每天注射LMWH(200IU/只),分别在给药后的第5、7、9天收集24小时尿液,检测尿蛋白含量。
1.2.2 标本收集
给药后第5、7、9天分别收集各LMWH治疗组大鼠24小时尿液离心(3000转/分钟,15分钟),去除沉渣后置冰箱(-20℃)保存待测;用3%的戊巴比妥钠(0.15mL/kg)于腹腔注射麻醉大鼠,从肾静脉采血离心(3000转/分钟,15分钟),取上清液置冰箱(-20℃)保存待测。采血后结扎肾蒂,摘取肾脏组织置冰箱(-80℃)保存待行WB检测,另取肾脏组织浸泡于4%多聚甲醛固定后行HE染色。最后再收集正常对照组及模型组大鼠24小时尿液及大鼠血浆和肾脏组织。
1.2.3 指标检测
用试剂盒分别检测血浆白蛋白含量及尿蛋白含量;血浆HS、HPSE、Syndecan-1、TNF-α、IL-6含量;血总胆固醇。
1.2.4 HE染色
先将浸泡在4%多聚甲醛里的肾皮质包埋(在KD-BMⅡ电脑生物组织包埋机中进行),包埋后切片(5μm),按照预实验条件进行梯度酒精浸泡后染色、脱色、镜下观察。
1.2.5 WB检测
提取组织蛋白后,用BCA法测定蛋白浓度,按SDS-PAGE凝胶试剂盒说明配置10%的分离胶及5%浓缩胶,上样前加入2×蛋白上样缓冲液,每孔上样30 μg后开始以80 V电泳15分钟,再切换至120 V约80分钟,待蛋白样本达到分离胶的底部时,停止电泳。用激活的PVDF膜覆盖后用恒定电流(200mA)转膜2小时,取出PVDF膜,浸泡于脱脂牛奶中封闭(室温)1小时后置封口袋封闭孵育(4℃冰箱内过夜)相应一抗,用1×TBST液清洗7次(7min/次)。室温下孵育相应二抗1小时,洗膜后用ECL化学发光成像系统显影。
1.2.6 统计学处理
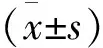
2 结果
2.1 LMWH对NS大鼠蛋白尿的影响(表1)
与NS模型组比较,各LMWH治疗组大鼠24小时尿蛋白含量均有所降低,给药7天开始差异具有显著性,与模型组相比有统计学意义,但各给药组间尿蛋白含量差异不明显。
2.2 LMWH对NS大鼠血浆总胆固醇及血浆蛋白含量的影响(表2)
与正常对照组相比,NS模型组血浆总胆固醇(Total Cholesterol;TC)含量明显增加,在给药后第9天血总胆固醇含量明显减少(P<0.05);与正常对照组比较,模型组血浆白蛋白显著减少,LMWH治疗7天组出现血浆白蛋白水平升高(P<0.05)。
2.3 LMWH对NS大鼠血浆GCX的影响(表3)
与正常对照组比较,模型组大鼠血浆Syndecan-1、HS含量较高;经LMWH治疗后血浆HS含量明显下降,Sydecan-1含量升高,治疗9天开始出现下降趋势(P>0.05);HPSE含量较模型组增加(P<0.05)。
2.4 LMWH对NS大鼠肾皮质GCX核心蛋白Syndecan-1和Glypican-1含量的影响(表4,图1)
与正常对照组比较,模型组大鼠Glypican-1、Syndecan-1含量显著减少(P<0.05);与模型组比较,各治疗组肾小球内皮Glypican-1、Syndecan-1含量增加。


Table 1Effect of LMWH on urinary protein in rats with
#:与模型组比较,P<0.05;*:与正常对照组比较,P<0.05


Table 2Effect of LMWH on plasma TC and albumin levels in NS
#:与模型组比较,P<0.05;*:与正常对照组比较,P<0.05


Table 3Effect of LMWH on plasma HS,HPSE and Syndecan-1,contents in NS
#:与模型组比较,P<0.05;*:与正常对照组比较,P<0.05

Table 4Result of Glypican-1 and Syndecan-1 contents in kidney of NS rats by
#:与模型组比较,P<0.05;*:与正常对照组比较,P<0.05
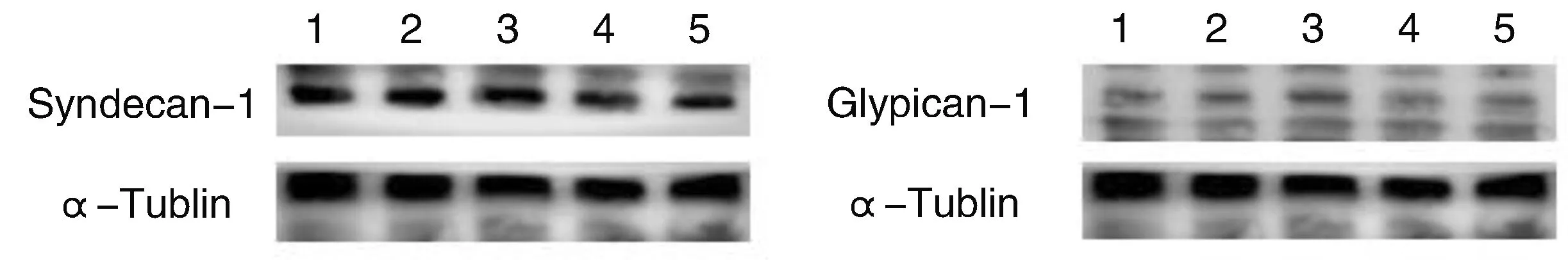
1:正常对照组 2:模型组 3:LMWH5天组 4:LMWH7天组 5:LMWH9天组
2.5 LMWH对NS大鼠血浆TNF-α和IL-6的影响(表5)
与正常对照组比较,肾病模型组大鼠血浆TNF-α、IL-6含量明显增加(P<0.05);经LMWH治疗后两者有下降趋势,TNF-α在治疗9天时血浆水平较肾病模型组明显减少(P<0.05),血浆IL-6含量在给药7天后明显降低(P<0.05)。


Table 5The effect of LMWH on plasma TNF- α and IL-6 in NS
#:与模型组比较,P<0.05;*:与正常对照组比较,P<0.05
2.6 肾组织HE染色(图2)
与正常对照组比较,模型组大鼠肾组织可见肾小球上皮细胞肿胀扩大,肾小球间质可见均质红染物质增多,少量单核细胞渗出,个别囊腔内见少量红细胞漏出,肾小管上皮细胞胞浆疏松化、体积增大,管腔内有大量透明管型,未见新月体、坏死及硬化;与模型组比较,各LMWH治疗组肾小球上皮细胞水肿程度减轻,肾小管内透明管型明显减少,肾小管上皮细胞胞质疏松化程度减轻。
对照组 模型组

低肝5天组 低肝7天组 低肝9天组
3 讨论
本实验采用阿霉素诱导NS模型,其临床表现近似于原发性NS,是公认的能够较好地模拟人类肾病的模型[13]。LMWH治疗后各组24小时尿蛋白含量较模型组明显减少,血浆白蛋白含量升高,血浆TC、HS、TNF-α、IL-6含量显著减少,HE染色结果显示治疗后肾小管内透明管型明显减少,提示LMWH是有效治疗NS的手段。
在本实验中,经LMWH治疗9天后血浆白蛋白含量得到回升,同时伴随着24小时尿蛋白、血浆TNF-α及IL-6、HS、TC含量显著减少。与田建梅[14]等用LMWH联合泼尼松作用于NS患儿,治疗一个月后患儿血浆总胆固醇、24小时尿蛋白含量明显下降的结果一致。LMWH因具有与HS相似的结构,可修复肾小球内皮GCX结构、降低肾小球滤过膜通透性,从而降低NS蛋白尿含量并提升血浆白蛋白水平[15],对肾脏发挥保护作用。本实验发现,经LMWH治疗后大鼠血浆GCX(HS、Syndecan-1)含量较模型组减少,HPSE含量增加(P<0.05)。组织GCX(Glypican-1、Syndecan-1)含量增加(P>0.05),可能与LMWH的血药浓度有关,因为LMWH以剂量依赖性方式防止GCX核心蛋白脱落,起到保护作用[2],提示LMWH有修复GCX的作用。GCX得到修复后导致蛋白尿的产生减少,进而血浆白蛋白含量回升,而血浆白蛋白升高抑制了血浆TC的升高。
经LMWH治疗后大鼠血浆TNF-α、IL-6水平明显降低,可能与LMWH的抗炎作用有关。LMWH抗炎作用机制可能从抗凝机制和非抗凝机制两方面体现:抗凝机制主要是通过抑制FXa而发挥抗炎作用,凝血因子FXa是一类能促进炎症反应的酶,可通过G蛋白偶联受体-3激活炎症细胞;还可与内皮细胞及白细胞上存在的一个特异性FXa受体-效应器蛋白酶受体-1(effector protease receptor-1,ERP1)结合,促进炎症介质如IL8、IL6、TNF-α等释放[16];LMWH的非抗凝抗炎机制主要是通过抑制炎症细胞、炎症因子(如TNF-α、白介素等)及黏附分子等发挥抗炎作用;通过降低体内炎症因子水平达到抗炎作用[16-18]。有研究显示血浆TNF-α、IL-6水平增加也可促进GCX的脱落,加重蛋白尿症状[19],因此抑制二者表达可能也是LMWH发挥肾脏保护作用的机制之一。
综上所述,LMWH可能是通过修复GCX减少蛋白尿的产生[1],并通过降低血浆TNF-α、IL-6含量减少蛋白尿的产生[20]。这可能是LMWH保护阿霉素NS大鼠肾脏的重要机制之一。

