IL-6、IL-8、MCP-1和TNF-α在子宫内膜异位症诊断中的临床价值
朱定军 叶梅
子宫内膜异位症是一种常见的慢性妇科疾病,是指子宫内膜活性细胞和组织出现在子宫内膜以外的部位,引发痛经、慢性盆腔痛、月经异常、异位结节以及不孕等临床症状[1]。子宫内膜异位症病因尚未完全阐述清楚,近期研究表明腹腔内炎性环境和免疫异常与子宫异位内膜过度生长密切相关[2-3]。本研究通过检测两组患者血清以及腹腔液中炎性因子的表达水平,分析免疫因子表达水平差异以及与子宫内膜异位症分期之间的关系,探讨其在子宫内膜异位症诊断以及分期判断中的临床价值。
对象与方法
1.研究对象 2015年1月—2016年1月期间本院收治子宫内膜异位症患者110例,年龄(31.4±4.5)岁,根据美国生育学会的修正子宫内膜异位症分期法(r-AFS)分为I期24例、II期27例、III期31例、IV期28例。同期本院收治的110例非子宫内膜异位症患者作为对照组,年龄(32.5±3.7)岁,排除内分泌、肝肾、自身免疫以及代谢疾病。所有纳入研究标本经医院伦理委员会批准并取得患者知情同意。
2.方法 (1) 标本采集与处理:抽取两组患者空腹外周静脉血5 ml,经抗凝处理后3000 r/min离心10 min取上清液存储于-80 ℃冰箱待测。腹腔镜检查时吸取子宫直肠陷凹内的腹腔液5ml,3000 r/min离心10 min,取上清液存储于-80℃冰箱待测。(2) 标本检测:按照人IL-6、IL-8、MCP-1和TNF-α酶联免疫吸附测定试剂盒(ELISA,美国R&D公司) 说明书进行操作,在预先包被人IL-6、IL-8、MCP-1和TNF-α捕获抗体的微孔中,依次加入待测标本、标准品、HRP标记的检测抗体,经过温育洗涤后显色。然后用酶标仪在450 nm 波长下测定各微孔吸光度(OD 值),根据标准品浓度作横坐标,对应OD值作纵坐标,绘制标准曲线,计算待测标本浓度。(3) 检测结果阳性判定:判断特异性和敏感性高低的标准是根据相应对照组中IL-6、IL-8、MCP-1和TNF-α单侧95%参考值范围上限作为界点进行判断,凡大于界点值判断为阳性。计算各诊断指标敏感性特异性,计算公式为:特异性=真阴性例数/(真阴性例数+假阳性例数)×100%,敏感性=真阳性例数/(真阳性例数+假阴性例数)×100%。

结果
1.两组患者血清和腹腔液IL-6、IL-8、MCP-1和TNF-α的表达情况
IL-6、IL-8、MCP-1和TNF-α在观察组血清以及腹腔液中表达水平明显高于对照组(P< 0.05),见表1和表2。

表1 两组患者血清中IL-6、IL-8、MCP-1和TNF-α的表达情况
*两组比较,P<0.05

表2 两组患者腹腔液中IL-6、IL-8、MCP-1和TNF-α的表达情况
*两组比较,P<0.05
2.血清和腹腔液中IL-6、IL-8、MCP-1和TNF-α诊断子宫内膜异位症的敏感性和特异性
对照组血清中IL-6、IL-8、MCP-1和TNF-α单侧95%参考值范围上限分别为19.66 pg/ml、22.76 pg/ml、24.45 pg/ml、15.46 pg/ml,对照组腹腔液中IL-6、IL-8、MCP-1和TNF-α单侧95%参考值范围上限分别为14.04 pg/ml、17.25 pg/ml、70.74 pg/ml、16.08 pg/ml分别计算出四种指标诊断子宫内膜异位症的敏感性和特异性,结果显示血清和腹腔液中MCP-1诊断子宫内膜异位症的特异性和敏感性均较高,具有极高的临床诊断参考价值,其次是TNF-α,血清中诊断子宫内膜异位症特异性最低的是IL-8,敏感性最低的是IL-6,腹腔液中诊断子宫内膜异位症特异性与敏感性最低的是IL-8。见表3和表4。
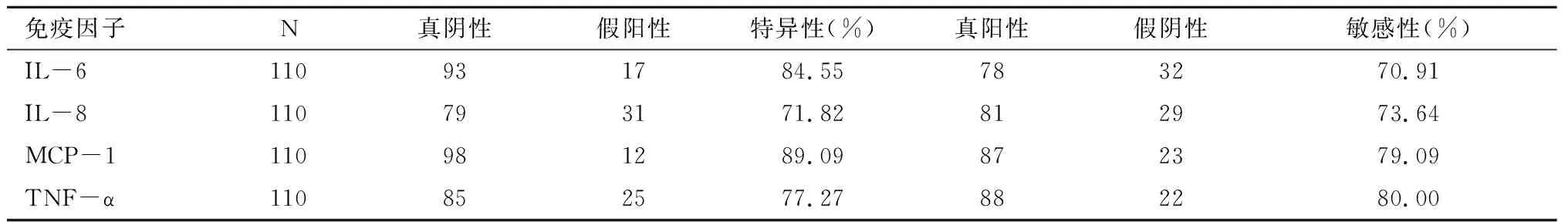
表3 血清中IL-6、IL-8、MCP-1和TNF-α诊断子宫内膜异位症的敏感性和特异性
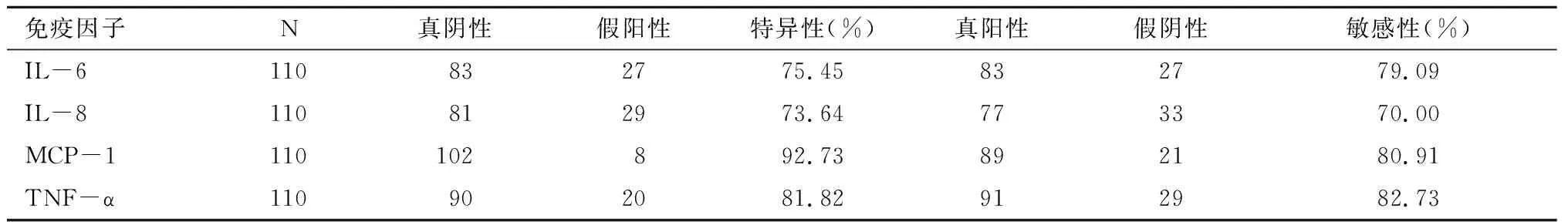
表4 腹腔液中IL-6、IL-8、MCP-1和TNF-α诊断子宫内膜异位症的敏感性和特异性
3.子宫内膜异位症分期与血清和腹腔液IL-6、IL-8、MCP-1和TNF-α的表达情况
III-IV期子宫内膜异位症患者血清以及腹腔液中IL-6、IL-8、MCP-1和TNF-α表达水平明显高于I-II期子宫内膜异位症患者(P< 0.05),见表5和表6。

表5 子宫内膜异位症分期与血清中IL-6、IL-8、MCP-1和TNF-α的表达情况
*P<0.05

表6 子宫内膜异位症分期与腹腔液中IL-6、IL-8、MCP-1和TNF-α的表达情况
*P<0.05
讨论
子宫内膜异位症的发病机制目前尚不清楚。研究认为子宫内膜异位症的发生及发展与免疫机制有着重要的联系,患者由于免疫监视功能减弱,无法清除异位内膜,使得不断增多的内膜碎片经黏附分子诱导在腹腔定植免疫系统,由监视、清除作用转变成免疫促进作用,免疫调节功能失控,造成免疫细胞产生多种细胞因子和炎症介质,这些分泌的因子影响自身和相邻细胞,导致趋化增殖以及促分化,进一步促进异位内膜生长及增殖,使得病情加快发展[4-5]。
IL-6属于标志性的炎症细胞因子,主要分泌于巨噬细胞,子宫内膜异位症患者也可以从异位内膜间质细胞中大量分泌,IL-6受体在异位内膜组织中与在位内膜组织相比显著降低,因此异位内膜对IL-6介导的生长抑制具有免疫作用[6]。异位内膜组织的不断增殖造成腹腔中的IL-6水平持续处在高位,使得患者内环境中的炎症和免疫反应加剧。IL-8属于促炎细胞因子,主要分泌于巨噬细胞和上皮细胞,其浓度的升高可对血管生成起到促进作用,而异位内膜则需要大量的新生血管,因此IL-8的浓度升高促进了异位内膜生长。IL-8在子宫内膜异位症患者子宫内膜内具有高表达性,子宫内膜在反流进入腹腔的时候将IL-8同时带入腹腔,而在慢性炎症的刺激下促使免疫反应变得活跃,使得巨噬细胞进一步释放出大量IL-8,IL-8同时能够上调机体中金属蛋白酶9表达,提高子宫内膜的间质黏附能力,具有浓度依赖关系[7]。TNF-α主要产生于淋巴细胞、巨噬细胞以及激活的单核细胞,属于血管活性因子之一,是多种生物活性的细胞因子,对炎症和免疫反应具有介导促进作用,能够对卵泡分泌及发育等多个生殖过程起到调节作用[8],另一方面TNF-α还参与到免疫病理损伤。在机体出现子宫内膜异位症时,异位子宫内膜能够刺激机体产生体液以及细胞免疫应答,增加腹腔液内巨噬细胞和外周血液内淋巴细胞的活化程度以及数量[9]。MCP-1可特异性的激活巨噬细胞和单核细胞,促进腹腔液巨噬细胞活化,导致局部免疫炎症发生发展[10]。李萍[11]等人研究证实宫内膜异位症患者腹腔液与异位的子宫内膜组织中MCP-1表达水平显著高于对照组。Arici[12]等研究发现子宫内膜异位症的病情严重程度与患者腹腔液内MCP-1浓度呈正相关性,子宫内膜异位症患者所分泌的细胞因子对腹膜间皮细胞形成刺激,从而产生MCP-1,MCP-1进一步对异位内膜诱导及活化,形成正反馈级循环放大效应。申辉[13]等人研究发现子宫内膜异位症患者的血清中IL-6、TNF-α和IgG水平升高,可能与炎性因子导致免疫性病理损伤等相关。周晓红[14]等人研究结果表明,子宫内膜异位症患者血清中IL-2、IL-6 以及 IL-10 水平明显升高,并且随着子宫内膜异位症分期升高,IL-2、IL-6 及 IL-10水平显著升高。本研究通过ELISA检测发现IL-6、IL-8、MCP-1和TNF-α在观察组血清以及腹腔液中表达水平明显高于对照组(P<0.05),且血清和腹腔液中IL-6、IL-8、MCP-1和TNF-α诊断子宫内膜异位症时均具有较高的敏感性和特异性。结果提示IL-6、IL-8、MCP-1和TNF-α在血清以及腹腔液中表达水平可能与子宫内膜异位症发病机制具有一定的相关性。
r-AFS分期可反映子宫内膜异位症患者的病情严重程度、病变范围以及粘连程度,但其仍需结合腹腔镜检查或者剖腹探查进行确诊,目前对于疾病严重程度与细胞因子之间的相关性的研究结论差异较大,不少研究[15-17]认为子宫内膜异位症患者的分期进展与IL-6,CA125以及TNF-α浓度具有正相关性,而也有研究[18]结果表明子宫内膜异位症患者I-II期与III-IV期血清和腹腔液中IL-6,CA125以及TNF-α浓度对比差异均无统计学意义(P>0.05),本研究未对CA125水平进行对比,而是对比了不同分期患者血清和腹腔液中IL-6、IL-8、MCP-1和TNF-α水平,结果表明III-IV期子宫内膜异位症患者不论血清和腹腔液中IL-6、IL-8、MCP-1和TNF-α浓度均显著高于I-II期患者,差异具有统计学意义(P<0.05)。笔者认为出现不同结果的原因可能是r-AFS分期评分没有把病灶活性纳入,缺乏疼痛指标,对患者生育需求评估有限,而且该评分主观性较大,不同观察者存在不同的评估标准,因此外周血清和腹腔液检测四种炎性因子的表达情况对子宫内膜异位症分期判断还需要进一步加大样本量证实。

