遗传咨询和预实验结果对胚胎植入前单基因遗传病诊断结局的影响
朱小辉 关硕 王玉倩 邵敏杰 廉颖 黄锦 李蓉 刘平 闫丽盈 乔杰
出生缺陷是指婴儿出生前发生的身体结构、功能以及代谢的异常。出生缺陷通常是严重致残致死类疾病,缺乏治疗手段。除严重胎儿畸形外,出生后的缺陷儿中30%会在五岁前死亡,40%的缺陷儿会有终身残疾,给患儿的家庭甚至社会造成了沉重的精神和经济负担[1]。造成出生缺陷的原因很多,主要有遗传因素和环境因素。原卫生部2012年发布的《中国出生缺陷防治报告(2012)》统计,我国出生缺陷高达5.6%,每年新增出生缺陷数约90万例,其中20%~30%与遗传因素相关。目前已知的属于出生缺陷类的疾病有8 000种以上,其中属于孟德尔单基因遗传病的有5 208种,3 575个已经发现相关基因[2]。
在所有出生缺陷中,与遗传因素相关的出生缺陷有80%左右,包括染色体结构异常,单个基因或多基因异常甚至基因甲基化异常等[3];随着高通量测序技术(包括外显子组和全基因组测序技术)的发展和人类基因组计划的实施、结合基础医学对基因功能的研究,有力地推动了遗传性出生缺陷的病因学研究[4]。对于大多数遗传性疾病,目前还没有有效的治疗药物和手段。遗传阻断的有效方式主要有两种:产前诊断和胚胎植入前遗传诊断,这两种方式均包括染色体和致病基因的诊断。PGD在1990年成功应用于临床,为一个X连锁隐性遗传病家系挑选女性胚胎[2]。随着单细胞基因组扩增方法的出现和不断改进,以及芯片技术和高通量测序技术在诊断中的应用,大大提高了胚胎诊断的准确性和应用范围,目前国际上有报道超过200个单基因病经PGD进行胚胎诊断[5]。我们中心在染色体和单基因的PGD诊断中,开发了MARSALA技术[6],为单基因遗传病家系病人进行胚胎诊断,目前450余例病人进入诊断流程,包括156种遗传病,准确诊断了386个取卵周期,已分娩61名PGD新生儿,还有38例处于妊娠期。
无论是产前诊断,还是胚胎移植前基因诊断,基因检测报告的准确性是关键,决定着PGD的结局和胎儿的命运。家系中患者的疾病临床诊断的准确性,疾病与基因的相关性以及基因突变位点的致病性等因素决定着基因检测结果的可靠性。专科医生大多可以做出疾病诊断,而检测机构的技术和生物信息人员负责对基因和位点进行判读,而把两者联系在一起的是有临床背景和遗传知识的遗传专家。遗传咨询,作为遗传学信息与临床症状联系的纽带,在婚前、胚胎植入前以及产前各阶段均对病人的生育有指导作用,对于防止缺陷儿出生,降低出生缺陷率有不可低估的作用。 病人进入流程前的预实验,是减小诊断风险,防止患儿出生的更关键一步。我中心胚胎诊断流程中病人进入取卵周期前,均需进行预实验:目的是遗传病基因检测结果家系验证,同时为后续的胚胎诊断做准备。遗传咨询和预实验是我们中心胚胎基因诊断流程的起始环节,也是发现问题、纠正错误、制定检测策略、提高胚胎诊断准确性的关键步骤。
对象与方法
一、对象
我中心遗传门诊接诊的遗传病家系夫妇,生育过患儿(包括引产过患病胎儿),或者无患儿但有遗传病家族史。根据遗传病的类型不同,遗传咨询后,采集夫妻双方、患儿、以及携带突变基因一方的父母的血液样本。如为常染色体显性遗传家系,还需采集携带突变一方其他家系成员血液样本。X连锁隐性遗传病家系,如无患儿,需采集女方家系中相关成员血液样本,包括家系中患病男性、正常男性以及患病男性的母亲等等(图1)。如果夫妻为新发病例或无家系样本,则考虑用单个精子、极体、或含致病位点胚胎用于连锁分析,预实验结束后,根据实验结果签署胚胎植入前基因诊断知情同意书,把风险和有可能出现的问题充分告知病人。
二、方法
预实验包括以下几方面: (1)基因检测报告上基因突变位点家系验证。(2)单细胞致病位点扩增:单细胞基因组扩增后,设计引物,突变位点扩增,为胚胎诊断做准备。(3)家系连锁分析:部分特殊家系进入周期后,先行寻找家系可用SNP位点,评估胚胎检测的风险,并为后续胚胎诊断做准备。具体实验方法如下:
1、家系样本采集:男女双方、患儿和其他家系成员采集EDTA抗凝血4 ml,分装后按照标准化流程入生殖中心样本库的PGD库,留0.5 ml提取基因组DNA,用于预实验。样本如为组织样本(如先证者的脐带或其他组织),分装成小块后,液氮速冻,存入样本库,留一份提取基因组DNA。留取先证者或者基因突变携带者的口腔黏膜细胞,显微镜下挑取单个细胞,放入裂解液中(亿康公司-MALBAC单细胞全基因组扩增试剂盒),3~5个细胞/管。某些男方携带基因突变的家系需留取精液,显微镜下挑取单个精子,放入裂解液中备用。
2、血液及组织基因组DNA提取:实验流程遵循试剂盒(Qiagen 69504)说明书。
3、家系突变位点验证:用家系基因组DNA作为扩增模板,根据家系携带基因突变的类型,进行突变位点验证。突变位点验证的方法包括:(1)PCR-Sanger测序适用于点突变,单碱基或多碱基插入缺失突变验证;(2)PCR扩增后毛细管电泳适合基因中碱基重复数异常的突变类型验证;(3)多重连接探针扩增(multiples ligation-dependent probe amplification,MLPA)适合外显子缺失的突变类型验证;(4)高通量基因组测序或者SNP芯片适用于验证大片段缺失和重复。
4、单细胞基因组扩增、基因突变位点检测:扩增实验方法遵循试剂盒说明书(亿康公司-MALBAC单细胞全基因组扩增试剂盒)。设计特异性引物(扩增产物长度不能过长,适于单细胞基因组扩增产物的长度)挑选适合的引物和扩增条件用于后续的胚胎检测。
5、某些病例,由于家系不全(基因突变携带者一方父母去世,或者携带者为新发突变,家系中无其他携带者)男方携带者,可将单个精子用于胚胎诊断中连锁分析,预实验时将单精子全基因组扩增,产物经全基因组测序后,在致病基因所在的染色体接近基因附近处寻找可用于家系连锁分析的SNP位点[6]。
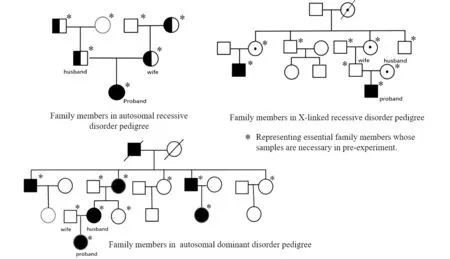
图1 遗传家系模式图。模式图中*代表预实验需留取样本的家系成员Figure 1 Schema chart of hereditary disorder pedigree* Representing essential family members whose samples are necessary in Pre-experiment
结 果
一、单基因遗传病胚胎植入前基因诊断前的遗传咨询
在本中心单基因PGD标准化流程中,生殖遗传咨询是流程的第一步,病人由临床遗传病接诊大夫接收,针对病人的基因检测结果和胚胎基因筛选的诉求,遗传咨询将分为两部分:
1、遗传咨询(常规遗传咨询):针对病人提供的基因检测报告和家系情况,推荐病人去专科医院遗传学专家门诊进行遗传咨询,咨询内容主要包括基因检测报告的可靠性,家系中患者症状与基因及基因突变的相关性,基因突变的致病性分析,专科遗传专家给出咨询意见。
2、生殖遗传咨询:由具有遗传学背景的生殖医学临床医生对病人进行生殖遗传咨询。内容包括:(1)全面了解胚胎诊断的过程。(2)告知病人遗传病阻断的方法和可能的选择,包括产前诊断和胚胎植入前遗传诊断各自的优势和缺点。(3)胚胎诊断的结局。需要告知病人几方面的内容:根据技术的局限性,告知病人胚胎诊断有误差存在。虽然很小,但有可能。告知病人胚胎诊断中的囊胚期活检的滋养层细胞的染色体状况不能完全代表胎儿染色体的情况,虽然进行了染色体整倍性筛查,但不排除胎儿染色体异常的可能性。(4)对胚胎存在染色体嵌合现象告知风险。移植胚胎需中期羊水穿刺进行基因验证。(5)根据疾病遗传方式对经PGD的胚胎在移植前进行遗传咨询:如常染色体隐性遗传病,携带一方突变的胚胎可移植。理论上将来孩子不患病。对于X-连锁隐性遗传病家系杂合携带突变的女性胚胎,移植前需告知其此女性胚胎的后代生育患病风险等等。病人充分了解PGD的细节和风险后,签署胚胎植入前基因诊断知情同意书,随后进入PGD流程。
二、预实验可能出现的结果及分析
在PGD病人的预实验过程中,我们发现以下几类问题值得关注:(1)经家系验证,由于基因检测公司的失误,基因检测报告有误。(2)常染色体显性遗传病致病基因突变家系验证后,不符合家系疾病与基因共分离现象。(3)X连锁隐性遗传病家系,病人的基因检测结果未得到家系里的先证者的验证。(4)在做预实验时发现病人一些特殊的问题。预实验结果验证了病人是否具有充分的PGD指征,并在我们制定胚胎检测策略时发挥重要作用。以下为代表性病例展示:
1、病例一:常染色体显性遗传病家系-- PGD指征基因,如马凡综合征-FBN1[7]
(1)对象:夫妻双方及男方母亲一起来中心就诊,提供基因检测报告显示在常染色体显性遗传病马凡综合征致病基因FBN1上有一突变,c.698G>A。要求男方采集家系中其他人员的血液样本。
(2)预实验结果:对FBN1的基因突变c.698G>A在全家系基因组DNA中进行验证,结果如图(图2)。基因突变携带情况和家系成员的症状不相符,家系中除男方和其母亲外,妹妹和小舅均为患者,却不携带此突变。建议病人再次进行基因检测,经第二次基因检测,结果显示在FBN2基因上找到一错义突变 c.3719G>A。我们对此位点再次进行全家系验证,此位点与家系成员症状存在完全的共分离现象(图3),只有患病的家系成员携带此突变。支持此位点为致病性位点的其他证据还有文献类似突变位点报道[8]。
(3)结局:经遗传咨询后,病人进入PGD试管周期,以FBN2的突变位点c.3719G>A 为依据进行胚胎诊断。目前成功分娩健康后代,新生儿体检显示各方面检测均正常。
2、病例二:X连锁隐形遗传病家系--PGD指征基因,如血友病F8[9]
(1)对象:夫妻双方来中心就诊,女方为血友病F8因子基因突变携带者,女方家系中有患者(同母异父的大姐的孙子和二姐的儿子均为患儿) 。家系成员除女方外均未做基因检测。基因检测报告显示女方在F8基因上携带一错义突变c.3169G>A,有文献报道。
(2)预实验结果: 全家系验证,结果显示患儿并不携带该突变。家系中患者重新基因检测,发现患者在 F8基因上存在一无义突变 c.5550 delC ,全家验证支持此突变为家系致病性突变,女方不携带(图4)。
(3)结局:女方并不携带家系致病性突变,不具备单基因PGD指征,建议自然妊娠。
3、病例三:常染色体隐形遗传家系-PGD指征基因脊肌萎缩症(spinal muscular atrophy,SMA)遗传家系+平衡易位[10-11]
(1)对象:夫妻双方曾有一个脊肌萎缩症(SMA)患儿,出生后4个月夭折,夫妻双方均为SMN1基因的外显子7和外显子8杂合缺失,患儿为两个外显子纯合缺失。男方家系不全,胚胎基因诊断策略中用单个精子做家系分析,故留取男方精子。
(2)预实验结果:除留取家系成员血液样本,采用MLPA的方法进行SMN1突变位点验证外。因男方母亲去世,男方母亲突变携带情况不详,故留取男方精液,显微镜下挑选单个精子作为辅助诊断依据。单个精子进行全基因组扩增后,判断缺失突变的携带情况,同时进行全基因组测序,寻找基因附近家系分析可用的SNP位点,用于胚胎诊断中染色体分型的依据。单精子全基因组扩增后测序结果分析发现,几乎所有精子都存在染色体异常,主要集中在5号和14号染色体上(图5),因此怀疑男方很有可能是平衡易位的携带者。经过染色体核型检查,辅助以染色体FISH检测,确定男方为5号染色体短臂与14号染色体长臂的平衡易位携带者(图5)。
(3)结局:制定PGD检测策略,对单基因SMN1行PGD外,同时行染色体PGD。利用携带突变的精子进行染色体分型,从而区分平衡易位与完全正常胚胎,病人经一周期PGD,有不携带SMN1双方突变,染色体完全正常的可移植胚胎。
4、病例四:常染色体显性遗传病家系-- PGD指征基因神经纤维瘤II型NF2[12]+染色体平衡易位
(1)对象:夫妻双方因男方家系携带神经纤维瘤II型NF2基因突变来中心就诊,接诊后询问病人孕产史时,发现这对夫妻有两次不良妊娠史,均在孕20周时因发现畸形胎儿引产。其中一次引产胎儿进行了染色体检测,发现胎儿13号染色体末端缺失,18号染色体末端重复,推测夫妻中一方存在染色体的平衡易位的可能性。夫妻在我院再次染色体核型检查并结合FISH检测进行诊断。
(2)结果:最终男方诊断为携带13号染色体长臂末端与18号染色体长臂末端的平衡易位(图6)。
(3)结局:制定PGD检测策略,利用患者引产胎儿样本作为先证者,胚胎可同时进行单基因NF2基因和染色体PGD,挑选染色体正常且不携带基因突变的胚胎。

图5 病例三男方为染色体平衡异位携带者a. 男方单个精子扩增后染色体整倍性分析结果;b. 左侧男方血液细胞染色体核型检查结果,右侧血液细胞FISH结果Figure 5 Case three: Male chromosome balanced translocation carrier diagnosed by single sperm genomic sequencing, chromosome karyotype and FISH analysis. a. chromosome number variation (CNV) analysis by single sperm genomic sequencing. b. Peripheral blood chromosome karyotype analysis. c. Peripheral blood chromosome FISH analysis

图6 病例四男方染色体检查结果,男方为平衡易位携带者a. 染色体核型检查结果;b. FISH检查结果Figure 6 Case Four: Male chromosome balanced translocation carrier diagnosed by chromosome karyotype and FISH analysis. a. Peripheral blood chromosome karyotype analysis. b. Peripheral blood chromosome FISH analysis
讨 论
随着科学技术的进步,PGD成为了减少出生缺陷的重要手段之一。越来越多的有遗传病史的家庭得到帮助,生育了健康的后代。PGD诊断技术成功应用近30年,诊断技术不断发展与改进,从常规PCR到芯片技术,再到高通量测序[13],减少诊断成本的同时,大大提高了准确性,也增加了病人对这项优生手段的信任度。随着病人人数的增加,胚胎诊断技术在很多医院和中心逐渐形成标准化流程[14]。我中心自2014年将新技术的科研成果推向临床PGD以来,率先建立起检测技术标准化流程,同时我们也将病人入组流程标准化。我们首先对其基因检测报告和病人遗传家系症状进行分析会诊,在入组之前充分做好遗传咨询、生殖遗传咨询和生殖评估。遗传咨询由各专科遗传专家给出专业咨询意见,生殖遗传咨询由具有遗传学背景的生殖专业临床医生给病人进行PGD流程与风险咨询。生殖评估由病人(主要为女方患者)所患遗传病专科医生,生殖科医生和产科医生共同组织全院会诊,主要针对女性遗传病患者的生育力、妊娠风险作出准确的评估。
预实验是对家系携带致病基因突变的验证,同时也是发现问题、制定个性化检测策略的关键步骤。我中心开展单基因PGD以来,进行胚胎植入前诊断的450余例病人中,在预实验过程中发现一些问题,常见的是病人的基因诊断报告上的致病基因与病人或其家中患者症状不相符,也就是病人需要重新确定疾病与基因的相关性,以及基因突变位点的致病性。这需要借助专科遗传专家的咨询意见,病人重新做基因检测,找到真正的致病基因及突变后,再进入PGD流程。此外,在前期PGD过程中,我们积累了一些经验,并进一步完善了PGD流程。
对于常染色体显性遗传家系,要求病人提供患病一方的全家系(尽可能多的相关家庭成员)进行位点验证。根据验证结果进行遗传咨询,确定基因与疾病的相关性后,开始PGD流程。对于X连锁隐性遗传病家系,一般情况下此类疾病有先证者存在。比如血友病、杜式肌营养不良(DMD)等,寻找家系的致病基因突变,首先应该从先证者入手,而不是携带者。对于基因检测结果,同样需要进行全家系验证(家族中必要成员,如家族中正常男性、患病男性或生育过男性患者的女性)才能确定真正的致病突变。本文中第三个病例的问题,在于女方本人去做基因检测,而非家系中的先证者,并且基因检测结果未做家系验证。预实验家系验证后,确定此病人不携带家系中从其母亲遗传的致病性突变,可自然妊娠。
通过预实验,还可发现一些复杂的现象,如本文中提到的病例四。虽然病人没有流产和胎儿畸形的不良孕史,但在我们预实验中,发现男方单精子屡次出现5号染色体和14号染色体的各种形式的异常现象,非常符合平衡易位导致的染色体异常的状况;因此怀疑男方为平衡易位携带者。经染色体核型检查并最终由FISH结果确定后,我们制定了胚胎单基因PGD同时进行染色体PGD的检测策略,最大可能减少PGD胚胎移植后出现异常的风险。病人来中心就诊,我们通过仔细询问病人的病史和孕史,充分的遗传咨询和必要的遗传学检测,加上捕捉预实验中出现的异常现象,可以尽最大可能减少PGD胚胎或新生儿出现异常的可能性。
尽管如此,经过严格的预实验验证和专家遗传咨询,也不可能达到100%的零风险。因此,进入PGD流程之前对病例进行合理的个性化的PGD风险评估,在胚胎初步诊断完成后,根据检测结果对移植后胚胎发育过程中出现的任何风险,做出准确的判断,也是胚胎植入前遗传学诊断工作的关键环节。充分告知病人在胚胎PGD可能出现的所有风险,达成共识后签署知情同意书,是我们对每一个病人进行胚胎诊断和胚胎移植前必须进行的工作。对于单基因胚胎植入前PGD,我们不承诺每一例都达到完美无风险,但将尽最大努力降低相关风险。
(图2、图3见封三,图4见封底)

