维生素D受体基因敲除小鼠品系的建立与鉴定
赵家荣,刘欢,张涛,王令,路宏朝,杜伟立
(陕西理工大学生物科学与工程学院,陕西汉中 723000)
维生素D受体(vitamin D receptor,VDR)是一种核转录因子,属于类固醇激素/甲状腺激素受体超家族成员[1],广泛存在于人体多种组织和细胞[2-3]。1,25-二羟基维生素D3(1,25(OH)2D3)激素信号分子与VDR结合形成激素-受体复合物并作用于靶基因上的特定DNA序列,调节下游基因表达,同时影响相关代谢通路[4-6]。VDR的生理功能是调节人体内钙和矿物质平衡,参与皮肤、免疫系统、结肠、乳腺和前列腺等多种器官的生长发育过程[7-10]。当VDR缺乏后,可能会导致心血管疾病、炎症、糖尿病和毛囊发育障碍等疾病的发生[11-12]。由于生物体的复杂多样性,在不同物种、不同组织和机体发育的不同阶段,VDR的生理功能目前仍存在较大争议,特别是在糖脂代谢过程、骨骼肌生长发育、生殖机能等方面,VDR的功能并未完全揭示。因此,构建稳定遗传的VDR敲除鼠品系,将为后续其功能的解析提供良好的动物模型。
基于实验室前期构建的F0代VDR敲除鼠模型[13],本实验将首先测定小鼠的繁殖性能,选择具有生殖能力的敲除鼠与野生鼠进行交配,建立能够将VDR敲除基因稳定遗传的杂合群体,进而对繁育小鼠的基因型和VDR表达水平进行鉴定分析,为揭示VDR的生物学功能提供实验材料。
1 材料与方法
1.1 材料
1.1.1 实验动物
4月龄SPF级C57BL/6 J小鼠12只,雌、雄各6只,体重20~25 g,购于成都达硕实验动物有限公司【SCXK(川)2015-030】,实验室采用胚胎显微注射和CRISPR/Cas9技术构建成VDR-/-基因敲除鼠,饲养于陕西理工大学生物学实验中心【SYXK(陕)2016-0012】。所有小鼠均饲养于12/12 h光照/黑暗条件下,自由采食和饮水,所有操作均符合实验动物伦理学要求(伦理审查备案号:SLGQD2017-10-IACUC2017-0004)。
T7E1核酸内切酶,总RNA提取试剂盒,SYBR Premix Ex Taq(大连宝生物工程有限公司,中国);Trizol(西安热默尔生物公司,中国);一抗(兔抗VDR单抗抗体),辣根过氧化物酶标记的羊抗兔二抗,内参抗体(辣根过氧化物酶标记鼠β-actin抗体)(Cell Signaling Technology,美国);裂解液RIPA和ECL曝光液(武汉博士德生物工程有限公司,中国);DNA纯化试剂盒、PVDF膜(Fluxion Biosciences,美国);基因序列测序,Real-time qPCR引物合成由北京奥科生物技术有限公司完成。
1.1.3 实验仪器
实时荧光定量PCR仪(Step OnePlusTM,Applied Biosystems,美国),数显恒温水浴锅(HH-2,常州润华电器有限公司,中国),PCR扩增仪(PTC-200,MJResearch,美国),常温离心机(Centrifuge5424,Eppendorf,德国),低温离心机(Centrifuge5415R,Eppendorf,德国),立式压力蒸汽灭菌器(YXQ-Ls-75G,上海博讯实业有限公司,中国),电泳仪(DYY-6C,北京市六一仪器厂,中国),涡旋仪(VDP7EX-6,海门市其林贝尔仪器制造有限公司,中国),紫外可见光光度计(UV-4802,尤尼柯(上海)仪器有限公司,中国),凝胶成像系统(Gel Doc,BIO-RAD,美国),蛋白曝光仪(GeneGnome,Syngene,美国)。
1.2 实验方法
1.2.1 引物设计
根据Genbank公布的小鼠VDR基因序列(CT010294.1),设计检测鼠VDR基因打靶位点引物及其定量引物(见表1)。

表1 引物名称及序列Table 1 Primer names and sequences
注:qVDR-F和qVDR-R为定量引物;VDRTPF和VDRTPR为扩增打靶位点引物。
Note. qVDR-F and qVDR-R are quantitative primers; VDRTPF and VDRTPR are amplified target site primers.
1.2.2 VDR敲除鼠品系构建
施工单位在对该公路使用强夯技术之前,必须派专业人员对所要进行施工的路段进行详细勘测,勘测其地质条件、施工地周围环境以及如何有效进行该技术的应用,都必须通过前期的勘测做出详细规划。从而提高工程的建设质量和效率。在强夯技术的应用时,重锤自由落体的强烈震动会对周围的建筑物造成直接的影响,为了避免此现象的发生,施工单位就需要对施工周围的环境进行详细的监测,可以通过挖掘减震沟等办法来减少重锤下落带来强烈震动对周围建筑物的影响。由于在施工过程中,会造成路基水分的流失,在情况比较严重的时候,直接影响工程的建设进程。所以工程建设公司要加强临时排水设施的建设,从而确保工程建设的顺利进行。
先将F0代雌、雄性VDR基因敲除纯合子(VDR-/-)小鼠互交,分析繁殖能力,后将VDR-/-小鼠与野生型(VDR+/+)小鼠互交,获得F1代;F1代雌、雄性VDR基因敲除杂合子(VDR+/-)小鼠互交或VDR+/-小鼠与VDR+/+小鼠互交获得F2代;F2代雌、雄性VDR+/-小鼠互交获得F3代。
1.2.3 VDR敲除鼠鉴定
(1)VDR敲除鼠表型分析
每周定期观察小鼠体型以及被毛和皮肤形态的变化,详细记录。
(2)VDR敲除鼠基因型鉴定
剪取鼠尾组织样,蛋白酶K法提取小鼠基因组DNA,PCR扩增CRISPR/Cas9打靶基因片段,PCR扩增体系为50 μL:5 μLTaq酶缓冲液,6 μL Mg2+,5 μL dNTP,上下游引物各2 μL,模板1 μL,Taq酶0.5 μL,水28.5 μL;PCR反应程序:95℃预变性5 min,95℃变性30 s,60℃退火30 s,72℃延伸30 s,共34个循环,72℃延伸10 min,12℃保存,扩增结束后,用DNA纯化试剂盒纯化PCR产物,从而获得VDR敲除打靶基因片段。T7E1核酸内切酶检测VDR基因是否敲除,同时将VDR敲除打靶基因片段测序,进一步确认VDR基因敲除类型。
1.2.4 VDR敲除鼠不同组织中VDR表达水平分析
利用实时荧光定量PCR(qPCR)检测敲除鼠多种组织中VDR基因转录表达水平。TRIZOL法提取VDR敲除鼠肺、肾、皮肤、小肠、睾丸和胸腺等组织RNA,经反转录试剂盒反转为cDNA,以cDNA为模板,在转录水平检测VDR敲除鼠各个组织中VDR基因的表达情况。25 μL qPCR反应体系:SYBR Premix Ex Taq TM(2x)12.5 μL,上下游引物各1 μL,cDNA模板2 μL,ddH2O 8.5 μL;qPCR反应程序:95℃,10 min;95℃,15 s;60℃,1 min;溶解曲线收集信号程序:95℃,15 s;60℃,1 min;95℃,15 s;共40个循环;采用2-ΔΔCt法分析qPCR结果。
取VDR敲除鼠肺、肾、皮肤、小肠和睾丸等组织各50 mg于研钵,加入液氮研磨后加入150 μL RIPA裂解液。转移细胞裂解混合物至离心管,然后加入SDS-聚丙烯酰胺凝胶(SDS-PAGE)上样缓冲液,混匀后置于沸水浴10 min,然后于4℃,10 000 r/min,冷冻离心10 min。取上清液进行12% SDS-PAGE电泳,然后转至硝酸纤维膜,洗脱后用封闭液封闭,加入一抗、洗脱、加二抗,ECL曝光。
1.3 统计学方法
2 结果
2.1 F0代VDR敲除鼠繁殖性能测定
实验室前期构建F0代VDR敲除鼠12只,均为双等位基因敲除,其中8只VDR-/-小鼠等位基因敲除片段大小与位置一致,4只VDR-/-小鼠等位基因敲除片段存在差异。采用12只雌、雄性VDR-/-小鼠随机互交和VDR-/-小鼠与VDR+/+小鼠互交两种交配方式进行VDR敲除鼠的繁育,结果只有VDR-/-10#(♂)和VDR-/-32#(♀)可以产生子代,且VDR-/-10#(♂)与VDR-/-32#(♀)交配也可以产生VDR-/-子代。VDR-/-10#(♂)和VDR-/-32#(♀)交配产生的VDR-/-小鼠及VDR-/-32#与VDR+/+小鼠繁育的子代没有繁育能力,因此本实验的研究对象都是VDR-/-10#与VDR+/+小鼠产生的后代,突变型VDR的保存与遗传都是以VDR+/-杂合体形式进行,本研究中VDR敲除鼠品系的建立均是通过VDR+/-与VDR+/+和VDR+/-与VDR+/-两种交配方式进行。
2.2 VDR基因敲除鼠鉴定
2.2.1 敲除鼠表型分析
本研究借助于前期获得F0代敲除鼠,建立了可稳定遗传的VDR敲除鼠品系,实验室保存的敲除鼠分别有VDR+/-和VDR-/-两种。通过观察,VDR+/-小鼠和VDR+/+小鼠在表型、骨骼发育及活动能力上无显著差异,随着月龄增大也没有发生明显变化,而VDR-/-小鼠和VDR+/+小鼠具有显著差异,3月龄时眼眶周围开始脱毛,并随着月龄增加,四肢及背部脱毛现象逐渐明显,直到12月龄时几乎完全脱毛,且骨骼发育缓慢,体型小,皮肤皱缩,活动能力降低(图1)。
2.2.2 敲除鼠基因型鉴定
以F2代小鼠基因组DNA为模板,PCR扩增靶点片段,经2%琼脂糖凝胶电泳检测,结果显示:均能扩增大小约470 bp的条带,与预期的VDR靶基因片段大小一致(图2);纯化的PCR产物在T7E1核酸内切酶作用下检测F2代VDR敲除鼠,如图3所示,本实验从F2代小鼠中随机挑选3只小鼠进行检测分析,结果显示3号泳道样本为野生型小鼠,2号和4号泳道的样本为VDR+/-小鼠。T7E1检测后再经测序确认,发现2号和4号样本的敲除类型一致,有5 bp的小片段删除,导致VDR发生无义突变,这一测序结果与F0代VDR-/-10#小鼠的一个等位基因的突变一致,说明本实验已经通过F0代VDR-/-10#小鼠繁育了VDR+/-小鼠,为后续VDR敲除鼠品系奠定了基础。(见图4)。
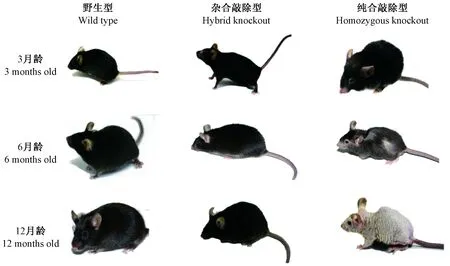
图1 小鼠表型特征Figure 1 Phenotypic characteristics of mice

图4 VDR敲除鼠靶点测序图Figure 4 Target sequencing chart of VDR knockout mice

注:M. DNA标准Marker DL2000;1-6.不同个体VDR靶点基因扩增产物。图2 VDR靶点基因扩增Note. M. DNA Standard Marker DL2000; 1-6. Amplified products of VDR target gene in different individuals.Figure 2 Amplification of VDR target gene
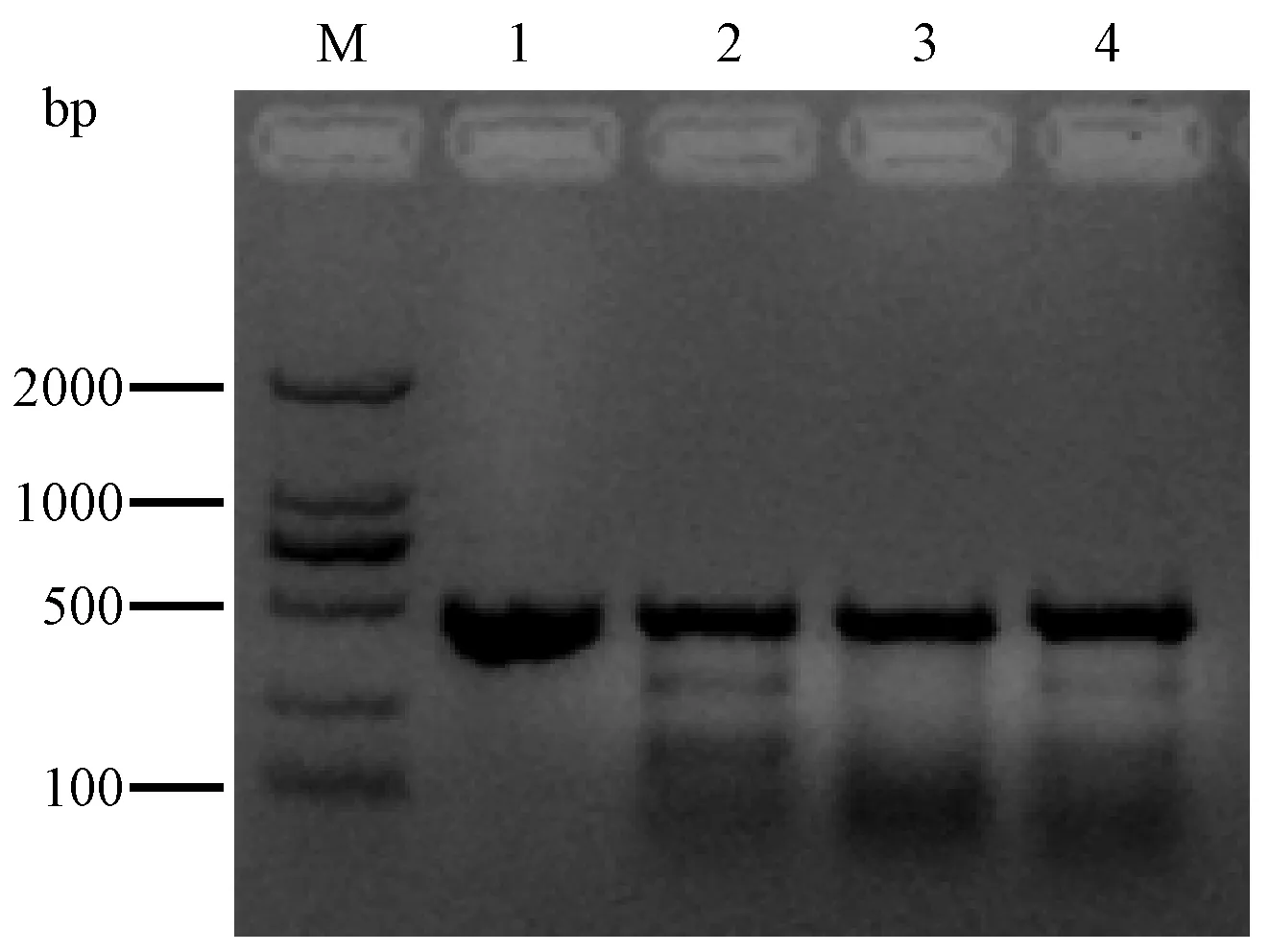
注:M. DNA标准Marker DL2000;1.T7E1未切VDR靶点基因;2-4.T7E1酶切不同个体VDR靶点基因。图3 T7E1核酸内切酶鉴定VDR敲除鼠Note. M. DNA Standard Marker DL2000; 1. T7E1 uncut VDR target gene; 2-4. T7E1 digests VDR target gene in different individuals.Figure 3 T7E1 endonuclease to identify VDR knockout mice
2.2.3 VDR基因敲除小鼠的繁育及鉴定情况
前期通过F0代12只VDR-/-敲除鼠繁育性能的检测分析,发现只有VDR-/-10#小鼠具有较好的、稳定的繁殖能力,因此本研究所有小鼠都是VDR-/-10#小鼠繁育的后代,每一代的繁殖性能和基因型鉴定情况见表2,这些数据表明不同繁育方式所产子代小鼠的基因型分布基本符合孟德尔遗传定律,在VDR敲除鼠品系构建过程中,本研究建立了详细、系统的遗传系谱图,其中部分遗传系谱图见图5。

表2 VDR基因敲除小鼠不同繁育方式繁育结果Table 2 Breeding results of different breeding methods in VDR knockout mice
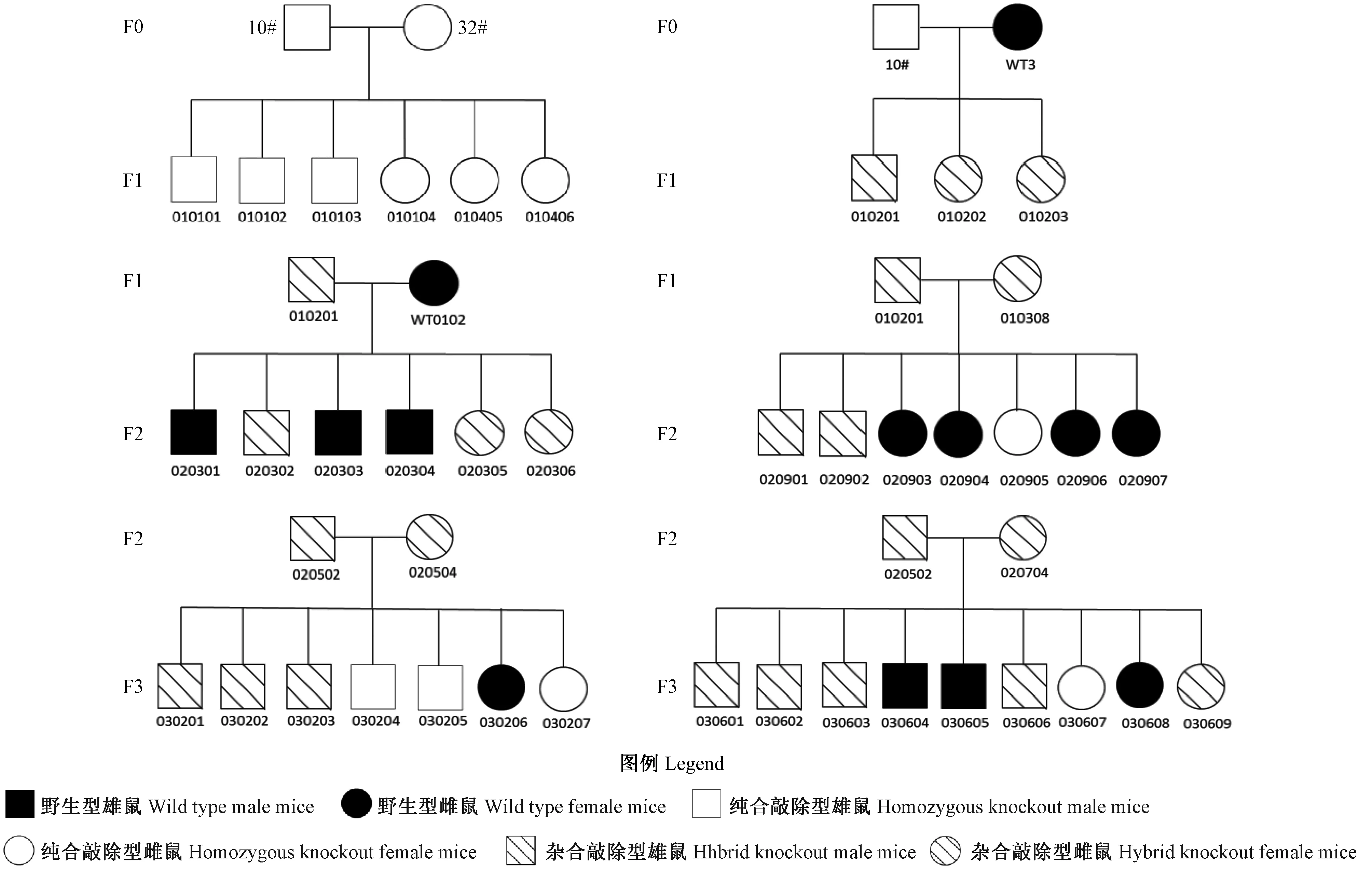
图5 VDR敲除鼠遗传系谱图Figure 5 Genetic lineage of VDR knockout mice
2.3 敲除鼠不同组织中VDR基因表达水平分析
采用qPCR检测F0代和F1代VDR-/-小鼠的肺、肾、皮肤、小肠、睾丸和胸腺等组织中VDR的转录水平。结果显示,与VDR+/+小鼠相比,F0代VDR-/-小鼠小肠和胸腺组织中VDR转录水平升高,且差异有极显著性(P< 0.01),肺组织中呈显著升高(P< 0.05),睾丸组织中也呈现升高趋势,但差异无显著性,肾和皮肤组织中VDR转录水平表达量呈降低趋势,且差异不显著,如图6(a)所示。F1代VDR-/-小鼠各组织中VDR转录水平均呈升高趋势,其中肺、皮肤、小肠和睾丸组织中差异极显著(P< 0.01),胸腺组织中差异有显著性(P< 0.05),但肾组织中差异不显著,如图6(b)所示。
Western blot检测F0代VDR-/-小鼠和VDR+/+小鼠皮肤、小肠、肾、睾丸、肺等组织蛋白表达水平,如图7所示,VDR+/+小鼠中各组织均有VDR表达,而VDR-/-小鼠中都未检测到VDR蛋白水平表达,说明VDR敲除成功。
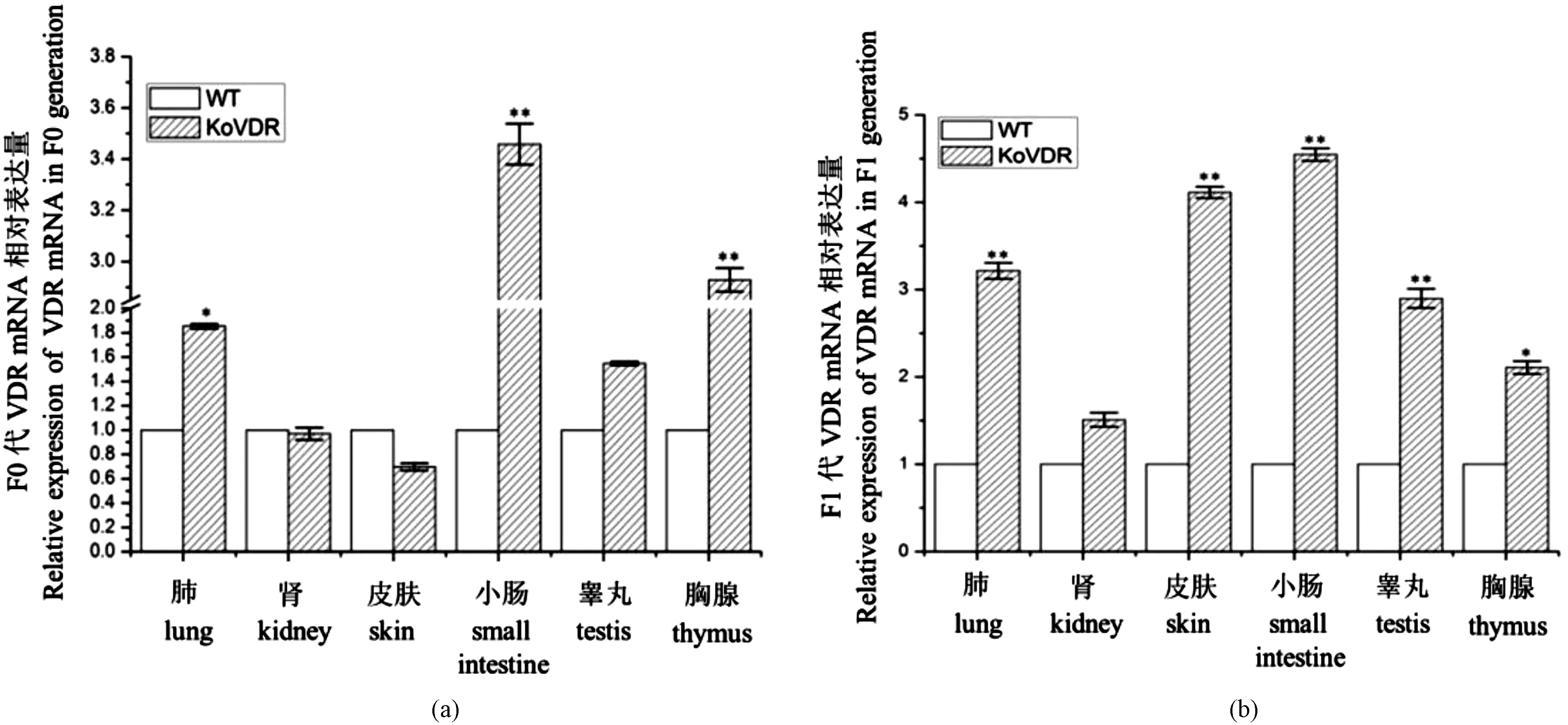
注:(a) F0代VDR-/-小鼠与VDR+/+小鼠不同组织VDR基因表达水平;(b) F1代VDR-/-小鼠与VDR+/+小鼠不同组织VDR基因表达水平;*P< 0.05,**P< 0.01。图6 F0代、F1代VDR-/-小鼠与VDR+/+小鼠不同组织中VDR转录水平分析Note. (a) VDR gene expression levels in different tissues of F0 generation VDR-/- mice and VDR+/+ mice. (b) VDR gene expression levels in different tissues of F1 generation VDR-/- mice and VDR+/+ mice; *P< 0.05, **P< 0.01.Figure 6 Analysis of VDR transcriptome levels in different tissues of F0 and F1 generations VDR-/- mice and VDR+/+mice

图7 Western blot检测F0代VDR-/-小鼠与VDR+/+小鼠不同组织中VDR蛋白表达Figure 7 Western blot detected VDR protein expression in different tissues of F0 generation VDR-/- mice and VDR+/+mice
3 讨论
基因敲除是研究基因功能不可缺少的逻辑环节[14],也是最直接的手段之一[15],为疾病发生发展、药物筛选以及活体和整体水平的研究提供了有力手段[16]。最近几年来,该领域技术发展迅速,基因敲除模型被广泛应用于生物学和医学研究领域。但是,敲除鼠品系建立又受敲除基因功能的限制,基因敲除小鼠的某些功能丧失,可能造成生长发育或生殖功能障碍[17],因此不易获得纯合型后代。本研究发现VDR-/-小鼠互交后,大多数小鼠无子代产生,仅有两只能够产生子代。由此推断,VDR基因缺失后可能影响雌雄小鼠的生殖能力,但目前机制尚不清楚,有待后期验证。另外,采用VDR+/-互交方式,子代小鼠出现三种基因型:纯合型(VDR-/-)、杂合型(VDR+/-)和野生型(VDR+/+),其比例接近1∶2∶1,VDR-/-可以用于后续功能研究,VDR+/-则可用来保种。
对于VDR-/-小鼠,本研究通过qPCR技术检测各组织中VDR基因的转录水平,发现F0和F1代VDR-/-小鼠VDR转录水平均有明显升高。同时,通过Western blot检测不同组织中VDR蛋白表达情况,在各组织中未检测到VDR表达,这一结果与本研究的预期结果一致。本研究的VDR敲除鼠品系是基于实验室前期通过CRISPR/Cas9技术构建的F0代VDR敲除鼠建立的,VDR敲除的机理是在VDR基因外显子上5 bp的小片段删除,导致VDR基因无义突变,无法产生完整有功能的VDR,因此Western blot检测不到蛋白表达,说明VDR敲除是成功的。由于VDR敲除仅仅是5 bp小片段删除,其转录机制没有受到影响,仅仅是mRNA翻译的提前终止,无法产生有功能的完整VDR,由于VDR是一个广泛存在的转录因子,机体不同组织生理功能的发挥都需要VDR,因此生物体就会通过自身调控机制进一步加强VDR基因转录水平,所以敲除鼠的VDR基因转录水平就会升高,这一结果符合生物体基因表达调控的基本原理。另外,由于不同组织对VDR的需求程度不同,不同组织之间会有差异,但具体调节机制还有待进一步的研究。基于前期的表型分析、测序分析、qPCR和Western blot检测结果,本研究筛选出以F0代VDR-/-10#为父本进行VDR敲除鼠品系建立,VDR基因上5 bp的片段删除导致了VDR发生无义突变,导致其功能的丧失,通过VDR-/-与VDR+/+,VDR+/-与VDR+/-及VDR+/-与VDR+/+不同交配模式最终建立VDR敲除鼠品系,为后续VDR功能研究提供了良好的实验模型。

